冰温贮藏羊肉电阻抗特性及肉品质相关性分析
2019-01-28王政纲赵丽华
王政纲,赵丽华,苏 琳,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
随着生活水平的提高,人们对食品的安全性、天然性、新鲜度要求越来越高。冰温保鲜是指将食品在0 ℃以下、冰点以上温度区域内进行贮藏[1],冰温保鲜作为继冷藏保鲜和气调保鲜之后的第三代保鲜技术[2],已被广泛应用于果蔬、水产品、牛羊肉类保鲜贮藏中[3-6]。冰温保鲜虽然能显著提高羊肉品质,但由于冰温保鲜羊肉贮藏在近冰点温度((-1.0±0.6)℃)条件下,所以相对于常规冷却肉,冰温保鲜羊肉经历僵直、解僵、成熟几个宰后生理阶段的周期要大幅延长,而羊肉在不同的宰后生理阶段,肉品质特性会存在比较大的差异[7-8]。常用的宰后肉品质监测指标包括:肌肉pH值、剪切力、保水性等[9],但是上述指标受个体差异影响较大,不能单一使用,需要结合其他指标评价肉品质,而且指标测定的方法操作复杂、耗时长,不能实现实时在线快速监测肉品质。因此有必要找到一种简便、快捷、有效的冰鲜羊肉宰后各个阶段品质变化的实时监测方法。
生物组织的电学阻抗特性是用来评价生物组织生理状态的一种方法[10]。生物组织是由大量形状不同的细胞组成,细胞液被细胞膜分隔为细胞内液和细胞外液。就阻抗特性而言,细胞内液和细胞外液常被看作电解液,细胞膜视作电容。当施加于生物组织不同频率的电流时,生物组织的阻抗特性会随之发生相应的变化,表现出不同的电阻抗特性;细胞内阻Ri、细胞外阻Re、细胞膜电容Cm,称为生物组织的RC三元件等效电路模型,因此可从电学阻抗特性层面上来分析肌肉组织的各种生理生化变化[11]。目前,电学阻抗技术已被应用于牛胴体产出率预测[12]、牛肉肌纤维强度评估[13]、冻鸡肉和未经冻结处理样的区分判别[14]、猪肉细菌总数含量和挥发性盐基氮含量的预测[15]。宰后肌肉组织中各种离子的释放,必然引起组织细胞内液和细胞外液的变化及细胞膜结构的破坏[16]。宰后肌肉组织的生化反应变化会导致肌肉组织电阻抗特性变化;因此,可以利用肌肉的电阻抗特性预测肌肉的品质特性,但利用电阻抗特性预测宰后羊肉品质变化的研究还鲜有报道。艳茹[17]对牛肉宰后生物阻抗特性进行了初探实验,得出了宰后牛肉成熟过程中阻抗特性(极化系数f、介电损耗tan δ、特征频率fc)的变化规律,但未能建立阻抗特性与肉品质之间的关系。
本研究通过对宰后冰温贮藏羊肉的电阻抗特性参数(阻抗复数Cole-Cole曲线、细胞内阻Ri、细胞外阻Re、细胞膜电容Cm、松弛因子α)分析,揭示宰后冰温贮藏对羊肉电阻抗和肉品质的影响,通过宰后电阻抗和肉品质的相关性分析,实现利用阻抗特性评估羊肉品质的目标。
1 材料与方法
1.1 材料与试剂
于呼和浩特市和林格尔养殖基地选取饲养方式相同、体质量40~50 kg的8 月龄绵羊32 只。采用清真屠宰方式,宰前休息2 h,宰后1 h内采取肉样。
1.2 仪器与设备
LG-BCD冰温冷藏箱 泰州乐金电子冷机有限公司;C-LM3数显式肌肉嫩度仪 东北农业大学工程学院;pH-STAR型胴体直测式pH计 北京奥依克光电仪器有限公司;数控精密恒温水浴锅 上海福玛实验设备有限公司;电子精密天平 德国Sartorius公司;TC-P2A全自动测色色差计 北京普析通用仪器有限责任公司;DZ-400/2S型真空包装机 山东省诸城市利德机械有限责任公司;PY-1型膨胀压缩仪 南京电力自动化设备厂;四极式生物阻抗测量仪 华中科技大学生命科技学院。
1.3 方法
1.3.1 肉样预处理
绵羊宰后,取左后腿股二头肌,平均分割为10 块,大小为5 cm×4 cm×2 cm,每块40 g左右,32 只羊共计分成320 份肉样,用聚乙烯包装袋(150 mm×200 mm×0.10 mm)进行真空包装。肉样包装之后,随机分成两组:一组在包装(宰后2 h)之后,直接放入(-1.0±0.6)℃冰温箱中贮藏至宰后216 h,设为正向组;另一组在包装之后放入-34 ℃冷库中速冻6 h,宰后8 h时放到(-1.0±0.6)℃冰温箱中贮藏至宰后216 h,设为负向组。对于两组样品,宰后每隔24 h(中间包括宰后8 h)对肉样的pH值、失水率、色差、剪切力和阻抗值等指标分别进行测定。
1.3.2 阻抗参数的测定
阻抗测量采用四针式电级法[18],电极间距1 cm,电极长为2 cm,测量时沿肌纤维组织横向插入电极约1 cm(图1)。通过生物电阻抗测量仪在5~200 kHz范围内取12 个频率点(5、10、20、40、60、80、100、120、140、160、180、200 kHz),频率由低到高,测定每个样品的阻抗幅值和相位角特性,利用迭代式最小二乘算法拟合出肉样等效阻抗参数:细胞内阻Ri、细胞外阻Re、细胞膜电容Cm、松弛因子α及阻抗复数曲线(Cole-Cole曲线)。在测量各个贮藏时间点的理化指标时同时测定阻抗指标,每次每组取16 个样本的平均值,作为该贮藏时间点的阻抗参数测定指标。

图1 阻抗测定方向示意图Fig.1 Schematic of electrical impedance tests
1.3.3 pH值的测定
pH值按照GB/T 9695.5—2008《肉与肉制品pH测定》[19]的方法进行测定。将pH计插入羊肉中,记录其pH值,每个样品重复测定3 次。
1.3.4 失水率的测定
失水率按照参考文献[20]进行测定。用膨胀压缩仪对面积为5 cm2、厚度为1 cm的羊肉样施加68.66 kPa的压力,失水率越大,则说明保水性越差,按下式计算失水率。

式中:m1为施压前肉质量/g;m2为施压后肉质量/g。
1.3.5 色差的测定
将肉样切成3 cm×3 cm×1 cm左右的肉块,用色差仪测定肉样的a*值(红度)。1.3.6 剪切力的测定
按照陈槟颖[21]的方法测定剪切力。将肉样同聚乙烯封口袋一起放入80 ℃水浴中加热1 h,之后取出冷却至室温,将肉样沿肌纤维方向切成1 cm×1 cm×2 cm的条状,用数显式肌肉嫩度仪进行测定,记录剪切力,每个样品进行3 次平行实验。
1.4 数据分析
实验数据使用Excel软件进行处理,使用IBM SPSS Statistics 19.0软件进行Pearson相关性分析,采用Duncan式多重比较进行差异显著性检验分析,P<0.05表示差异显著。
2 结果与分析
2.1 宰后羊肉贮藏过程中阻抗特性的变化
2.1.1 宰后羊肉贮藏过程中阻抗复数曲线(Cole-Cole曲线)的变化

图2 宰后不同时间羊肌肉组织的Cole-Cole图Fig.2 Cole-Cole plots of mutton muscle samples during postmortem aging
频率对正、负向贮藏的羊肌肉组织影响也相同,频率低时,肌肉组织的实部和虚部均随贮藏时间的延长显著减小,频率高时则变化不大。这是由于低频时肌肉组织的阻抗主要体现为细胞外液的电阻,因此肉样阻抗较大;随着频率的增加,电流不仅能够流经细胞外液,也能直接通过细胞膜流入细胞内部[24],使肌肉组织的电导率升高,而阻抗值降低。对于负向贮藏组,由于宰后对肉样进行了冷冻处理,使肌肉组织的细胞膜结构遭到一定的破坏,相应地降低了细胞膜的容抗特性,进而使肌肉组织阻抗显著降低(P<0.05)。
2.1.2 宰后羊肉贮藏过程中细胞膜电容Cm的变化
细胞膜电容Cm是衡量肌肉细胞膜完整性的重要指标,其值越小,肌肉细胞膜破损的程度越大,胴体的贮藏时间越长,肉的新鲜度越低[23]。
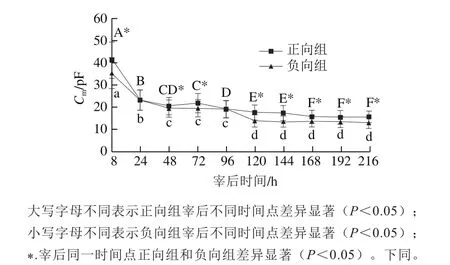
图3 宰后不同时间羊肌肉组织Cm的变化Fig.3 Change in Cm of mutton muscle samples during postmortem aging
由图3可知,在整个冰温贮藏过程中,随贮藏时间的延长,正向、负向组的Cm均逐渐降低,宰后8 h的Cm分别为41.20、35.47 pF,宰后216 h的Cm分别为15.32、12.95 pF;这说明肌肉细胞膜作为介电绝缘体,它的绝缘性能随着细胞膜磷脂层的氧化和宰后细胞自身的溶解而减小,使细胞膜的渗透性增强,Cm逐渐减小[25]。负向组降低程度更大,除宰后24 h和96 h时间点外,其他时间点两组差异性均显著(P<0.05),这可能是由于负向组在宰后进行了冻结处理,使得骨骼肌细胞膜的完整性受到一定程度的挤压破损,导致Cm降低。
2.1.3 宰后羊肉贮藏过程中细胞内阻Ri的变化
细胞内阻Ri是衡量生物细胞内液导电能力大小的指标。对于生物体,细胞内的离子强度越大,细胞内阻Ri越小,细胞的阻抗越小,导电能力越大。

图1 宰后不同时间羊肌肉组织Ri的变化Fig.1 Changes in Ri of mutton muscle samples during postmortem aging
由图4可知,随着贮藏时间的延长,正、负向两组样品的细胞内阻Ri均呈现先增加后降低再趋于稳定的趋势,在宰后24 h时羊肉的Ri达到最大值,分别为18.68、16.76 Ω。宰后8~48 h内,在相同贮藏时间下,正向组样品的细胞内阻Ri显著高于负向组样品(P<0.05);这可能是由于负向组宰后经冻结后,肌肉组织内质网和线粒体中的Na+、Cl-和K+等离子更快地从细胞器中被释放出来,细胞内离子强度增加,导电能力上升,阻抗能力减弱[26]。宰后72~216 h内,正向组样品的细胞内阻Ri与负向组样品总体差异性不显著(P>0.05)。说明宰后冻结处理对细胞内阻Ri值的影响主要体现在宰后肌肉僵直阶段,随着宰后羊肉成熟过程的进行,肌肉的细胞内阻Ri趋于稳定。
2.1.4 宰后羊肉贮藏过程中细胞外阻Re的变化
细胞外阻Re可以反映生物细胞外液导电能力的大小,细胞外的离子强度越大,细胞外阻Re越小,细胞的阻抗性越弱,导电性越强。

图5 宰后不同时间羊肌肉组织Re的变化Fig.5 Changes in Re of mutton muscle samples during postmortem aging
由图5可知,正、负向组样品的Re在宰后贮藏的过程中,均呈先上升后降低再趋于稳定的趋势。宰后24 h时正、负向组Re均达到最大,分别为347.3、283.3 Ω。Damez等[23]在研究宰后牛肉的介电特性时也得到类似结论。宰后8~144 h,正、负向组细胞外阻Re总体差异显著(P<0.05),其主要原因可能是宰后随着肌肉僵直、解僵、成熟过程的进行,肌纤维膜不断破裂,细胞内外离子交换强度加大,细胞内外形成渗透压差,细胞外离子强度增加,导电性逐渐增加,Re值在宰后24 h后逐渐减小[27-28]。宰后168~216 h,正、负向组细胞外阻Re没有显著性变化,但在同一宰后时间,正向组样品的细胞外阻Re显著高于负向组(P<0.05),到216 h时,正向组Re为135.1 Ω,负向组为81.2 Ω,这可能是由于负相组经过冻结后,肌细胞膜破裂程度加强,细胞内离子更快地流入细胞外,导致细胞外离子强度增强,Re降低。
2.1.5 宰后羊肉贮藏过程中松弛因子α的变化

图6 宰后不同时间羊肌肉组织的松弛因子α变化Fig.6 Changes in α of mutton muscle samples during postmortem aging
在生物组织中存在着大量大分子物质,这些分子在外加电场作用下,会获得电荷形成极性分子,产生感应电流,阻碍电流的自由通过。这种条件下,溶液中原有离子的均匀分布性会遭到破坏,但在热运动的作用下组织会产生复原力,此现象为松弛效应,松弛因子α大小表示生物组织中大分子的尺寸和构象[17]。由图6可知,随着贮藏时间的延长,正、负向组样品的松弛因子α整体上呈逐渐下降的趋势。这是由于随着成熟过程的进行,羊骨骼肌中的大分子物质逐渐分解,形成分子质量更低的物质。在整个贮藏过程中正、负向两样品的松弛因子α差异性不显著,正、负向组松弛因子α平均值分别为0.838、0.836;这说明宰后冻结处理不会对肌肉组织中大分子物质的尺寸和空间构象造成影响。
2.2 宰后羊肉贮藏过程中品质的变化
2.2.1 宰后羊肉贮藏过程中pH值的变化

图7 宰后不同时间羊肌肉组织pH值的变化Fig.7 Changes in pH of mutton muscle samples during postmortem aging
羊肉的pH值可以影响肉的颜色、风味、保水性、嫩度等品质,pH值受肌肉本身、成熟进程、微生物等因素的综合影响[9]。由图7可知,两组样品的pH值均呈现先降低后升高的趋势。在整个冰鲜贮藏过程中(刚宰后的前24 h除外),正、负向两组的pH值均处于5.9~6.2范围内,属于一级鲜肉[29]。宰后8~144 h内(宰后96 h除外),正、负向组之间pH值差异显著(P<0.05),贮藏48 h时pH值分别达到最低点,为5.95与6.04,负向组样品的pH值始终高于正向组;说明负向冷却处理有利于抑制pH值降低的速度,这可能是由于经过冷冻处理的羊肉中糖原降解相关酶类活性降低,乳酸产量减少,导致pH值相对较高。宰后168~216 h内,在贮藏时间相同情况下,正、负向组间pH值差异不显著,这可能是贮藏后期微生物的繁殖导致的。
2.2.2 宰后羊肉贮藏过程中失水率的变化
羊肉系水力在宰后的僵直和成熟期间会发生显著变化,在这期间肌肉组织内部会发生各种复杂的生理生化反应,导致肌原纤维蛋白质的网络结构紧缩和所带电荷数减少,使肌肉系水力下降,失水率增加。
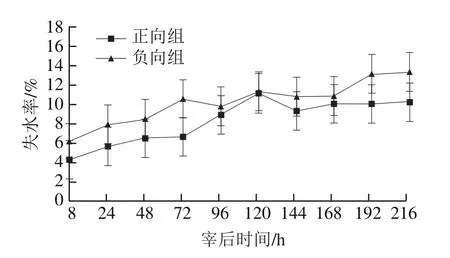
图8 宰后不同时间羊肌肉组织失水率的变化Fig.8 Changes in drip loss rate of mutton muscle samples during postmortem aging
由图8可以看出,随贮藏时间的延长,正、负向组羊肉的失水率均呈逐渐增大的趋势,到宰后216 h时,分别达到10.22%、13.39%。正向组样品的失水率在整个贮藏期整体小于负向组。可能是因为经过负向组冷冻处理后,肌纤维蛋白质的网络结构交联程度减少,肌肉系水力下降,汁液失水率提高;这说明宰后冷冻处理会导致汁液流失率升高,这与许立兴等[30]研究的结果一致。
2.2.3 宰后羊肉贮藏过程中色差的变化
肉色是评估羊肉新鲜程度和影响消费者接受程度的一项重要指标,因为对冰鲜羊肉而言,其色泽的a*值比L*值(亮度)、b*值(黄度)更重要,所以本实验只测定了a*值。

图9 宰后不同时间羊肌肉组织a*值的变化Fig.9 Changes in a* value of mutton muscle samples during postmortem aging
a*值反映肉颜色中红色的深浅程度,a*值越大,肉色越红。如图9所示,两组样品的a*值在宰后贮藏的过程中,均呈先缓慢上升再下降的趋势。在整个冰鲜贮藏过程中,正、负向组的a*值差异显著(P<0.05);这说明宰后冻结处理会对肌肉组织的a*值造成影响。刘萌[31]对宰后放置时间和冷冻对猪肉a*值的影响进行了研究,结果发现,在宰后144 h内,随宰后时间的延长,肉样的a*值均呈先升后降的趋势,经冷冻处理肉样解冻后a*值明显低于未经冷冻肉样a*值,此发现与本研究结果相似。
2.2.4 宰后羊肉贮藏过程中剪切力的变化
肉的嫩度是反映肉质地的指标,羊肉的嫩度主要受结缔组织含量、性质及肌原纤维蛋白的化学结构等因素的影响。嫩度的大小一定程度上可以用剪切力表征,剪切力越大,肉的嫩度越小。

图10 宰后不同时间羊肌肉组织剪切力的变化Fig.10 Changes in shear force of mutton muscle samples during postmortem aging
由图10可知,随贮藏时间的延长,两组羊肉的剪切力均呈缓慢上升趋势,且两组之间差异显著(P<0.05)。在216 h时剪切力达最大值,正、负向组分别为62.5、67.6 N,两组样品嫩度随贮藏时间处长不断下降可能是失水率增大导致的[32]。
2.3 宰后羊肉贮藏过程中品质与阻抗相关性分析

表1 正向冷却羊肉品质与生物电阻抗的相关性分析Table1 Correlations of electrical impedance properties with quality attributes of mutton muscle samples for positive direction group

表2 负向冷却羊肉品质与生物电阻抗的相关性分析Table2 Correlations of electrical impedance properties with quality attributes of mutton muscle samples for negative direction group
如表1所示,对于正向组,pH值在宰后8~72 h与Cm呈显著正相关(P<0.05);失水率在宰后8~216 h与Re呈显著负相关(P<0.05);宰后72~216 h,a*值与Re、Cm均呈显著正相关(P<0.05),剪切力与Re、Ri呈显著正相关(P<0.05)。这说明正向羊肉冰温贮藏期间阻抗特性与肉制品的相关性受宰后贮藏时间的影响很大。
如表2所示,对于负向组,pH值在宰后8~72 h与Cm呈显著正相关(P<0.05);失水率在宰后8~216 h与Re呈显著负相关(P<0.05),与Ri或Cm呈显著正相关(P<0.05);a*值在宰后72~216 h与Re、Cm呈显著正相关(P<0.05);剪切力在宰后8~72 h与Ri呈显著负相关(P<0.05),在宰后72~216 h与Re、Ri呈显著正相关(P<0.05)。这表明经负向冷却处理的羊肉贮藏过程中阻抗特性同样受贮藏时间的影响很大,而且负向冷却对阻抗特性与肉制品之间的相关性也有一定的影响。
3 结 论
羊肉在正、负向两种冰温贮藏条件下,两组样品的细胞内阻Ri和细胞外阻Re呈先增加后降低再趋于稳定的变化趋势,细胞膜电容Cm和松弛因子α整体上呈逐渐下降的变化趋势。在相同宰后贮藏时间,负向组各项阻抗指标整体上均小于正向组。正向组冷却羊肉在宰后贮藏时间内保水性、色差a*值、嫩度都优于负向组,负向组pH值高于正向组,表明正向冷却处理冰鲜贮藏羊肉品质优于负向冷却处理。正、负向羊肉冰温贮藏期间阻抗特性中只有Ri、Re、Cm在特定的宰后时间内与失水率、色差a*、剪切力、pH值有显著的相关性。综上所述,电阻抗特性参数在固定的冰鲜贮藏时期内可作为评价羊肉品质的指标,为冰温保鲜羊肉贮藏期间的肉品质监控提供参考。
