大鼠睾丸支持细胞的分离培养及鉴定
2018-07-13周可柔胡倩倩靳二辉顾有方李升和
张 倩, 周可柔, 胡倩倩, 任 曼, 靳二辉, 顾有方, 李升和
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
支持细胞(Sertoli cell),在精子发生和成熟过程中,具有支持、保护和营养生精细胞作用,促进雄激素结合蛋白(androgen binding protein,ABP)合成,ABP可与雄激素结合,以保持生精小管内雄激素水平,进而促进精子发生[1],使支持细胞体外培养研究成为探究雄性生殖细胞的基础,在生物学研究领域具有广阔应用前景。20世纪90年代初,Cameron创立了睾丸支持细胞的分离培养方法[2],目前国内外采用方法均由其沿袭而来,但由于其方法复杂,操作步骤繁杂、实验时间长、对细胞损伤大、睾丸支持细胞产量低;另外39 ℃下培养对细胞造成损伤,睾丸支持细胞活性低,不利于开展后续实验[3]。国内学者针对这些缺陷进行了许多改良,曹博等采用睾丸酶次第消化制成细胞悬液后[4],于37 ℃无CO2培养箱中培养48 h后,用胰蛋白酶和DMEM/F-12培养液吹打,有效去除了生精细胞和其他贴壁细胞,比39 ℃高温培养和低渗法去除生精细胞方法简便,并且获得支持细胞浓度达到90%以上[5]。
在睾丸支持细胞原代培养中,提高分离培养支持细胞纯度一直是其重点所在[6]。从睾丸组织中获得高纯度支持细胞可以采用机械分离法和酶法[7-10]。机械分离法难以获得大量高纯度细胞,酶法是体外培养时分离细胞最有效的方法[11]。本试验采用两步酶单次消化法,在前人研究的基础上缩短了酶消化时间,减少了对细胞的损伤,在37 ℃水浴震荡消化过程中可使睾丸曲细精管充分消化,细胞培养24 h后用预冷磷酸盐缓冲溶液(PBS)轻轻洗涤并更换新的完全培养液,提高细胞的收获量和纯度,同时在两步酶消化过程中可充分去除睾丸中的成纤维细胞、间质细胞和生精细胞。
1 材料与方法
1.1 材料
1.1.1试验动物3月龄清洁级Sprague Dawley(SD)大鼠(许可证号:SCXK(浙)2014-0001),购自浙江省实验动物中心。试验大鼠按照雌∶雄(3∶1)进行交配繁殖,饲养于全膜终端独立通气笼盒(Individual ventilated cages,IVC)内,严格按照IVC标准进行饲养。环境温度25~27 ℃,湿度55%~63%,光照12 h,饲喂颗粒饲料及蒸馏水,自由饮水和采食。试验用于交配繁殖生长的18~22日龄的雄性SD大鼠。
1.1.2试验饲料试验饲料:试验大鼠颗粒饲料(检验报告编号:2017-X-7386),购自南京市江宁区青龙山实验动物繁殖场。其营养水平为:粗蛋白≥18.15%,粗脂肪≥4.03%,粗纤维≥5.12%,粗灰分7.94%,钙1.43%,磷0.87%,硼1.96 mg/kg。
1.1.3试验试剂苏木精(国药集团化学试剂有限公司,北京)、伊红(国药集团化学试剂有限公司,北京)、DMEM高糖培养基(HyClone,美国)、胎牛血清(HyClone,美国,FBS)、青霉素-链霉素(Biosharp,美国)、PBS(HyClone,美国)、0.25%胰酶(GBICO,美国)、胶原酶IV型(Biosharp,美国)。
1.2 方法
1.2.1支持细胞的分离培养取交配繁殖的18~22 d雄性大鼠,颈椎脱臼致死,全身浸泡于75%酒精中,紫外灯下照射10 min,无菌操作取睾丸并置于预先加入4 ℃预冷的无菌PBS培养皿中,两次清洗睾丸表面黏液和血液,用眼科剪和眼科镊去除睾丸被膜及睾丸实质中的血管;然后置于青霉素瓶中,加入预冷PBS 3 mL,用眼科剪将睾丸实质剪碎为约1 mm3的碎块,静置3 min,用移液枪将上清液弃去,转移至15 mL离心管中;加入相当于离心管中睾丸实质4倍体积的0.25%胰酶,轻轻震荡,使睾丸实质中的曲精小管散开;37 ℃水浴消化15 min,期间每隔2 min震荡一次,观察组织碎块消化成线索状,加入1 mL FBS终止消化,1500 r/min离心5 min,弃上清液,再加5 mL PBS用1 mL移液枪轻轻吹打悬浮细胞,1 000 r/min离心5 min弃上清液;加入相当于离心管中睾丸实质4倍体积的0.1% IV型胶原酶,37 ℃水浴消化10 min,每隔2 min震荡一次,观察组织变成黏液状,再加入1 mL FBS终止消化,经100目金属网筛过滤收集滤液于离心管中,800 r/min离心5 min弃上清,再加入10 mL DMEM高糖完全培养基(含100 IU/mL青霉素+100 μg/mL链霉素+10% FBS),用1 mL移液枪轻轻吹打悬浮细胞,用细胞计数仪进行细胞计数。接着将细胞浓度调整为(0.5~1)×106/mL,接种于25 mL培养瓶中(5 mL/瓶),轻轻晃动,使细胞分散均匀,置于37 ℃、5% CO2、饱和湿度二氧化碳培养箱中培养,培养24 h后于倒置荧光显微镜下观察;然后用PBS轻轻洗涤一次,更换DMEM高糖完全培养基,培养3 d待细胞长至培养瓶的85~95%时进行细胞传代。
1.2.2支持细胞免疫荧光鉴定取分离培养所得细胞,制备细胞爬片,4%多聚甲醛固定。固定好的细胞爬片,用含0.1% Tris-HCl的PBS洗3次(Vimentin蛋白需要破膜,在细胞质中表达),每次5 min;3% H2O2室温处理15 min;PBS洗3次,每次5 min;滴加一抗Vimentin Antibody (1∶1000) 4 ℃过夜;室温平衡30 min;PBS洗涤3次,每次5 min;滴加Alexa Fluro 488-conjugated Affinipure G(H+L)二抗,37 ℃孵育2 h,PBS洗涤3次,每次3 min;加DAPI染15 min,PBS洗涤3次,每次3 min,荧光显微镜下观察并拍照。
1.2.3不同代支持细胞HE染色取不同代细胞,制备细胞爬片。PBS洗涤3次,每次2 min,95%乙醇固定20 min,PBS洗涤2次,每次1 min,苏木精染液染色2.5 min,蒸馏水冲洗,1%盐酸酒精分色5 s,自来水蓝化,伊红染色2 min, 70%、80%、90%梯度乙醇各洗涤一次,每次1 min,95%、100%乙醇洗涤2次,每次1 min,二甲苯洗涤3次,每次1 min,中性树胶封片,在显微镜下观察。
2 结果与分析
2.1 Vimentin免疫荧光鉴定睾丸支持细胞
以Vimentin表达阳性为支持细胞的鉴定标准。由图1可知,荧光显微镜下蓝色荧光椭圆形结构为支持细胞的细胞核(图1 B);绿色荧光为Vimentin表达阳性细胞结构,主要表达于细胞质,且Vimentin阳性表达率 > 95%(图1 A),表明该分离培养的细胞为睾丸支持细胞,其纯度达到95%以上(图1 C)。

图1 支持细胞Vimentin免疫荧光鉴定(400 ×;A.细胞质中Vimentin阳性表达;B.细胞核DAPI染色;C.A与B叠加图片 )
2.2 睾丸支持细胞原代培养的细胞形态变化
倒置相差显微镜观察可见,刚分离的支持细胞体积较小、呈圆形、折光性强(图2 A)。培养24 h后,可见少数细胞出现突起并贴壁长出,细胞周边有光圈现象,同时可见少部分圆形细胞悬浮于细胞瓶中(图2 B);培养48 h后,可见大多数细胞均已贴壁,细胞扁平、形态不规则,胞体增大并可见多个突起,少部分细胞开始呈膜状铺在培养瓶壁上,悬浮的细胞明显减少近乎消失,细胞核和细胞质更加明显(图2 C);培养72 h后更换完全培养基,观察可见培养的细胞体积明显增大,细胞质增多,细胞之间融合成片,折光性减弱,细胞核更加明显,悬浮的细胞消失,此时可进行传代培养(图2 D)。
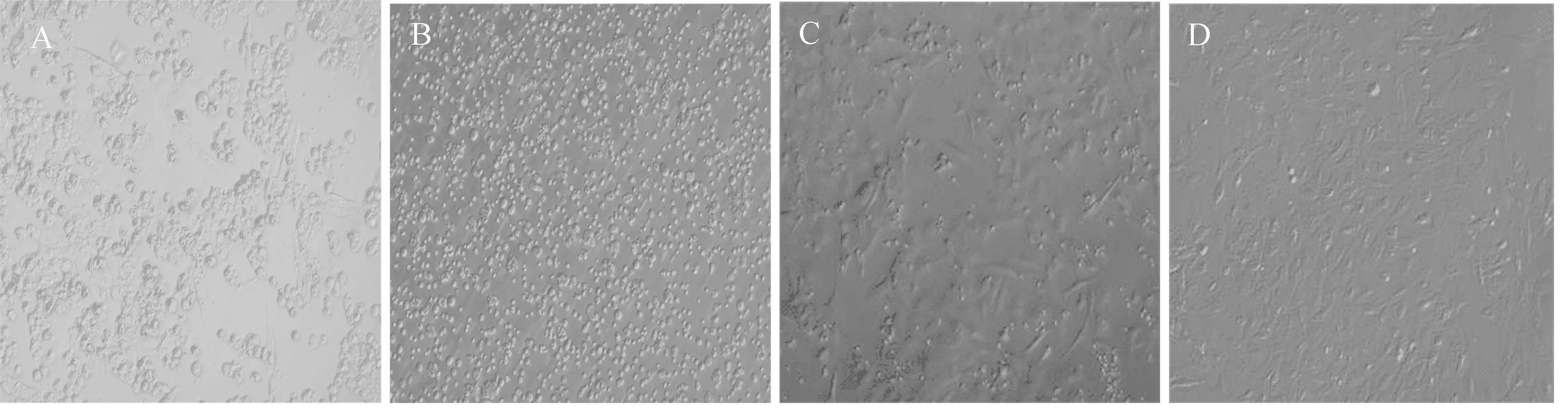
图2 睾丸支持细胞原代培养细胞形态化 (100 ×;A:1 h;B:24 h;C:48 h;D:72 h)
2.3 睾丸支持细胞传代培养的细胞形态变化
倒置相差显微镜观察活细胞及光镜下观察HE染色细胞爬片(图3)可见,分离培养的第1代睾丸支持细胞贴壁伸展的形态不均匀,胞体伸出的突起较少,细胞间连接不紧密,并有少量细胞悬浮(图3 A、E、I)。第2、3代睾丸支持细胞贴壁形态趋于稳定并且分布较为均匀,细胞生长速度较快,细胞体积增大、胞质丰富,胞核呈卵圆形;细胞突起增多、排列紧密、相互间连接呈片状(图3 B、F、J;图 3 C、G、K);第4代睾丸支持细胞生长速度慢,细胞突起萎缩,胞体体积变小,胞核固缩或变形裂解,细胞分散排列(图3 D、H、L)。鉴于以上结果,试验将选用细胞形态稳定、增殖速度较快的第2、3代睾丸支持细胞为佳。

图3 睾丸支持细胞传代培养细胞形态
3 结论与讨论
睾丸支持细胞的分离培养方法相关文献报道较多,但目前国内分离培养支持细胞的方法均较复杂繁琐,包括称量睾丸湿重、2次消化及过滤、多次离心等,其操作步骤多,所需时间长,分离培养的支持细胞纯度为80%左右[12]。此外,由于睾丸支持细胞在睾丸中所占比例很低,因此分离的纯度常受到生精细胞及间质细胞的影响[13]。试验显示,胚胎鼠睾丸中生精细胞较少或不存在,支持细胞的纯度很高但睾丸支持细胞产量亦较低;成年鼠睾丸中含有大量的生精细胞,故分离所得睾丸支持细胞纯度较低[14]。金向阳等研究选用28~30日龄wistar大鼠,所分离培养得到的支持细胞占细胞总数的80%左右[15]。王炜等采用16~22日龄SD大鼠处于青春前期至青春期,分离得到的睾丸支持细胞的数量达到90%[16]。本试验选用18~22日龄SD雄性大鼠,因该日龄段大鼠睾丸尚未下降到阴囊,仍在腹腔,故支持细胞分离较为简单,并且比较容易纯化,分离的细胞生长速度也较快,分离纯化后支持细胞的数量较多。
不同的分离方法得到的睾丸支持细胞的数量和纯度也不相同,实验室中常采用机械法和酶消化法[10]。有的学者采用单一酶消化法,有的采用组合酶消化法,还有采用酶消化法与机械法共同作用[17-18]。本试验分离过程采用胰酶和Ⅳ型胶原酶37 ℃水浴震荡消化,从而缩短了消化时间,减少了对细胞的机械损伤,且细胞消化彻底,分离得到的支持细胞数量较多,纯度较高。此外,培养24 h时用预冷PBS轻轻洗涤一次,加入新的培养液,可以去除部分未贴壁的其他细胞,在细胞长满85%以上进行传代,纯化细胞,此步骤简化了以前学者采用39 ℃高温培养和低渗法去除生精细胞的方法。
分离培养的睾丸支持细胞常用HE染色、甲基绿-派洛宁染色和Feulgen染色和透射电镜可以鉴定支持细胞[19]。其中Feulgen染色主要用来检测细胞核中的卫星核小体,该鉴定方法条件苛刻,稳定性差,常需要反复试验才能获得理想的染色效果[20],为了克服Feulgen染色鉴定方法稳定性差缺点,常采用免疫标记法鉴定支持细胞,如FAS-L、P-胎盘钙黏蛋白或波形蛋白标记法等[21-22]来鉴定睾丸支持细胞。本文采用Vimentin免疫荧光鉴定,Vimentin蛋白与Vimentin抗体特异性结合,可见95%的细胞Vimentin阳性表达于细胞质中,表明分离培养的细胞为睾丸支持细胞,且细胞纯度达95%以上。倒置相差显微镜下观察,本试验分离的大鼠睾丸支持细胞在培养6 h后细胞开始贴壁生长,培养24 h后,大多数支持细胞已经贴壁,细胞形态呈圆形或椭圆形,少部分支持细胞开始生长呈长柱型或梭形,细胞的细胞核呈圆形或椭圆形,还有少数细胞悬浮在细胞培养瓶上。这与韩晓冬等人分离的大鼠睾丸支持细胞形态一致,细胞培养24 h之后,大多数细胞开始贴壁,细胞形状呈圆形或椭圆形,培养液中漂浮着较多生精细胞[23]。
综上所述,本试验通过改进大鼠睾丸支持细胞的分离培养方法可获得大量纯度较高、活性较好的睾丸支持细胞,这为后续的试验奠定了良好的基础。
