十种添加物对红曲菌monacolin K产量的 促进效果分析
2018-07-11柴诗缘张安安张晨曦王成涛
柴诗缘,张安安,梁 健,张晨曦,王成涛,张 婵,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.北京市食品添加剂工程技术研究中心,北京 100048;3.中国农业科学院农产品加工研究所,北京 100193)
红曲菌是我国重要的药食两用微生物资源之一,其发酵产品红曲在我国及东南亚地区有上千年的应用历史,主要用于食品色素、医药、酿酒等方面[1]。红曲菌能够产生多种次级代谢产物,包括monacolin K[2]、红曲色素[3-4]、γ-氨基丁酸[5-8]、麦角固醇[9]、桔霉素[10]等。研究发现,红曲菌中monacolin K具有抑制胆固醇合成中关键酶HMG-CoA活性的作用[11],所以能够有效的抑制胆固醇合成,显著降低其含量,红曲中monacolin K是1979年日本学者远藤章首次分离得到的[12]。近年来,随着人们对红曲药用、生理价值的深入研究,已经开发出对高血压、高血脂等具有显著疗效的功能性红曲产品,如血脂康、脂必妥等。现代研究表明,作为胆固醇合成抑制剂的monacolin K具有高效、低毒、安全等特点[13],是目前医药界公认的降低胆固醇的理想药物之一,因此引起科研工作者的深入研究。
红曲菌中monacolin K活性成分含量偏低、生产成本高等因素,严重制约了功能性红曲在降脂降压方面作用的发挥,以及功能红曲产品的大规模产业化发展。近年来,为了提高功能红曲的品质,研究人员在优化发酵条件等方面进行了大量深入而细致的研究工作,如Rashmi Dikshit[14]和Lijuan Yu[15]等人通过响应面法对培养基发酵条件进行优化来提高monacolin K产量;陈小林[16]、马义芝[17]和赵树欣[18]等人通过在培养基中添加不同的诱导物来促进monacolin K的合成。由于实验菌株、处理方法及检测方法不同,不能很好的确定哪种添加物是最佳诱导物。因此,本文比较了目前已见报道的对于提高红曲菌monacolin K产量的10种添加物,采用同一菌株,同样的发酵条件、处理方法及检测方法,探寻针对紫色红曲菌的一种最佳添加物,同时也对这10种添加物对红曲色素和桔霉素的影响进行检测,为实现功能红曲高产提供理论依据参考。
1 材料与方法
1.1 材料与仪器
紫色红曲菌菌株(MonascusPurpureus)M1 本实验室保存;葡萄糖、琼脂、甲醇,色谱纯 北京奥博星生物技术责任有限公司;甘油、PDA、YPD 北京半夏科技有限公司;monacolin K(纯度≥98%)、桔霉素(纯度≥98%) Sigma公司。
LDZX-75KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;M-pact AX124型分析天平 上海欢奥科技公司;HZQ-F160型全温振荡培养箱 太仓市实验设备厂;PHS-3D功能型pH计 上海三信仪表厂;20A型高效液相色谱仪、UV-2450型紫外可见光分光光度计 日本岛津公司;超净工作台 北京东联哈尔仪器制造有限公司;SU8010型扫描电子显微镜 日本日立公司。
1.2 培养基
马铃薯固体培养培养基[19](PDA)(g/L):葡萄糖20,蛋白胨3,酵母浸粉4,麦芽浸粉20,琼脂20,KH2PO42,NaNO32,MgSO4.7H2O 1。普通液体种子培养基[19](g/L):葡萄糖30,豆粕粉15,蛋白胨10,甘油70,KH2PO42,NaNO32,MgSO4.7H2O 1。普通液体发酵培养基[19](g/L)(空白对照组):甘油90,大米粉20,蛋白胨10,KH2PO42.5,NaNO35,MgSO4.7H2O 1,ZnSO4.7H2O 2。山药粉-发酵培养基[17](g/L):在普通液体发酵培养基中按3%(V/V)加入山药粉。桔皮粉-发酵培养基[16](g/L):在普通液体发酵培养基中按2%(V/V)加入桔皮粉。酵母菌液-发酵培养基[18](g/L):YPD培养基30 ℃平板培养1 d酵母细胞,用接种环刮取1环菌体接种到YPD液体培养基中,30 ℃、200 r/min培养1 d,制备酵母菌液。向普通液体发酵培养基中按10%(V/V)的接种量接入酵母菌液。酵母上清液-发酵培养基[18](g/L):发酵1 d后的酵母菌液经12000 r/min离心15 min后取上清,按2.67%(V/V)的接种量接入普通发酵培养基中。酵母破壁液-发酵培养基[18](g/L):发酵1 d后的酵母菌液经12000 r/min离心15 min,无菌水洗涤后在灭菌的研钵中研磨10 min后12000 r/min离心15 min,取上清即为酵母破壁液。向普通液体发酵培养基中按2.67%(V/V)的接种量接入酵母破壁菌液。破壁后的酵母菌液-发酵培养基(g/L):发酵1 d后的酵母菌液经12000 r/min离心15 min,无菌水洗涤后研磨10 min后12000 r/min离心15 min,取沉淀,按2.67%(V/V)的接种量接入普通发酵培养基中。亮氨酸-发酵培养基[17](g/L):在普通液体发酵培养基中按10 mmol/L加入亮氨酸。谷氨酸-发酵培养基[17](g/L):在普通液体发酵培养基中按10 mmol/L加入谷氨酸。乙醇-发酵培养基[1](g/L):在普通液体发酵培养基中按2.5%(V/V)加入乙醇。优化培养基-发酵培养基[1](g/L):甘油90,葡萄糖50,蛋白胨10,KH2PO42.5,NaNO35,MgSO4·7H2O 1,ZnSO4.7H2O 2。
1.3 实验方法
1.3.1 菌种培养 菌株活化:将M1菌株在马铃薯固体培养基上30 ℃培养3 d,活化2代。
种子液的制备:用接种环刮取1环菌液到普通液体种子培养基中,30 ℃、200 r/min培养2 d。
发酵液的制备:按10%的接种量将种子液接种到普通液体发酵培养基中,25 ℃、150 r/min培养12 d。
1.3.2 不同添加物对红曲菌发酵产monacolin K、桔霉素和发酵液色价的影响 将M1菌株在种子液中培养2 d后,将种子液按10%的接种量分别接到普通液体发酵培养基、山药粉-发酵培养基、桔皮粉-发酵培养基、酵母菌液-发酵培养基、酵母上清液-发酵培养基、酵母破壁液-发酵培养基、破壁后的酵母菌液-发酵培养基、亮氨酸-发酵培养基、谷氨酸-发酵培养基、乙醇-发酵培养基和优化培养基-发酵培养基中。25 ℃、150 r/min培养12 d后,检测各培养基中monacolin K、桔霉素及色价产量。其中普通液体发酵培养基为空白对照组,其余的为实验组,进而确定最佳添加物。
1.3.3 谷氨酸添加量的研究 根据“2.1”的实验结果确定最佳添加物为谷氨酸,为探究谷氨酸的适宜添加量。本实验在10 mmol/L添加量附近选取8、9、11、12 mmol/L谷氨酸进行添加,将发酵液25 ℃、150 r/min培养12 d后对其monacolin K产量进行检测。
1.3.4 monacolin K的检测
1.3.4.1 发酵液的预处理 各取空白对照组和实验组发酵液5 mL,加入15 mL 75%的甲醇,超声波萃取30 min,静置过夜,取上清液经0.45μm的有机滤膜过滤,检测滤液中monacolin K含量。
1.3.4.2 monacolin K的检测 参考王兰[20]检测方法。将monacolin K标品分别稀释成5、20、50、80、100、150、200 mg/L标准溶液,然后经HPLC检测绘制标准曲线,根据标准曲线得到回归曲线方程:y=37558x+181164,R2=0.9986,其中横坐标(x)为浓度,纵坐标(y)为峰面积,R为相关系数。HPLC检测条件:色谱柱:InertsilODS-3 C18(150 mm×4.6 mm×5 μm),流动相:0.1%磷酸∶甲醇=1∶3,流速1 mL/min,检测器为紫外检测器,检测波长237 nm,检测温度30 ℃,进样量10 μL。
monacolin K产量计算公式:
1.3.5 桔霉素的检测
从J社区的拆迁案例可以看出,地方政府在回应有权势的钉子户抗争时,为了维持基层社会的稳定有序,总是在有限的范围内尽可能以“妥协让步”的方式寻求与钉子户的一致约定,这和以往的“硬策略”形成鲜明对比。因此,为了“避免出事”,地方政府在应对钉子户抗争上付出的成本和代价是高昂的。
1.3.5.1 发酵液的预处理 取发酵液5 mL,加入10 mL无水乙醇,超声破碎细胞15 min,60 ℃水浴振荡1 h,冷却至室温,取上清液经0.45μm的有机微孔滤膜过滤,检测滤液中桔霉素含量。
1.3.5.2 桔霉素的检测 参考黄艳[21]等检测方法。将桔霉素标品分别稀释成0.05、0.2、2、4、8、12、16 mg/L标准溶液,然后经HPLC检测绘制标准曲线。根据标准曲线得到回归曲线方程:y=6×106x+13203,R2=1,其中横坐标(x)为浓度,纵坐标(y)为峰面积,R为相关系数。HPLC检测检测条件:色谱柱:YMC-Triart C18(250 mm×4.6 mm×5 μm),流动相:乙腈∶水(磷酸调pH2.5)=35∶65,流速:1.2 mL/min,检测器:荧光检测器,激发波长λex=331 nm,发射波长λem=500 nm,柱温28 ℃,进样量20 μL。
桔霉素产量计算公式:
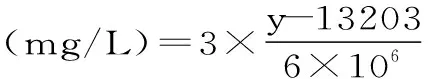
1.3.6 色价的测定 取发酵液5 mL,加入15 mL 70%的乙醇溶液,于恒温水浴锅60 ℃浸提1 h,静置。用分光光度计测定410、505 nm处吸光值。根据以下公式计算色价。
红曲红色素色价(U/mL)=OD505×稀释倍数
红曲黄色素色价(U/mL)=OD410×稀释倍数
1.3.7 生物量的测定 菌丝体生物量采用干重法测定:各取5 mL空白对照组和实验组的发酵液,用3层纱布过滤,再用蒸馏水洗涤2~3次,拧干水分,在60 ℃烘箱中烘干至恒重,即为菌丝体干重[22]。
生物量(g/L)=干物质质量/发酵液体积
1.3.8 扫描电镜处理 培养8 d 的红曲菌菌体,12000 r/min离心5 min收集菌体细胞,将细胞重悬于2.5%戊二醛溶液(PBS缓冲溶液稀释,pH7.2)固定12 h。扫描电镜样品处理方法具体参考Zhang[23]等,最后至样品成粉末状即可,Eiko IB-3 型离子溅射仪喷金,留待观察。
1.4 数据处理
实验操作重复三次,采用Excel进行数据计算,SPSS Statistics软件进行多重比较分析,Origin8.5软件进行绘图。
2 结果与分析
2.1 不同培养基中monacolin K产量的检测
由图1可知,当在普通培养基中添加山药粉和谷氨酸时,monacolin K产量与空白对照组相比差异极显著(p<0.01),产量分别提高了2.49和5.60倍,达到了107.7和203.8 mg/L;添加亮氨酸时,monacolin K产量与空白对照组相比差异显著(p<0.05),产量提高了1.12倍,达到了65.4 mg/L;添加酵母上清液和破壁后的酵母菌液时monacolin K产量也略有提高,但并不显著;添加酵母破壁菌液和乙醇导致monacolin K的产量降低;而添加桔皮粉则使monacolin K的产量降低至0。推测由于添加桔皮粉导致发酵液粘稠,溶氧降低后抑制红曲菌的生长,而红曲菌是好氧真菌,所以桔皮粉的添加对红曲菌的生长和monacolin K的合成有着抑制的作用。陈小林等[16]、马义芝等[17]、朱振元等[24]、赵树欣等[18]、吴学倩等[1]分别发现山药粉、谷氨酸、酵母破壁液、酵母、酵母上清液液、酵母细胞破碎液、葡萄糖代替大米粉都可以提高monacolin K的产量。但在本实验中,只有山药粉、谷氨酸和山药粉显著提高了monacolin K产量,其余物质对monacolin K产量的提高并不显著。
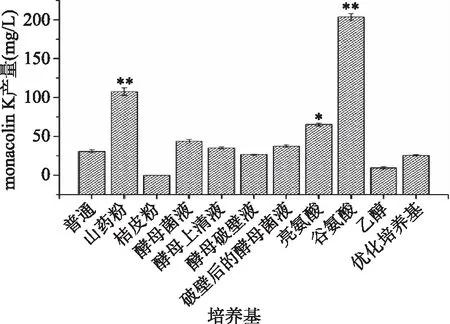
图1 不同培养基对monacolin K产量的影响Fig.1 Effects of different medium components on monacolin K production in Monascus注:与普通组相比,*代表差异显著(p<0.05),**代表差异极显著(p<0.01);图2、图3同。
2.2 桔霉素检测结果
结果如图2所示,其中添加酵母上清液、谷氨酸和桔皮粉的培养基桔霉素产量稍有变化,但并不显著;其余几种培养基桔霉素产量均极显著(p<0.01)的低于空白对照组;其中添加山药粉和乙醇的培养基桔霉素产量为0。马义芝[17]等人发现精氨酸和亮氨酸可以促进红曲霉桔霉素生成,而赖氨酸,甘氨酸,谷氨酸和酪氨酸抑制桔霉素的生成。结合2.1的实验结果综合考虑,添加谷氨酸即可以促进monacolin K的合成又不会显著的提高桔霉素的产量,所以选取谷氨酸为最佳添加物。
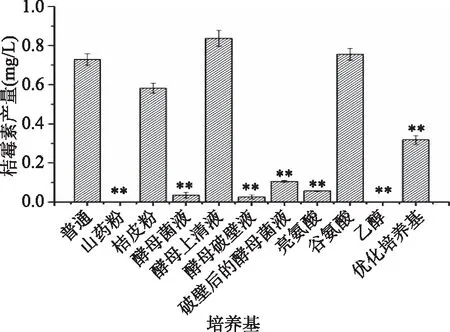
图2 不同培养基对桔霉素产量的影响Fig.2 Effects of different medium components on citrinin concentration in Monascus
2.3 色价检测
由图3可知,空白对照组红曲红色素为47.36 U/mL,红曲黄色素为35.2 U/mL。与空白对照组相比添加酵母菌液能极显著(p<0.01)的提高红曲红色素产量,提高了37.8%,产量为65.28 U/mL;添加山药粉和酵母上清液时能显著(p<0.05)的提高红曲红色素产量。当添加山药粉、酵母菌液、酵母上清液和破壁后的酵母菌液时,能极显著(p<0.01)的提高红曲黄色素的产量,其中添加酵母菌液后红曲黄色素产量为最高,提高了51.4%,产量为50.88 U/mL。赵树欣[20]等人也发现酵母菌液、酵母上清液和破壁后的酵母菌液可以提高红曲色素的产量。推测是因为红曲菌为抵御壳聚糖酶的作用,红曲菌自身产生疏水性物质如红曲色素。而添加桔皮粉、亮氨酸、谷氨酸、乙醇会对红曲色素产量产生抑制作用。据报道色素合成是一个需氧过程,而添加桔皮粉后培养基粘稠度增大,会使溶氧量降低。因此推测添加桔皮粉后会降低培养基溶氧量,从而降低色素产量。张斌[25]等人通过对比20种氨基酸对红曲色素的影响发现,亮氨酸和谷氨酸会降低红曲色素的产量,与本研究的结果具有一致性。
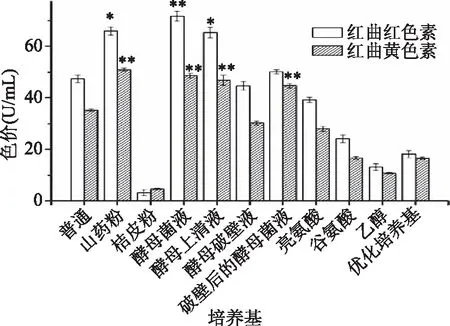
图3 不同培养基对红曲色素色价的影响Fig.3 Effects of different medium components on pigments value in Monascus
2.4 不同浓度谷氨酸培养基中monacolin K产量
通过检测十种培养基的发酵液,发现10 mmol/L谷氨酸的添加量可以显著提高monacolin K的产量,因此本研究通过优化谷氨酸的添加量进一步探究谷氨酸对红曲菌的最佳添加量。由图4可知,当谷氨酸的添加量为10 mmol/L时,monacolin K的产量最高,为217 mg/L,所以选取10 mmol/L为最佳添加量并进行后续实验。
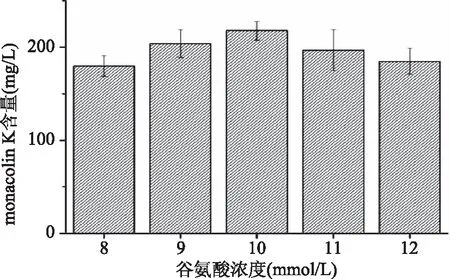
图4 不同浓度谷氨酸添加量的培养基中monacolin K产量Fig.4 The monacolin K production in the medium of different glutamate content
2.5 生物量的测定
通过对monacolin K产量的测定发现谷氨酸可以极显著(p<0.01)提高monacolin K 产量,所以对谷氨酸培养基中的菌体和普通培养基中的菌体进行生物量测定,对比其菌体生长情况。由图5可知,添加谷氨酸的培养基中菌体重量高于普通培养基中菌体重量,说明谷氨酸可能会促进菌体生长,进而提高monacolin K产量。
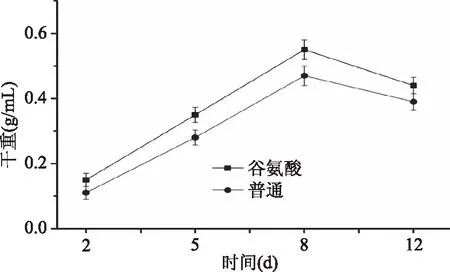
图5 谷氨酸与原始培养基中菌体干重变化情况Fig.5 The biomass in the glutamic acid medium and the original medium
2.6 扫描电镜分析
通过扫描电镜对谷氨酸培养基中的红曲菌菌丝体形态进行了观察,扫描电镜结果显示,与对照组相比,谷氨酸培养基中的红曲菌菌体表面出现皱缩、膨大、弯曲或断裂现象;对照组中菌丝更加饱满,菌丝体分枝顶端有单个或多个成链状的分生孢子,孢子呈球形或椭球形。通过图6中C、F对比可以看出添加了谷氨酸后的菌体皱缩现象更为突出,推测其细胞膜通透性增强[21],进而使胞内的monacolin K转移到胞外,从而使发酵液中monacolin K产量提高。
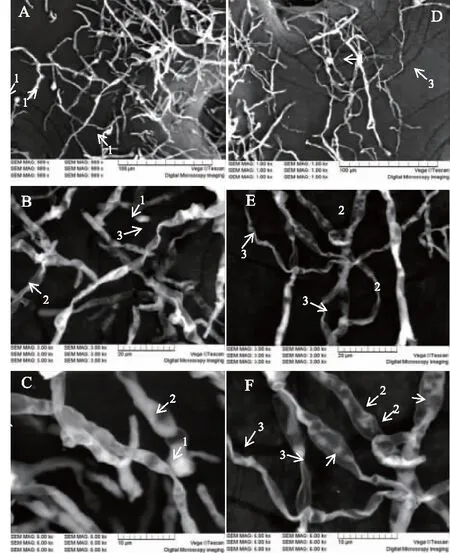
图6 不同培养基中不同放大倍数的红曲菌 M1 形态。Fig.6 M1 form of different magnification in different culture medium
3 结论
本研究发现添加山药粉、酵母上清液、破壁后的酵母菌液、亮氨酸与谷氨酸均能提高monacolin K产量,其中加入谷氨酸效果极显著(p<0.01),提升倍数为5.60倍;山药粉其次,提升倍数为2.50倍。结合桔霉素和色价的测定结果,发现添加山药粉后桔霉素产量大幅降低,红色素和黄色素产量增加,但monacolin K产量较低;而添加谷氨酸虽然对桔霉素产量影响不显著,且红色素和黄色素产量降低,但可以显著促进monacolin K合成,所以选取谷氨酸为最佳促进monacolin K合成的添加物。本研究又进一步探寻了谷氨酸的最佳添加量,发现谷氨酸添加量为10 mmol/L时monacolin K产量最高,为217 mg/L。通过扫描电镜观测菌丝体形态变化发现,谷氨酸会使红曲菌菌体表面皱缩、膨大、弯曲或断裂现象增多。
