牙鲆鱼、多宝鱼肌原纤维蛋白性质比较
2018-07-11夏俪宁董秀萍潘锦锋
夏俪宁,贾 慧,李 琦,徐 畅,董秀萍,潘锦锋
(大连工业大学食品学院 国家海洋食品工程技术研究中心 辽宁大连 116034)
牙鲆鱼(Paralichthysolivaceus),别名鲆鱼,为硬骨鱼纲、鲆科,是比目鱼的一类。多宝鱼,学名大菱鲆(Psettamaxima),为硬骨鱼纲鲽形目鲆科菱鲆属海洋底栖鱼类。以上两种鱼都属鲆鱼类,因肉质白嫩、鲜美可口受到消费者的喜爱。2016年我国鲆鱼产量为11.8万吨[1]。
鱼肉是一种优质的食物资源,蛋白含量高、脂肪含量低,且所含脂肪多为不饱和脂肪酸[2-3],营养价值高。鱼肉及鱼肉制品呈现的结构、形态、色泽、香气、味道等性质,主要取决于各种鱼肉蛋白的功能性质在制备、加工或保藏中的理化性质的变化[4-5]。肌肉组织蛋白质通常可分为三类:肌原纤维蛋白(收缩性蛋白)、肌浆蛋白(代谢性蛋白)、基质蛋白(结缔组织蛋白)。肌原纤维蛋白是肌肉中最重要的蛋白质,又称为盐溶性蛋白,约占总蛋白的50%~55%,由肌球蛋白、肌动蛋白、肌动球蛋白和调节蛋白(原肌球蛋白、肌钙蛋白)等组成[6]。
肌原纤维是鱼肉的基本组成单位,研究表明鱼肉的许多加工特性与肌原纤维的特性息息相关。在鱼肉加工保藏过程中,肌原纤维结构与理化性质发生变化,导致鱼肉嫩度﹑保水性﹑胶凝性等发生改变[7]。
1 材料与方法
1.1 材料与仪器
牙鲆鱼815±5 g、多宝鱼887±5 g 购于大连市美林园农贸市场,活运至实验室。
Ca2+超微量ATP酶测试盒 南京建成生物工程研究所;改良型Bradford蛋白浓度测定试剂盒 上海生工生物工程有限公司;十二烷基硫酸钠(SDS) 上海生工生物工程有限公司;金龙鱼一级大豆油 益海嘉里食品营销有限公司;顺丁烯二酸 国药集团化学试剂有限公司;三羟甲基氨基甲烷(Tris)、BBI Life Sciences、氯化钾等试剂 均为分析纯。
Discovery HR-1流变仪 美国TA公司;μDSC微量热仪 法国SETARAM公司;Infinite200 NANO酶标定量测定仪 瑞士TECAN公司;UV-5200型紫外分光光度计 上海元析仪器有限公司;AE-6401垂直电泳仪槽 日本ATTO。
1.2 实验方法
1.2.1 蛋白质的提取分离 鲜活牙鲆鱼、多宝鱼冰水致死后宰杀去皮去刺,取背部肌肉,将其切成鱼块(2 cm×2 cm×2 cm),置于碎肉机中,制成肉糜,放于自封袋中,于-30 ℃冻存,6个月内用完。将肉糜加入5倍体积冰冷(4 ℃)的洗液0.05 mol/L KCl-20 mmol/L Tris-maleate(pH7.0)缓冲液作匀浆处理。高速均质3次,每次30 s,间隔20 s置于冰盒中,在10000×g、4 ℃条件下离心10 min,取沉淀,上清液为肌浆蛋白。在沉淀中加入5倍体积的0.6 mol/L KCl-20 mmol/L Tris-maleate(pH7.0)缓冲液,再次高速均质3次,每次30 s,间隔20 s置于冰盒中,10000 r/min、4 ℃条件下离心10 min,取上清液即为肌原纤维蛋白。采用 Bradford 法测定蛋白质浓度[8]。
1.2.2 肌肉蛋白形式测定
1.2.2.1 SDS-PAGE凝胶电泳 样品制备:将牙鲆鱼与多宝鱼肌浆蛋白、肌原纤维蛋白溶液调整质量浓度为7 mg/mL,采用10%分离胶,5%浓缩胶。以体积比为1∶1混合蛋白液与5×上样缓冲液,沸水浴5 min。进行SDS-PAGE凝胶电泳,以对比牙鲆鱼与多宝鱼的肌浆蛋白、肌原纤维蛋白的区别。
用ATTO 垂直电泳仪,电极缓冲液采用SDS-Tris-甘氨酸系统,15 mA/胶恒电流电泳直至溴酚蓝前沿离凝胶下端1 cm左右时结束。考马斯亮蓝-乙酸-甲醇溶液振荡染色过夜,去离子水冲洗,再用SDS-PAGE脱色液(50%的乙醇,9%的冰乙酸)脱色,直至条带清晰。最后用Bio-lmaging Systems MF-ChemBIS 2.0的凝胶成像仪(UV板)成像。
1.2.2.2 肌原纤维蛋白Ca2+-ATPase活性测定 将1.2.1提取的肌原纤维蛋白浓度调整至4 mg/mL,采用Ca2+超微量ATP酶测试盒进行测定。
我院中心药房麻精药品智能化管理系统的开发与应用…………………………………………………… 沈国荣等(9):1158
1.2.3 肌原纤维蛋白热特性
1.2.3.1 差示扫描量热法(DSC)分析 取1.2.1方法制备的蛋白溶液,准确称取样品(170±0.1 mg),置于氧化铝密封坩埚中,密封,在氮气保护下将氧化铝密封坩埚置于差式扫描量热仪中。从10 ℃开始,以1 K/min升温至70 ℃,得到牙鲆鱼、多宝鱼肌原纤维蛋白的DSC谱图。
1.2.3.2 动态流变学 取1.2.1方法制备的蛋白溶液,采用平行板直径为50 mm 的流变仪进行测定,分别将5 mg/mL的牙鲆鱼肌原纤维蛋白溶液及5 mg/mL的多宝鱼肌原纤维蛋白溶液上样于两个平板之间,调节板间的距离为 0.5 mm,除去四周过量的样品。实验条件:常应变率1 rads-1,摆动幅度1%,温度扫描以2.0 ℃/min的速率从20 ℃开始升温至80 ℃,随后降至25 ℃。
1.2.4 肌原纤维蛋白功能特性
1.2.4.1 乳化性的测定 取1.2.1方法制备的蛋白溶液,调节肌原纤维蛋白浓度至5、10、20 mg/mL,取3 mL蛋白液与10 mL大豆油混合,18000 r/min高速匀浆1 min制成乳状液,立即于容器底部取样50 μL,用0.1% SDS 溶液稀释100倍,剧烈振荡10 s后在波长500 nm处测定吸光值A,以同浓度SDS 溶液作空白[9]。室温放置10 min后再次取样测定。每一式样测定三次取平均值[10]。
其中乳化活性(Emulsifying Activity Index,EAI)和乳化稳定性(Emulsion Stability Index,ESI)计算公式:
EAI(m2/g)=(2×2.303×dil×A)/(C×φ×10000)
式中:dil-稀释倍数;A-乳化液吸光值;C-样品质量浓度(g/mL);φ-乳化液中油相比例(0.25)。
ESI(min)=(A0×10)/(A0-A10)
式中:A0-初始乳化液吸光值;A10-10 min后吸光值。
1.2.4.2 起泡性的测定 取1.2.1方法制备的蛋白溶液,调节肌原纤维蛋白浓度至1、2、5 mg/mL,置于室温20 min。取15 mL,室温下16000 r/min高速匀浆1 min。随后将溶液体系转移至25 mL量筒,计体积数A[11]。
其中起泡性(Foaming capacity,FC)和起泡稳定性(Foaming stability,FS)计算公式:
FC(%)=(VT/V0)×100
式中:VT-匀浆后总体积(mL);V0-匀浆前原始体积(mL)。
匀浆后体系室温下放置5 min后再次量取体积。
FS(%)=(Vt/V0)×100
式中:Vt-匀浆后室温下静置5 min后体积(mL);V0-匀浆前原始体积(mL)。
1.2.5 数据统计与分析 实验数据用SPSS 16.0软件处理分析,数据以平均值(average value,AV)±标准误差(standard error,SE)形式表示,采用单因素方差法分析数据,进一步以Duncan法进行多组平均数的差异水平分析,显著性水平设定为p<0.05。
2 结果与分析
2.1 SDS-PAGE凝胶电泳
如图1所示,A、B为7 mg/mL牙鲆鱼、多宝鱼的肌浆蛋白电泳图谱。本研究发现在66.4~44.3 kDa条带群中多宝鱼较牙鲆鱼多一条特异条带。在20.1~44.3 kDa间牙鲆鱼肌浆蛋白中较多宝鱼肌浆蛋白多两条较特异条带。该结果与蔡扬鹏等人对几种鱼肌肉蛋白的研究结果有明显差异[12]:鲤鱼在15.9 kDa处有一特异条带,草鱼则在41.1和35.9 kDa处有特异条带。C、D为7 mg/mL牙鲆鱼、多宝鱼的肌原纤维蛋白电泳图谱,与蔡扬鹏等人研究结果相似[12],牙鲆鱼与多宝鱼均在200 kDa处都有一个明显的条带,为肌球蛋白重链(myosin heavy chain,MHC),而在44.3 kDa左右也有明显的条带,为肌动蛋白。66.4 kDa处牙鲆鱼较多宝鱼多一条特异条带。牙鲆鱼与多宝鱼中肌浆蛋白以及肌原纤维蛋白特异条带的差别有助于种类的鉴别。
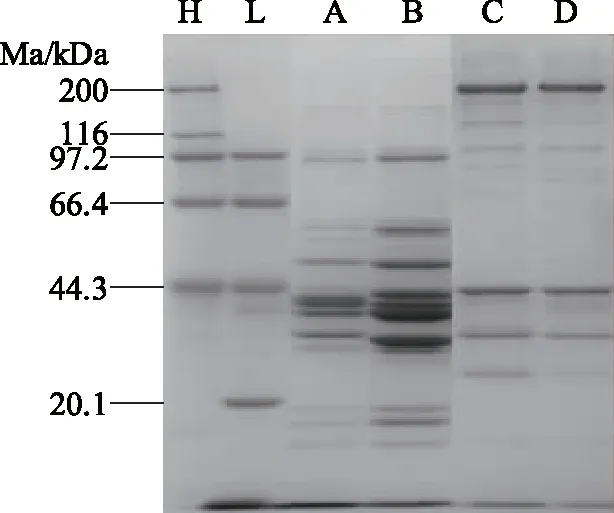
图1 牙鲆鱼、多宝鱼肌肉蛋白SDS-PAGE图谱Fig.1 SDS-PAGE patterns of flounder and turbot muscle proteins注:H:High Marker;L:Low Marker;A:多宝鱼肌浆蛋白;B:牙鲆鱼肌浆蛋白;C:多宝鱼肌原纤维蛋白;D:牙鲆鱼肌原纤维蛋白。
2.2 肌原纤维蛋白中Ca2+-ATPase活性
肌球蛋白是鱼肌肉中最丰富也是最重要的蛋白质,肌原纤维蛋白的性质主要是由肌球蛋白的性质决定[13]。肌球蛋白的球状头部具有ATPase的活性,则在测定鱼肌肉蛋白质变性时通常以肌球蛋白ATPase的活性作为指标。如图2所示牙鲆鱼肌原纤维蛋白中Ca2+-ATPase活性要高于多宝鱼,与Watabe等报道的栖息于较高环境温度下的鱼一般具有更高的肌球蛋白Ca2+-ATPase活性结论相符合[14]。

图2 牙鲆鱼、多宝鱼肌原纤维蛋白Ca2+-ATPase活性Fig.2 Ca2+-ATPase of myofibrillar protein of flounder and turbot
2.3 肌原纤维蛋白DSC分析
差示扫描量热分析(DSC)是评价蛋白结构变化的重要指标。肌原纤维蛋白质在加热过程中会发生变性和聚集,引起一系列理化特性的变化进而造成产品性质的变化[15]。热转化温度(Tm)反映了蛋白质变性导致其立体结构解离的温度,其值与被测蛋白质的结构性质有关。图3是牙鲆鱼、多宝鱼两种鲆类鱼的肌原纤维蛋白的DSC分析图谱。多宝鱼肌原纤维蛋白的Tm值(39.98 ℃)高于牙鲆鱼肌原纤维蛋白的Tm值(37.86 ℃)。根据鲁长新研究表明,该温度出现峰值可能与肌球蛋白有关,二者Tm的差异可能是由于肌球蛋白头部和尾部热稳定性不同导致的[16]。邵颖等报道了几种鱼的热转化温度Tm,其中武昌鱼(44.03 ℃)、鲈鱼(44.93 ℃)、草鱼(45.67 ℃),均高于多宝鱼,而鳜鱼(39.33 ℃)与多宝鱼相当[17]。与邵颖等人研究结果的差异,可能是由于鱼种类及地理环境的不同所导致的。
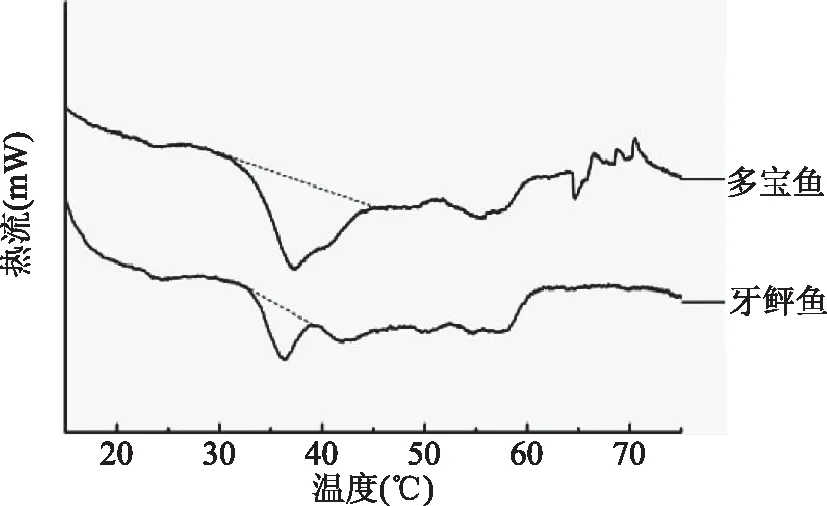
图3 牙鲆鱼、多宝鱼肌原纤维蛋白DSC曲线Fig.3 DSC heating curve for flounder and turbot myofibrillar protein
2.4 流变特性分析
对牙鲆鱼、多宝鱼肌原纤维蛋白在温度从20~80 ℃的流变性变化进行了测定,结果如图4所示。所有的样品中在加热前其储藏模量(Storage modulus,G′,或弹性模量)均高于损耗模量(Loss modulus,G″,或粘性模量),表明处理的肌原纤维蛋白体系已经具有凝胶样结构[18-19]。对比牙鲆鱼与多宝鱼,牙鲆鱼与多宝鱼的G′在40~50 ℃间有一交叉点,随后随着温度的升高,牙鲆鱼的储藏模量G′高于多宝鱼,主要是由于蛋白质在加热变性的过程中产生的肌动球蛋白之间的交联,形成的共价键和非共价键限制了蛋白质分子的运动造成的[20]。同时对于损耗模量G″牙鲆鱼在40~50 ℃之间有一个峰,此处为一个流变特性转折点。多宝鱼在50~60 ℃有一个流变特性转折点。损耗模量G″流变特性转折点与DSC的热转化温度点一致。

图4 牙鲆鱼、多宝鱼肌原纤维蛋白动态流变学特性变化Fig.4 Rheological properties for myofibrillar protein of flounder and turbot
2.5 肌原纤维蛋白特性
2.5.1 乳化性 乳化性是蛋白质重要的功能性质之一,主要包括乳化活性指数(Emulsifying Activity Index,EAI)和乳化稳定系数(Emulsifying Stability Index,ESI)[21-22]。鱼肉蛋白质的乳化能力以及其乳状液可由其在500 nm处的吸光度值表示。图5为牙鲆鱼与多宝鱼在不同浓度下鱼肉肌原纤维蛋白的乳化活性。由图5可以看出,蛋白乳化活性随着蛋白浓度的提高而逐渐降低。在低浓度(5 mg/mL)处,牙鲆鱼肌原纤维蛋白乳化活性6.76 m2/g高于多宝鱼5.92 m2/g,而在中浓度(10 mg/mL)处,牙鲆鱼肌原纤维蛋白乳化活性3.72 m2/g低于多宝鱼4.16 m2/g。本实验乳化性的结果是与顾振宇等人的研究结果有一定的差别[23]。这可能是因为实验选择原料差异所导致的。由于较大的蛋白聚集体产生,而不能再形成稳定的界膜,因此EAI值降低。
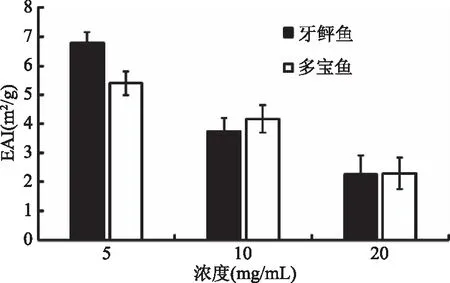
图5 牙鲆鱼、多宝鱼肌原纤维蛋白乳化活性Fig.5 EAI of flounder and turbot myofibrillar protein
蛋白质的乳化稳定性代表蛋白质与脂肪小球结合的能力的变化情况,随着时间的增加,被粉碎的小的脂肪球将会开始慢慢聚集形成大的脂肪球,乳化能力降低,使吸光度变小,因此可以通过吸光度的变化来考察蛋白质的稳定性[24]。图6为牙鲆鱼与多宝鱼在不同浓度下鱼肉肌原纤维蛋白的乳化稳定性。由图6可以看出,蛋白乳化稳定性随着浓度的上升变化趋势是降低的。在低浓度(5 mg/mL)与中浓度(10 mg/mL)处牙鲆鱼肌原纤维蛋白乳化稳定性高于多宝鱼,而在高浓度(20 mg/mL)处牙鲆鱼肌原纤维蛋白乳化稳定性低于多宝鱼。匀浆会使原来分散的蛋白空间结构发生改变,蛋白变性程度增大,使其乳化稳定性降低。
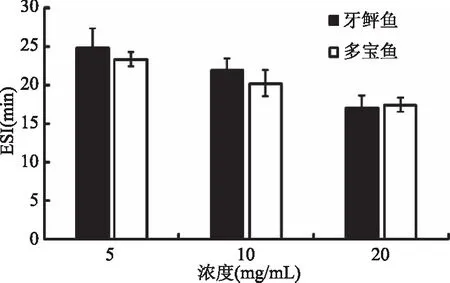
图6 牙鲆鱼、多宝鱼肌原纤维蛋白乳化稳定性Fig.6 ESI of protein of flounder and turbot myofibrillar protein
2.5.2 起泡性 鱼蛋白质高分子溶液经搅打而产生泡沫的性质称为蛋白质高分子的起泡性质,包括起泡能力(Foaming Capacity,FC)和起泡稳定性(Foaming Stability,FS)。由图7可以看出,肌原纤维蛋白起泡性质总体变化趋势是升高的。如图7,低浓度(1 mg/mL)时牙鲆鱼肌原纤维蛋白起泡性低于多宝鱼,中浓度(2 mg/mL)与高浓度(5 mg/mL)时高于多宝鱼。同时随着浓度的升高,多宝鱼起泡性趋于平缓。本实验起泡性的结果是与郭浩楠等人的研究结果相似[25]。
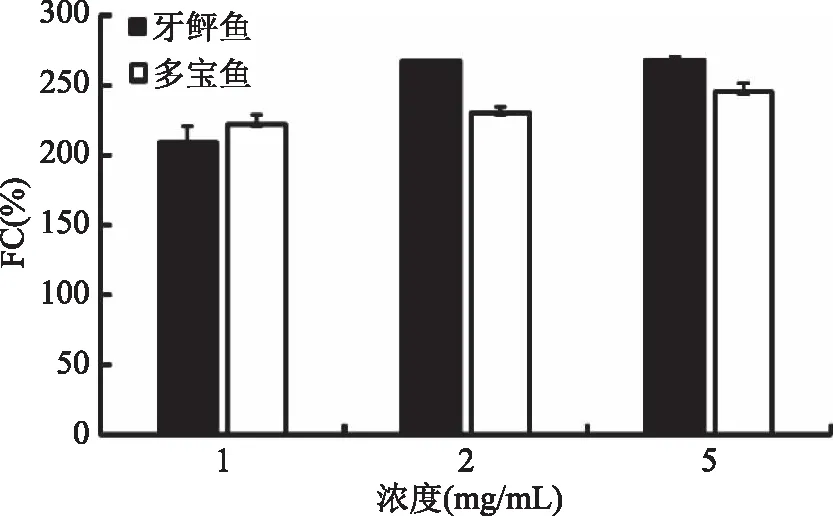
图7 牙鲆鱼、多宝鱼肌原纤维蛋白起泡特性Fig.7 FC of flounder and turbot myofibrillar protein
由图8可以看出,牙鲆鱼肌原纤维蛋白起泡稳定性趋于平稳,而多宝鱼肌原纤维蛋白起泡稳定性呈现降低的趋势。随着蛋白浓度的提高,分子间相互作用形成了稳定网络结构和界面膜遭到破坏,产生的泡沫界面膜易破裂,因而起泡性和泡沫稳定性降低[26]。如图8,低浓度(1 mg/mL)时多宝鱼的肌原纤维蛋白起泡稳定性高于牙鲆鱼肌原纤维蛋白,高浓度(5 mg/mL)时牙鲆鱼的肌原纤维蛋白起泡稳定性高于多宝鱼肌原纤维蛋白。中浓度(2 mg/mL)时二者蛋白起泡稳定性相似。

图8 牙鲆鱼、多宝鱼肌原纤维蛋白起泡稳定性Fig.8 FS of flounder and turbot myofibrillar protein
3 结论
牙鲆鱼与多宝鱼水溶性蛋白,牙鲆鱼较多宝鱼具有特异条带;而在盐溶性蛋白中,多宝鱼肌球蛋白重链多于牙鲆鱼。在流变特性中多宝鱼肌原纤维蛋白变性温度高于牙鲆鱼,损耗模量G″流变特性转折点与DSC的热转化温度点一致。低浓度时牙鲆鱼乳化活性高于多宝鱼,中、高浓度时二者的乳化活性差异不显著。低浓度牙鲆鱼肌原纤维蛋白起泡性低于多宝鱼,中与高浓度时高于多宝鱼。同时随着浓度的升高,多宝鱼起泡性趋于稳定。以上结果证实,虽皆为鲆鲽类冷水鱼,牙鲆鱼与多宝鱼肌原纤维蛋白的蛋白形式、流变特性、乳化特性以及起泡性等功能特性有一定差异。实际生产过程中应合理设计加工条件与工艺,实现对牙鲆鱼和多宝鱼鱼肉蛋白资源的合理利用与产品开发。
