EMR与ESD治疗早期消化道肿瘤的有效性及安全性分析
2018-07-10盛竹鸽王宇晖梁爱玲朱浪潮
盛竹鸽 郭 剑 王宇晖 梁爱玲 白 欣 朱浪潮 王 莹 郭 雄
消化道肿瘤主要包括食管癌、胃癌和结直肠癌三种,且中晚期患者预后非常差,有较高的死亡率[1]。因此,消化道肿瘤的早期诊断及治疗受到临床学者的重视。近年来,消化道早期肿瘤随着人们生活饮食习惯的改变呈现逐年增加的趋势,如果不能得到有效治疗发展到晚期,将会对患者的生命和生活质量造成较大的影响[2]。传统外科手术治疗方式虽有一定效果,但手术创伤大、出血量多、不良反应及并发症严重等缺点,给消化道肿瘤的治疗带来了巨大的挑战[3]。伴随着消化内镜的发展,内镜诊疗技术逐渐应用于消化道肿瘤的治疗,尤其是内镜下黏膜切除术(EMR)和内镜下黏膜剥离术(ESD)被临床医者作为消化道早期肿瘤治疗的重要研究方向[4-7]。为了寻找出有效且安全性较高的治疗方法,本文通过收集我院2015年1月至2017年9月行EM R或ESD治疗的102例早期消化道肿瘤病变患者临床资料,总结并分析两种方法治疗后的临床疗效及安全性,为今后临床医生选择最佳的治疗方法提供依据。
资料与方法
一、一般资料
收集我院2015年1月至2017年9月收治的102例早期消化道肿瘤患者临床资料。所有病例符合以下条件:①经临床诊断及病理检查确诊为消化道早期肿瘤[8];②无EMR或ESD治疗禁忌症,如患有严重的基础疾病、凝血功能障碍以及妊娠、哺乳期或月经期妇女等;③患者愿意配合采用EMR或ESD治疗早期消化道肿瘤;④患者知情同意并签署知情同意书。
根据患者的病情、手术的适应症及禁忌症(EMR治疗的手术适应症:病变起源于黏膜层,局部管壁结构完整周围无肿大的淋巴结[9];ESD治疗的手术适应症:为无淋巴及血行浸润及转移,病变未浸润固有肌层或浆膜层[10]),将所有的患者分为观察组(行ESD治疗)和对照组(行EMR治疗)。观察组45例,男24例,女21例,平均年龄(57.1±5.6)岁;病变位于食管10例,位于胃部24例,位于结直肠11例。对照组57例,男 30例,女 27例,平均年龄(55.8±6.3)岁;病变位于食管12例,位于胃部25例,位于结直肠20例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
二、研究方法
1.手术前准备
手术前向患者讲解EMR或ESD治疗的相关知识,取得患者及家属的配合。同时,做好手术前消化道清洁的准备(检查前4小时口服复方聚乙二醇电解质散)。手术前禁食12 h以上,建立静脉通道、全身麻醉,保持呼吸道通畅,中心吸氧及心电监护等。
2.ESD或EMR治疗方法
(1)观察组行ESD治疗,手术前静推丙泊酚注射液进行麻醉,在消化道局部隆起的病变部位黏膜下注射肾上腺素盐水(比例1:10 000)大约5~10 mL,抬起病变组织,再使用圈套器置于透明帽内沿,将病灶吸入透明帽后收紧圈套,采用高频电刀(ERBE:型号:VIO 200 D)切除病变并进行病理学检查。对于大于1.0 cm以上的病灶或者第一次吸引不能完全切除的患者,可多次进行吸引切除。
(2)对照组行EMR治疗,在静脉复合全麻下用超声内镜确定好病变的位置及深度,采用ESD专用器械刀(hooking刀)在病灶的边缘标记,之后进行黏膜下注射以及病灶环切,暴露出肿瘤组织,最后采用透明帽、hooking刀等进行黏膜剥离。操作完成后,可用钛夹对创面进行封闭。患者手术后要注意观察患者创面有无出血以及是否有腹胀或腹痛的情况。
EMR术后禁食1 d,而ESD术后禁食3 d,上钛夹的患者,有出血穿孔者适当延长卧床休息的时间。
三、研究指标
全部患者接受EMR或ESD治疗后,评价治疗的临床效果及并发症发生的情况,包括整块切除率(整块切除是指病变在内镜下一次性被整块切除)、完全切除率(完全切除是指在整块切除标本的基础上,其病理学水平达到水平切缘和垂直切缘均阴性)、病灶大小、手术时间、术中出血、住院时间及手术并发症等情况。
四、统计方法
应用SPSS22.0统计软件处理数据。计量资料以x±s或M(Qmin,Qmax)表示,采用 t检验或秩和检验;计数资料以%表示,采用 χ2检验或 Fisher′s Exact Test。 P < 0.05 为差异具有统计学意义。
结 果
一、两组整块切除率、完全切除率及病灶大小比较
观察组整块切除43例,整块切除率为95.6%,完全切除39例,完全切除率为86.7%,与对照组比较二者差异均有统计学意义(P<0.05)。观察组剥离病变的直径大于对照组,差异有统计学意义(P<0.05),见表1。
二、两组手术指标比较
观察组手术时间中位数为57 min,术中出血10例,占22.2%,住院时间平均为(6.6±2.4)d。两组三项手术指标比较差异均有统计学意义(P<0.05),见表2。
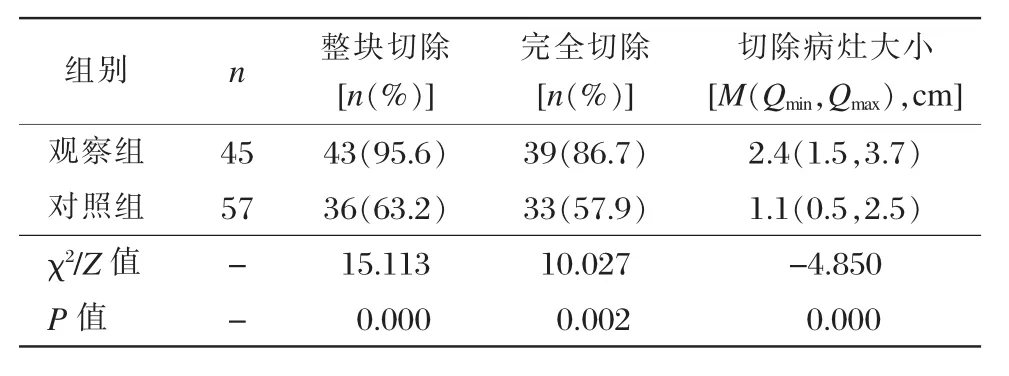
表1 两组整块切除率、完全切除率及病灶大小的比较
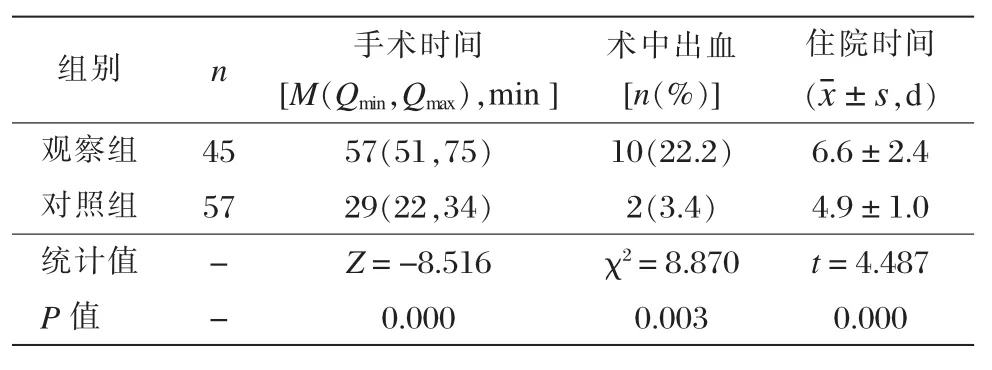
表2 两组手术指标比较
三、两组并发症发生情况比较
观察组术后腹部不适有13例,占28.9%,出血12例,占26.7%,这两种并发症发生率明显高于对照组,差异均有统计学意义(P<0.05);两组术后穿孔发生率无统计学差异(P>0.05)。 见表 3。
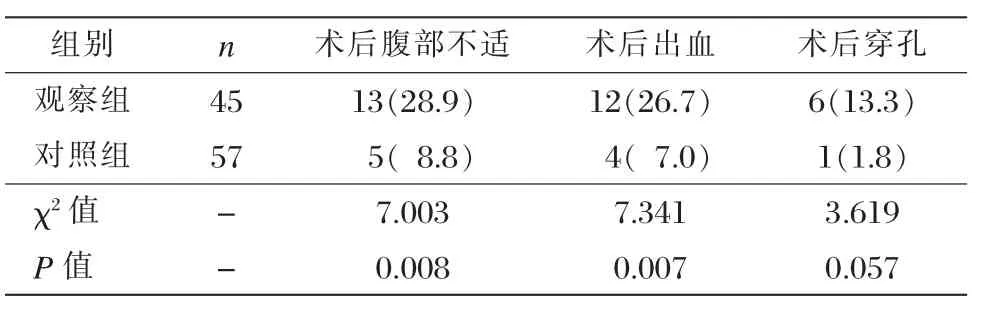
表3 两组并发症发生率比较 [n(%)]
讨 论
我国消化道肿瘤发病率及病死率均高于全球平均水平,且其增长的速度较快。目前,消化道肿瘤中的食管癌、胃癌、肝癌和结直肠癌四种肿瘤均排在我国恶性肿瘤前列[11]。据有关数据显示,这四种肿瘤占恶性肿瘤前十位死亡总数的40.75%[12],成为影响我国人类健康的主要问题。因此,早期发现、早期诊断及早期治疗是消化道肿瘤诊疗的关键[13]。
近年来,随着内镜技术和相关器械的大力发展,临床学者在早期癌症和癌前病变的患者中应用内镜下切除术,并且得到了及时有效的治疗。研究报道,内镜黏膜切除术相比于外科手术有许多优点,如手术微创性、住院时间较短、恢复较快等[14]。但也有研究表明,内镜黏膜切除术对于肿瘤大于2 cm以上的病变几乎不能一次性完整的切除,局部病变具有复发的可能性[15-16]。而内镜下黏膜剥离术是在内镜下黏膜切除术的基础上发展而来,它的技术的原理是在内镜下使用专用的高频电刀及其它辅助设备一次性整块切除较大消化道黏膜及黏膜下病变,可以对较大的病灶进行完整剥离,能够扩大治疗适应证范围,并取得完整的病理标本及精确评估[17]。因此,我们采用内镜下黏膜剥离术和内镜下黏膜切除术治疗消化道早期肿瘤,并对二者的疗效及并发症做了进一步比较。
本研究通过收集我院102例消化道早期肿瘤的患者行ESD和EMR治疗,分析疗效结果显示,ESD组的整块切除率为95.6%,完全切除率为86.7%,切除病灶的大小中位数为2.4 cm,以上三项指标与对照组比较,差异有显著性 (P<0.05),说明内镜下黏膜剥离术不仅在整块切除及治愈性切除方面优于内镜下黏膜切除术,且能治疗更大的病变,这与国内文献报道的结果一致[18-20]。同分多次切除相比,一次性大块的切除能够获得完成的病理标本,且可防止肿瘤转移,提高早期消化道肿瘤治愈的可能性。同时,我们比较了两种治疗方法在手术时间、术中出血及住院时间等三项手术指标的差异,结果显示,ESD组的手术平均时间比EMR组长,术中出血率高,住院时间长,说明内镜下黏膜剥离术在以上三个手术指标上略差于内镜下黏膜切除术,这与Nishide N和Tajika M等研究结果一致[21-22]。此外,进一步比较内镜下黏膜剥离术及黏膜切除术的并发症发生情况,ESD组术后腹部不适率为28.9%,术后出血率为26.7%,这两项并发症指标均高于EMR组,究其原因,主要是ESD的手术操作步骤繁琐且技术难度高,导致手术耗时较长,从而增加了手术并发症发生的风险,结果与郭大昕等研究结果基本一致[23-24]。
综上所述,在切除率方面,ESD在病灶整块切除率及完全切除率均显著优于EMR组,且能剥离切除更大的病灶;在手术安全性方面,ESD治疗的手术时间及住院时间比EMR长,因结直肠壁薄,容易发生手术并发症(术后腹部不适、出血)。基于ESD的显著的切除率,应大力发展和更新技术设备,培养手术操作的技巧和熟练度,使ESD的安全性能够得到较大的改善[25]。在目前内镜下治疗的现状下,在选择内镜下治疗手术的方式时,必须要结合患者病灶的具体情况来合理选择。
[1]唐闯.内镜下黏膜切除术在早期消化道肿瘤中的临床应用[J].中国医药指南,2012,10(20):18-19.
[2]陆秋云,戈之铮.经内镜黏膜下剥离术在早期胃肠道肿瘤中的应用[J].国际消化病杂志,2009,29(2):133-135.
[3]李荣萍,致敏,陈启康,等.消化道早期肿瘤的内镜下治疗临床疗效和安全性观察[J].国际医药卫生导报,2012,18(19):2822-2824.
[4]叶鹏飞,刘佃温.经内镜黏膜下剥离术 (ESD)与黏膜切除术(EMR)治疗结直肠早期病变的临床疗效观察[J].疾病监测与控制,2017,11(8):656-657.
[5]胡晓,李良平,肖迅,等.内镜下黏膜剥离术治疗上消化道早期癌及癌前病变的临床疗效[J].现代消化及介入诊疗,2017,22(1):9-12.
[6]Nietsch H H.692 Endoscopic Resection of Large Laterally Spreading Rectal Adenomas:EMRVersus Esd[J].Gastrointestinal Endoscopy,2017,85(5):AB102.
[7]Hoteya S,Furuhata T,Takahito T,et al.Endoscopic Submucosal Dissection and Endoscopic Mucosal Resection for Non-Ampullary Superficial Duodenal Tumor[J].Digestion,2017,95(1):36-42.
[8]傅泽坚.内镜下消化道肿瘤的早期诊断和治疗[J].中国医学创新,2015,12(13):133-136.
[9]刘变英,雷宇峰,李小会,等.内镜下黏膜切除术治疗消化道肿瘤性病变[J].中华消化内镜杂志,2007,24(6):454-455.
[10]刘靖正.内镜黏膜下剥离术(ESD)在消化道肿瘤治疗中应用的新进展[J].复旦学报(医学版),2012,39(2):198-202.
[11]周燕荣.恶性肿瘤死亡流行趋势与控制[J].中国肿瘤,2011,20(4):256-258.
[12]董颖.消化道恶性肿瘤流行病学特征与发病现状分析[J].医学综述,2014,20(3):429-431.
[13]陈虹彬,倪阵,吕勇,等.内镜黏膜下剥离术治疗上消化道黏膜下病变的价值及并发症危险因素[J].世界华人消化杂志,2015,16(19):3141-3146.
[14]钟超,杨建宇,李启睿,等.内镜黏膜下剥离术与外科手术治疗早期胃癌的有效性及安全性的Meta分析[J].中国内镜杂志,2017,23(5):57-63.
[15]窦利州,张月明,贺舜,等.内镜下黏膜切除术和内镜黏膜下剥离术治疗直肠类癌的对照研究[J].中华消化内镜杂志,2013,30(4):209-213
[16]周平红,姚礼庆,徐美东,等.内镜黏膜下剥离术治疗消化道黏膜下肿瘤[A].首届中日内镜黏膜下剥离术[C],2007:505-508.
[17]黄金链.内镜下黏膜切除术(EMR)及黏膜剥离术(ESD)在早期消化道肿瘤中的应用效果比较[J].中国伤残医学,2015,25(23):69-70.
[18] 白顺滟,肖思洁,吴俊超,等.内镜黏膜下剥离术和黏膜切除术治疗早期胃癌的临床对比分析[J].中国内镜杂志,2014,20(8):873-877.
[19]沈妍华,姜海行,覃山羽,等.内镜下黏膜切除术在治疗上消化道黏膜病变中的应用[J].微创医学,2013,8(2):131-133.
[20]刘岚,王云霞,郭建强.内镜黏膜下剥离术和内镜下黏膜切除术治疗早期胃癌的Meta分析[J].中国老年学,2015,35(7):1804-1808.
[21]Nishide N,Ono H,Kakushima N,et al.Clinical outcomes of endoscopic submucosal dissection for early gastric cancer in remnant stomach or gastric tube[J].Endoscopy,2012,44(6):577-583.
[22]Tajika M,Niwa Y,Bhatia V,et al.Comparison of endoscopic submucosal dissection and endoscopic mucosal resection for large colorectal tumors[J].European Journal of Gastroenterology&Hepatology,2011,23(11):1042-1049.
[23]郭大昕,杨建民,徐启顺,等.内镜黏膜下剥离术和内镜下黏膜切除术治疗早期食管癌安全有效性的Meta分析[J].中华消化内镜杂志,2013,30(12):685-689.
[24]Lian J,Chen S,Zhang Y,et al.A meta-analysisof endoscopic submucosal dissection and EMR for early gastric cancer[J].Gastrointestinal Endoscopy,2012,76(4):763-770.
[25]房殿春.早期胃癌内镜黏膜下切除治疗:现状与展望[J].第三军医大学学报,2014,36(14):1443-1447.
