毒胡萝卜素诱导内质网应激对小鼠调节性T细胞免疫功能的影响
2018-07-09冯珍珍刘萤董宁于燕马涛姚咏明
冯珍珍,刘萤,董宁,于燕,马涛,姚咏明
内质网(endoplasmic reticulum,ER)是真核细胞内的重要细胞器,参与调节蛋白质折叠、生物合成、翻译后修饰等。在应激条件下,如钙离子平衡紊乱、蛋白质糖基化状态改变、突变蛋白表达等引起ER腔内未折叠或错误折叠蛋白聚集,导致ER内稳态失衡[1],进而触发内质网应激反应(endoplasmic reticulum stress,ERS)[2]。研究表明,ERS不仅是生理状态下维持机体稳态的重要机制,也参与糖尿病、肾脏疾病、神经退行性疾病、心血管系统疾病等病理生理过程[3-5]。近年来研究发现,ERS亦可影响巨噬细胞及树突状细胞(DC)等免疫细胞的功能,参与对免疫细胞功能的调节[6-8]。调节性T细胞(regulatory T cells,Treg)作为一类具有显著免疫调节效应的CD4+T细胞亚群,在维持免疫稳态、保持免疫耐受等方面发挥重要作用[9-11]。但ERS是否影响Treg介导的免疫功能,目前尚不清楚。本研究以ERS特异性诱导剂毒胡萝卜素(thapsigargin,TG)体外刺激小鼠脾脏Treg,分析对Treg免疫反应及ERS相关信号通路的影响,探讨ERS对Treg功能的调节效应及可能的信号机制。
1 材料与方法
1.1 实验材料及试剂 6~8周雄性BALB/c小鼠,购自中国医学科学院实验动物中心。小鼠脏器淋巴细胞分离液、RPMI 1640培养液均购自天津灏洋生物制品科技有限责任公司。磷酸盐缓冲液(PBS)购自北京索莱宝科技有限公司。TG购自美国Sigma公司。纯化抗CD3/CD28抗体、别藻蓝蛋白(APC)标记的抗小鼠细胞毒性T细胞相关抗原4(CTLA-4)抗体、藻红蛋白/青色素染料7(PE-Cy7)标记的抗小鼠叉头翼状螺旋转录因子(Foxp3)抗体均购自美国eBioscience公司。抗葡萄糖调节蛋白78(GRP78)抗体、抗真核细胞转录启始因子(eIF2α)抗体及抗磷酸化eIF2α(p-eIF2α)抗体、抗转录激活因子(ATF)4抗体均购自美国Cell Signaling Technology公司。Mini MACS磁性分离仪Treg分离磁珠为德国Miltenyi Biotec公司产品。
1.2 实验方法
1.2.1 小鼠脾脏细胞分离与单个核细胞的制备小鼠断颈处死后无菌留取脾脏置于平皿中,加入3~5ml PBS缓冲液,剪刀剪碎,置于200目滤网上,5ml注射器活塞轻轻研磨,PBS缓冲液冲洗平皿和滤网,收集细胞滤液于15ml离心管中。1500r/min离心5min后弃上清,适量PBS缓冲液重悬细胞制成细胞悬液,缓慢加入到2倍体积的小鼠淋巴细胞分离液中,3000r/min离心15min后吸取中间层絮状物于15ml离心管中。适量PBS缓冲液离心洗涤2次,所得细胞即为小鼠脾脏单个核细胞。
1.2.2 Treg的分离与鉴定 采用Mini MACS免疫磁性分离系统分离Treg:①每1×107细胞加入30μl PBS和10μl生物素偶联抗体鸡尾酒液,4℃避光孵育10min;每1×107细胞加入20μl抗生物素磁珠及10μl PE标记的抗CD25 抗体,4℃避光孵育15min;收集LD柱阴性分选后留出的细胞悬液,离心弃上清获取CD4+T淋巴细胞。②每1×107细胞加入90μl PBS和10μl抗PE磁珠,4℃孵育15min;加入到MS柱中进行第2次分选,收集留出的细胞悬液为T淋巴细胞,阳性分选得Treg,细胞计数。取1×105细胞置于流式上样管中,定容至100μl,加入抗CD4–FITC抗体(0.25μg/106),避光孵育15min,定容至200μl,上流式细胞仪检测双阳性细胞的纯度。
1.2.3 细胞培养与TG刺激 含10%胎牛血清的RPMI 1640培养基重悬Treg细胞,调整细胞浓度为1×106/ml,加入抗CD3/CD28(抗CD3抗体2μg/ml,抗CD28抗体1μg/ml)抗体,接种于96孔板中,每孔200μl。TG刺激设0.05、0.1、0.2μmol/L(n=4)3个浓度,以0μmol/L为对照;设6、12、24h(n=4)3个刺激时间,以刺激0h为对照。
1.2.4 流式细胞术检测Treg Foxp3及CTLA-4的表达
收集细胞,PBS洗涤细胞2次,100μl PBS重悬细胞,加入APC标记的抗小鼠CTLA-4抗体。4℃避光孵育30min,2ml破膜缓冲液洗涤2次,加入1ml破膜液,4℃避光过夜。离心弃上清,细胞重悬于100μl破膜缓冲液中,加入PE-Cy7标记的抗小鼠Foxp3抗体,4℃避光45min,2ml破膜缓冲液洗涤2次,重悬细胞于破膜缓冲液中,流式细胞仪检测Treg Foxp3及CTLA-4的表达水平。
1.2.5 Western blotting检测Treg中ERS信号通路相关分子的表达 Treg按每孔2×106个接种于6孔板中,每孔加入CD3/CD28刺激活化,实验组加入TG,使TG在细胞悬液中的浓度为0.1μmol/L,培养12h后收取细胞,提取蛋白,采用BCA法对总蛋白定量分析。各组细胞蛋白上样量为30μg,SDS-PAGE电泳,电泳完成后进行电转膜。一抗、二抗孵育醋酸纤维素膜,二抗为辣根过氧化物酶标羊抗兔IgG单克隆抗体(1:5000),洗膜后进行发光显影。
1.2.6 流式细胞术检测效应T细胞(Teff)增殖活性在1ml Teff悬液中加入1μl CellTraceTM试剂室温避光孵育20min;加入5倍体积的含10%胎牛血清的培养基,37°孵育5min终止反应。离心弃上清,PBS细胞重悬Teff,3×104个Teff与各组Treg 1:1共培养72h,收集细胞,流式细胞仪检测Teff增殖情况。
1.2.7 ELISA检测细胞因子分泌水平 收集Treg单独培养或与Teff共培养上清,严格按照ELISA试剂盒说明书检测Treg单独培养上清中白介素(IL)-10、转化生长因子(TGF)-β及共培养上清中IL-4、干扰素(IFN)-γ、IL-2生成水平。
1.3 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析(ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠Treg分离纯度 小鼠单个核细胞经过两次MACS分选后,得到Teff的纯度为88.2%,Treg纯度为91.0%(图1),台盼蓝染色检测细胞活性为97.0%。
2.2 TG刺激对Treg Foxp3及CTLA-4表达的时效-量效关系 与对照及刺激6h相比,TG(0.1μmol/L)作用12、24h均可诱导Treg Foxp3表达水平明显升高,差异有统计学意义(P<0.05)。但刺激12h与刺激24h两组间比较,Foxp3的表达差异无统计学意义(P>0.05)。CTLA-4的表达在刺激各时间点的变化差异均无统计学意义(P>0.05,图2A),与对照及0.05μmol/L浓度相比,TG浓度为0.1、0.2μmol/L时Foxp3的表达明显增强(P<0.05),但两组间比较差异无统计学意义(P>0.05)。CTLA-4的表达在各剂量组亦未见明显变化(P>0.05,图2B)。依据Foxp3表达变化情况,选定TG 0.1μmol/L和12h为后续实验的刺激浓度和时间。
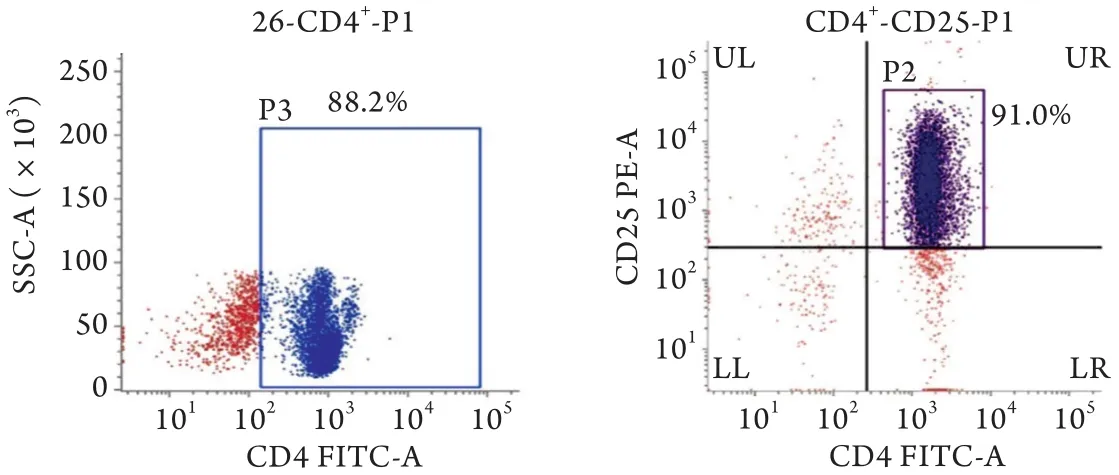
图1 磁珠分选Treg纯度Fig.1 Treg purity sorted by magnetic beads
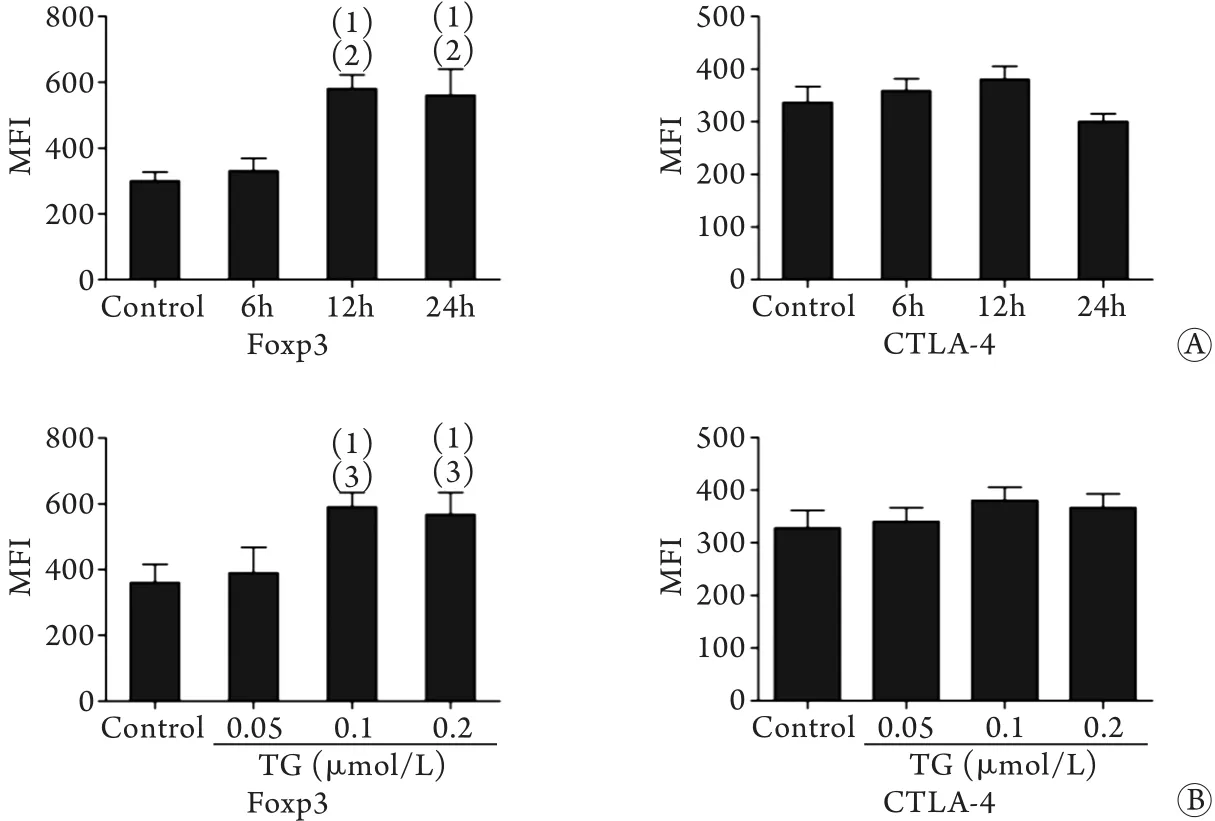
图2 TG刺激后Treg Foxp3及CTLA-4的表达Fig.2 Expressions of Foxp3 and CTLA-4 on Tregs after TG stimulation
2.3 Western blotting检测TG刺激诱导的Treg ERS反应 与对照组相比,0.1μmol/L TG刺激12h可诱导Treg中ERS信号通路蛋白GRP78、ATF4表达水平显著上调,ERS信号通路关键性调节分子eIF2α磷酸化水平明显增加,p-eIF2α/eIF2α比值增加,差异均具有统计学意义(P<0.05,图3)。
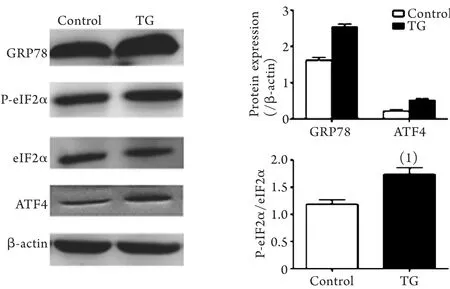
图3 TG刺激诱导Treg中ERS信号通路相关分子表达Fig. 3 Effect of TG on the expression of ERS signaling pathway-related molecules in Tregs (Western blotting)(1)P<0.05 compared with control group
2.4 TG刺激对Treg细胞因子IL-10和TGF-β生成的影响 与对照组相比,TG刺激后Treg培养上清中IL-10及TGF-β的生成明显增加,差异有统计学意义(P<0.05,图4)。
2.5 TG刺激Treg对Teff增殖及Th1/Th2分化的影响与对照组相比,TG刺激组Treg可明显抑制Teff增殖活性,差异有统计学意义(P<0.05,图5A)。与对照组相比,TG刺激组共培养上清中IL-4/IFN-γ比值明显升高,IL-2分泌水平明显降低,差异均有统计学意义(P<0.05,图5B)。
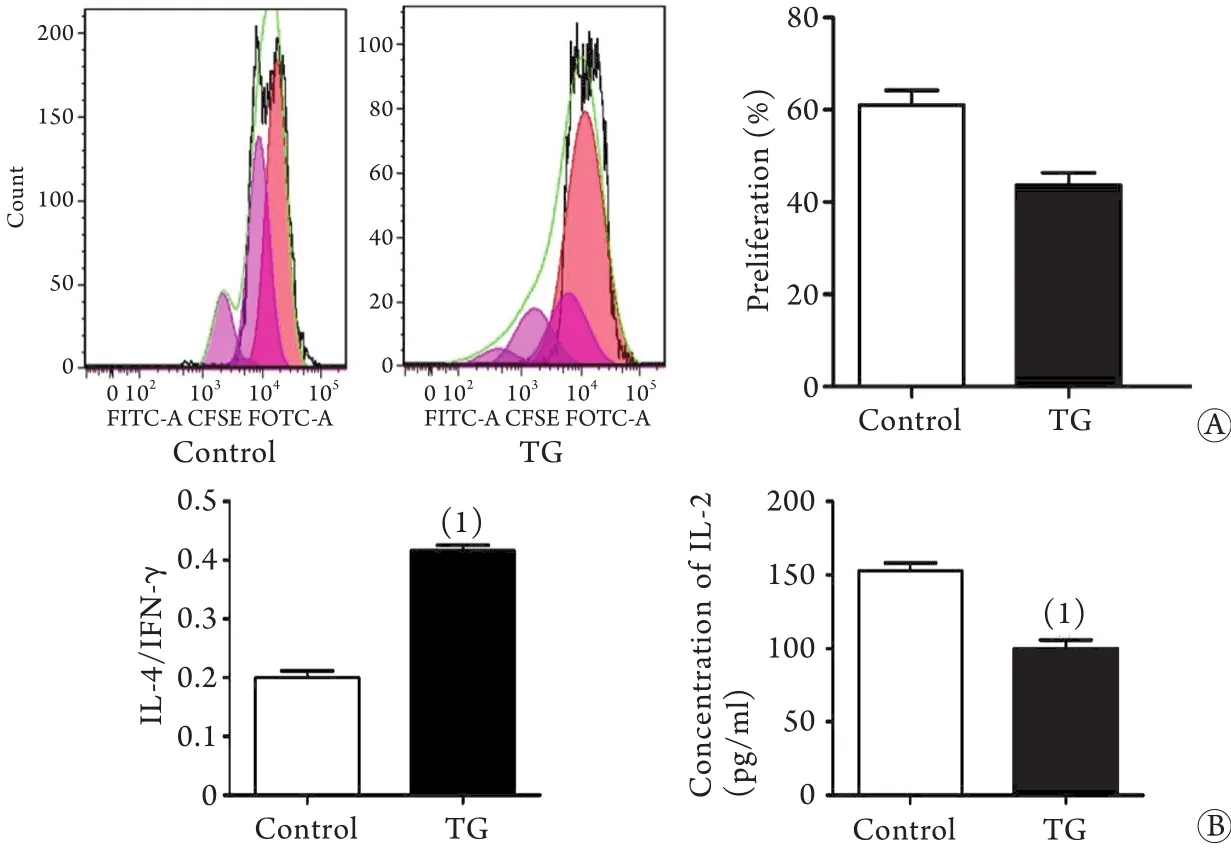
图5 TG刺激Treg对Teff增殖活性及共培养上清中细胞因子分泌情况的影响Fig.5 Effect of TG-stimulated Tregs on proliferative activity of Teff and secretion of cytokines in co-cultured supernatants
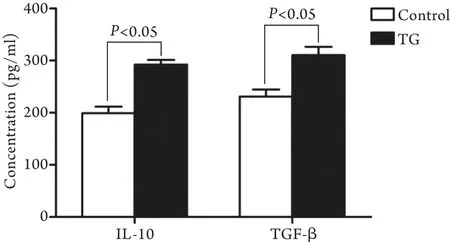
图4 TG刺激Treg培养上清中IL-10及TGF-β的生成情况Fig.4 Effect of TG on the production of IL-10 and TGF-β in Treg culture supernatants
3 讨 论
Treg细胞是一类具有特殊免疫学效应的CD4+T淋巴细胞亚群,主要介导免疫抑制效应,通过实现对天然和特异免疫反应的负性调节,在保持自身免疫耐受、免疫稳态调节等方面发挥重要作用。Treg数量和(或)功能的变化也被证实是移植耐受、过敏反应、自身免疫病、感染免疫等疾病的重要病理生理基础[9]。因此,研究Treg功能变化的机制对于免疫相关疾病的干预和治疗具有重要意义。
ERS是ER在应对多种生理或病理条件下引起的ER腔内未折叠蛋白或错误折叠蛋白聚集的应激性反应。GRP78是ERS反应的标志性蛋白,应激状态下,GRP78作为伴侣分子与ER上的跨膜蛋白解离,与腔内未折叠或错误折叠蛋白结合,促进异常蛋白质的修饰、折叠和转运;GRP78表达的增加提示ERS反应的发生[12],eIF2α和ATF4是ERS诱导PERK信号通路中的重要组分,eIF2α的磷酸化将减缓蛋白质的合成,减轻ER蛋白合成负荷,同时上调下游转录因子ATF4的表达,进一步抑制ER内蛋白质的合成[13]。本研究使用ERS特异性诱导剂TG刺激Treg后,可以检测到Treg中GRP78表达增强,磷酸化eIF2α表达增加,ATF4表达亦明显上调,提示TG刺激后Treg发生明显ERS反应,以利于恢复或保持Treg内ER稳态。
近年来研究提示,ERS对免疫细胞的功能及活性有重要的调节作用。我们的既往研究显示,HMGB1刺激可激活DC中ERS反应,引起DC表面标记分子表达上调,诱导炎性细胞因子生成增加[8];Solanki等[6]发现ERS相关信号通路的活化可明显增强巨噬细胞的抗凋亡能力,加重动脉粥样硬化斑块病灶的进展。本组资料中,我们采用TG刺激,不仅可以观察到Treg中ERS反应的活化,Treg介导的免疫功能也发生明显改变。Foxp3是Treg最具特异性的分子标志物,其表达水平高低是决定Treg功能活性的关键因素[14-15]。本研究结果显示,TG刺激可明显诱导Treg中Foxp3表达,且在0.1μmol/L TG刺激12h时表达明显。进一步分析发现,TG刺激后Treg对Teff的增殖抑制作用明显增强,并且共培养上清中细胞因子IL-4/IFN-γ比值明显增加,IL-2的分泌水平降低,Th1/Th2平衡向Th2方向分化。以上结果显示,TG在诱导Treg发生 ERS反应的同时,对Treg免疫功能也有确切的活化调节效应。
目前已明确,Treg主要依靠细胞接触依赖和非接触依赖机制发挥免疫抑制效应[16]。CTLA-4组成性表达于Treg,可与Teff表面相应受体结合,激活Teff内相应信号通路,进而抑制Teff的增殖活性及IL-2等细胞因子的表达,是Treg发挥细胞接触依赖抑制效应的重要分子[17]。但本研究结果显示,不同浓度TG(0、0.05、0.1、0.2μmol/L)刺激不同时间(0、6、12、24h),Treg上CTLA-4的表达与对照组相比均无明显变化,提示ERS增强Treg活性并非通过CTLA-4介导的细胞接触依赖机制发挥作用,但本研究尚不能排除膜型TGF-β、糖皮质激素诱导的肿瘤坏死因子受体等的作用。IL-10及TGF-β是Treg发挥负性免疫调节效应的重要细胞因子,可直接作用于免疫细胞,发挥负性调节效应[18]。本研究中,我们发现TG刺激后Treg培养上清中IL-10及TGF-β的生成明显增加,提示TG诱导的ERS反应可能通过增强Treg细胞因子的生成能力,以非接触依赖机制发挥免疫抑制效应,但具体作用机制尚待进一步澄清。
研究证实,ERS作为细胞应对应激状态的一种自我保护机制,通过抑制早期蛋白质的合成、增加内质网分子伴侣的表达、加速未折叠蛋白及错误折叠蛋白的降解促进ER稳态的恢复。本研究结果显示,ERS不仅是作为细胞的稳态调节机制,而且在受到TG刺激后,Treg通过活化ERS相关信号通路,恢复Treg中ER稳态的同时,对Treg的免疫反应也具有明确的调节效应。鉴于ERS参与包括神经退行性疾病、心血管疾病、脓毒症等病理生理过程[3-4,19],阐释ERS与Treg的关系及其调控机制,可能为进一步探讨Treg介导免疫性疾病的干预及治疗提供潜在靶点。
[1] Yu BJ, Peng N, Gu ZT, et al. Role and mechanism of endoplasmic reticulum stress and Ca2+overload in pulmonary endothelial cell damage induced by heat stress[J]. Med J Chin PLA, 2017,42(6): 488-494. [余保军, 彭娜, 古正涛, 等. 内质网应激和Ca2+超载在热打击诱导的肺微血管内皮细胞损伤中的作用与机制[J]. 解放军医学杂志, 2017, 42(6): 488-494.]
[2] Cláudio N, Dalet A, Gatti E, et al. Mapping the crossroads of immune activation and cellular stress response pathways[J].EMBO J, 2013, 32(9): 1214-1224.
[3] Guerrero-Hernández A, Leon-Aparicio D, Chavez-Reyes J,et al. Endoplasmic reticulum stress in insulin resistance and diabetes[J]. Cell Calcium, 2014, 56(5): 311-322.
[4] Prell T, Lautenschläger J, Grosskreutz J. Calcium-dependent protein folding in amyotrophic lateral sclerosis[J]. Cell Calcium,2013, 54(2): 132-143.
[5] Lang LX, Xin YP, Feng SH, et al. Detection of expressions
of GRP78,TRAF2,and Caspase-12 in pancreatic tissue of gestational diabetes mellitus rats[J]. J Zhengzhou Univ (Med Sci), 2016, 51(4): 458-462. [郎丽翔, 辛雅萍, 丰树焕, 等. 妊娠期糖尿病大鼠胰腺组织中GRP78、TRAF2、Caspase-12蛋白的表达[J]. 郑州大学学报(医学版), 2016, 51(4): 458-462.][6] Solanki S, Prabhatchandra R, Dube, et al. Reduced endoplasmic reticulum stress-induced apoptosis and impaired unfolded protein response in TRPC3-deficient M1 macrophages[J]. Am J Physiol Cell Physiol, 2014, 307(6): C521-C531.
[7] Zhu XM, Yao FH, Yao YM, et al. Endoplasmic reticulum stress and its regulator XBP-1 contributes to dendritic cell maturation and activation induced by high mobility group box-1 protein[J].Int J Biochem Cell Biol, 2012, 44(7): 1097-1105.
[8] Zhu XM, Dong N, Wang YB, et al. The involvement of endoplasmic reticulum stress response in immune dysfunction of dendritic cells after severe thermal injury in mice[J]. Oncotarget,2017, 8(6): 9035-9052.
[9] Zhang P, Tey SK, Koyama M, et al. Induced regulatory T cells promote tolerance when stabilized by rapamycin and IL-2 in vivo[J]. J Immunol, 2013, 191(10): 5291-5303.
[10] Zhang JC, Yang YL, Sun XD, et al. Autologous dendritic cells combined with cytokine-induced killer cells in the treatment of metastatic renal cell carcinoma[J]. Med J Chin PLA, 2016,41(10): 827-832. [张金超, 杨岩丽, 孙雪冬, 等. 自体树突细胞联合细胞因子诱导的杀伤细胞治疗转移性肾癌的疗效分析及随访观察[J]. 解放军医学杂志, 2016, 41 (10): 827-832.]
[11] Lu YG, Li L, Su Q, et al. Relationship between endothelial microparticles and CD4+CD25+Foxp3+regulatory T cells in patients with acute coronary syndrome[J]. J Jilin Univ (Med Ed), 2016, 42(5): 963-967. [陆永光, 李浪, 苏强, 等. 急性冠脉综合征患者内皮细胞微粒与CD4+CD25+Foxp3+调节性T细胞的关系[J]. 吉林大学学报(医学版), 2016, 42(5): 963-967.]
[12] Hammadi M, Oulidi A, Gackiere Florian, et al. Modulation of ER stress and apoptosis by endoplasmic reticulum calcium leak via translocon during unfolded protein response: involvement of GRP78[J]. FASEB J, 2013, 27(4): 1600-1609.
[13] Chaveroux C, Carraro V, Canaple L, et al. In vivo imaging of the spatiotemporal activity of the eIF2alpha-ATF4 signaling pathway: insights into stress and related disorders[J]. Sci Signal,2015, 8(374): rs5.
[14] Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3[J]. Science,2003, 299(5609): 1057-1061.
[15] Bao R, Hou J, Li Y, et al. Adenosine promotes Foxp3 expression in Treg cells in sepsis model by activating JNK/AP-1 pathway[J].Am J Transl Res, 2016, 8(5): 2284-2292.
[16] Gadina M, O'Shea JJ. Immune modulation: turncoat regulatory T cells[J]. Nat Med, 2009, 15(12): 1365-1365.
[17] Matheu MP, Othy S, Greenberg M, et al. Imaging regulatory T cell dynamics and CTLA4-mediated suppression of T cell priming[J]. Nat Commun, 2015, 6: 6219.
[18] Wu H, Li P, Shao N, et al. Aberrant expression of Treg-associated cytokine IL-35 along with IL-10 and TGF-beta in acute myeloid leukemia[J]. Oncol Lett, 2012, 3(5): 1119-1123.
[19] Khan MM, Yang W, Wang P. Endoplasmic reticulum stress in sepsis[J]. Shock, 2015, 44(4): 294-304.
