母系遗传性视网膜母细胞瘤家系RB1基因分析与产前诊断
2018-07-09兰小平许无恨汤晓君叶海昀杨永臣宋小珍张泓
兰小平,许无恨,汤晓君,叶海昀,杨永臣,宋小珍,张泓
视网膜母细胞瘤(retinoblastoma,RB;OMIM 180200)是一种来源于未成熟视网膜细胞的恶性罕见肿瘤[1],是最早发现的由基因突变而导致的肿瘤,该致病基因被命名为视网膜母细胞瘤基因1(RB1),因此RB1也成为了第一个被成功克隆的人类抑癌基因[2]。已有研究表明,90%的双眼和15%的单眼RB患者外周血基因组DNA中均能检测到RB1基因致病性杂合突变[3]。本研究采用Sanger测序与多重连接探针扩增技术(MLPA)相结合的策略[4]对一个中国汉族双眼RB家系开展了基因检测,并以检测结果为依据对该家系开展了两次产前诊断。现报告如下。
1 资料与方法
1.1 研究对象 为我国一汉族家系,先证者(Ⅱ-1)男,4岁,9月龄发病。临床诊断为双眼RB,右眼C期,左眼D期,患儿足月顺产,无窒息、吸氧史,为该家系第一胎。父母均身体健康,非近亲婚配,均无其他遗传病史,眼底检查均无异常。
1.2 样本采集及DNA提取 为进一步确诊和对其父母再生育时的产前诊断提供依据,在签署知情同意书和上海市儿童医院伦理委员会批准的情况下,采集先证者及父母EDTA抗凝外周静脉血3~5ml,基因组DNA提取采用试剂盒(QIAamp DNA Blood Mini Kit)进行。产前诊断羊水的采集在具有相关资质的妇产科医院完成,羊水基因组DNA的提取采用改进的外周血基因组DNA提取试剂盒进行。
1.3 基因检测方法 RB1基因点突变及小的插入/缺失检测采用Sanger测序法,具体过程是从UCSC数据库(http://genome.ucsc.edu/,GRCh37/hg19)获取RB1基因(NM_000321.1)启动子区、27个外显子编码区及内含子与外显子交界区基因组DNA序列,采用引物设计软件Oligo 7.0设计PCR及测序引物。测序实验采用PCR产物割胶纯化的方法,采用基因分析仪(ABI 3500DX Genetic Analyzer)完成,结果比对分析采用Mutation Surveyor 4.0(SoftGenetics)软件完成。RB1基因外显子拷贝数变异的检测采用多重连接探针扩增(MLPA)法,探针(P047-D1)及试剂均来自MRC-Holland公司,实验操作按说明书标准操作流程(http://www.mlpa.com)进行,实验在T100TMThermal Cycler(Bio-Rad)PCR扩增仪上完成,片段分析采用基因分析仪(ABI 3500DX Genetic Analyzer)完成,结果分析采用GeneMarker V2.2.0(SoftGenetics)软件完成。
1.4 产前诊断方法 对本研究中RB1基因整体杂合缺失突变的产前诊断采用多重连接探针扩增技术(MLPA),产前诊断中母体DNA污染的排除采用检测STR位点的方法进行,每次实验中均以胎儿父母DNA样本分别作为阴性和阳性对照。
2 结 果
2.1 家系基因检测结果 该家系包括2名产前诊断胎儿在内共5名成员(图1A),Sanger测序未检测到先证者Ⅱ-1 RB1基因启动子区、27个外显子及其外显子两端15bp内含子区存在致病性点突变和小的插入/缺失突变。MLPA检测结果显示,先证者Ⅱ-1 RB1基因1-27号外显子杂合缺失(图1B),该缺失包含RB1基因上游的ITM2B基因和下游RCBTB2基因,但不包含上游的ENOX1基因和下游DLEU1和PCDH8基因,母亲Ⅰ-2同样存在该缺失突变(图1C),父亲Ⅰ-1拷贝数正常(图1D),因此可确定先证者的缺失突变来自母亲遗传。
2.2 产前诊断结果 针对该家系第一胎存在RB1基因1-27号外显子杂合缺失的基因检测结果,第二胎产前诊断结果显示,胎儿Ⅱ-2为该突变的男性携带者(图1E),家长最后选择终止妊娠;第三胎产前诊断结果显示,胎儿Ⅱ-3为RB1基因外显子拷贝数正常的女性(图1F),该胎儿出生后眼底检查结果正常。由于MLPA检测探针设计的特殊性,两次产前诊断试验均可通过性别探针排除母体DNA污染的可能性,这一结果与STR位点检测结果一致。
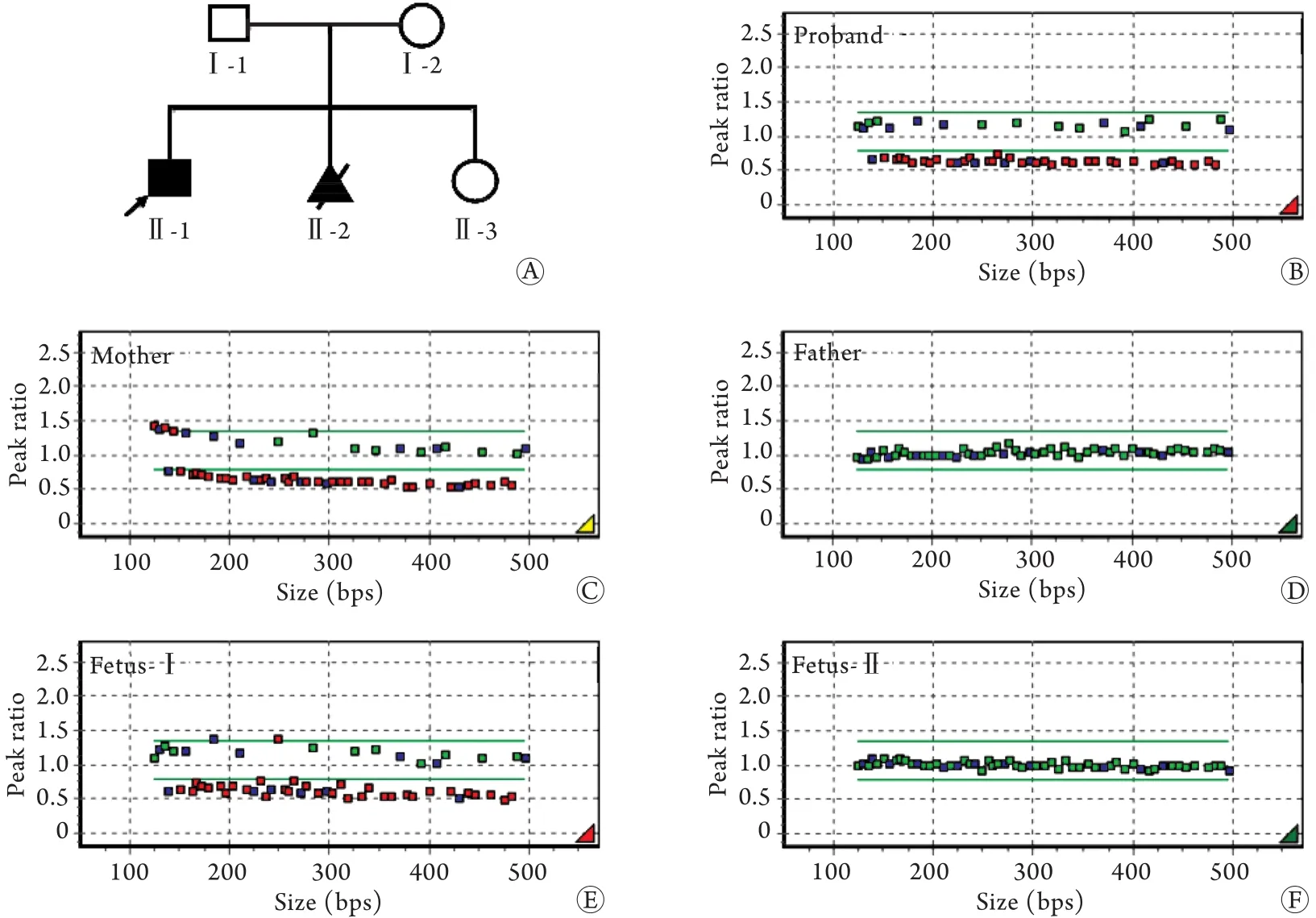
图1 视网膜母细胞瘤家系(A)和MLPA检测结果(B-F)Fig.1 Pedigree of retinoblastoma (A) and MLPA detection results (B-F)
3 讨 论
视网膜母细胞瘤多发于5岁之前的婴幼儿,全世界新生儿发病率基本恒定在1/15 000~1/20 000,每年新增患者约9000例[5]。我国人口出生率高,每年新增患者数量在亚太地区排名第二,约为1103例,仅次于排名第一的印度(1468例)[6]。RB根据其患眼可分为单侧发病和双侧发病,分别约占60%和40%,极少一部分双侧患儿合并颅中线上的松果体肿瘤,称为三侧性RB,约45%的患者血液DNA中存在RB1基因致病性杂合突变[7]。因此,利用外周血基因组DNA对RB患者及亲属开展基因检测,对其早期确诊、治疗、再生育遗传咨询及产前诊断具有重要意义。本研究中先证者为双眼RB,RB1基因检测结果表明该患者存在RB1基因的整体杂合缺失,而且父母检测结果表明该缺失突变来自健康无病的母亲,因此对该先证者父母再生育胎儿开展了产前基因诊断。
截止2016年3月,人类基因突变数据库(HGMD)共收录RB1基因与RB相关的各类突变980个,包括错义突变、无义突变、移码突变、可变剪接、插入/缺失及染色体重排,其中缺失突变占15.2%(149个)。包含BR1基因在内的染色体缺失片段大小与RB发生的相关性研究表明:当缺失片段大于1Mb时,个体通常为单眼发病RB患者或无RB症状携带者,但会出现特殊容貌、身材矮小、精神发育迟滞、肌张力低下、脑及心脏发育异常等综合征特征;当缺失范围仅限于RB1基因及其两端较小范围时,临床表型与缺失片段所包含的基因直接相关,缺失片段仅包含RB1及上游ITM2B基因时,所有患者均为双眼发病,而缺失片段同时包括RB1及上游ITM2B和MED4基因时,患者通常为单眼发病,表明MED4基因的缺失具有抑制RB1发生的趋势[8]。同样有研究表明RB1基因下游PCDH8基因缺失与精神运动发育迟缓有关[9]。由此可见,当先证者出现RB1基因完全缺失时,缺失片段的大小以及上下游缺失基因的种类对先证者临床表型的评估具有重要的参考意义。本研究中的先证者为RB1基因的完全缺失,上游缺失包含了ITM2B基因,而未出现ENOX1基因的缺失,下游缺失包含了RCBTB2基因,而未到达PCDH8基因,这一结果与先证者仅出现双眼RB,而无其他临床症状的结果是一致的,由于本研究所用MLPA试剂盒未在ITM2B基因上游的MED4基因中设置检测探针,因此无法确定MED4基因是否缺失。
遗传性RB的外显率高达90%以上,RB1基因的移码突变和无义突变通常为完全显性,而错义突变、可变剪接突变、非移码的插入/缺失及启动子区突变则会出现低外显率的现象[10-11]。对于包含RB1基因全部外显子在内的染色体小片段缺失突变(<1Mb),国内外已报道的病例均与本研究中的先证者临床表型一致,为双眼RB[8,12],尚未见到携带RB1基因全部外显子缺失突变而无RB临床症状的研究报道,本研究中的先证者母亲携带了与先证者相同的缺失突变而无临床症状的原因可能与以下两个方面的因素有关,一方面可能与RB1基因的“二次突变”过程有关;另一方面可能与RB1基因的表观遗传学有关,RB1基因作为母源性印记基因,其印记中心位于第二内含子的CpG85,该印记区控制着RB1的正常表达[13],不同亲本来源的RB1突变在外显率方面存在差异[14],详细的机制还有待进一步的研究。
RB1基因由于其突变类型的多样化,在临床基因检测和产前诊断实践中既要考虑点突变及小的插入/缺失突变,又要考虑外显子及染色体大片段的拷贝数变异,甚至印记中心和启动子区的甲基化改变情况。因此,目前Sanger测序或二代测序结合MLPA或荧光定量PCR的检测策略被国内外实验室普遍采用[12]。
[1] Wang Q, Du LQ, Wang Y, et al. Inhibitory effect of Rb94 gene combined with radiotherapy on growth of esophageal carcinoma cells of tumor-bearing nude mice[J]. J Jilin Univ (Med Ed),2017, 43(2): 220-224. [王芹, 杜利清, 王彦, 等. Rb94基因联合放射治疗对荷瘤裸小鼠食管癌细胞生长的抑制作用[J]. 吉林大学学报(医学版), 2017, 43(2): 220-224.]
[2] Friend SH, Bernards R, Rogelj S, et al. A human DNA segment with properties of the gene that predisposes to retinoblastoma and osteosarcoma[J]. Nature, 1986, 323(6089): 643-646.
[3] Dimaras H, Gallie BL. Genetics of retinoblastoma and genetic counseling[M]//Rodriguez-Galindo C, Wilson MW.Retinoblastoma. Boston, MA: Springer US; 2010: 41-54.
[4] Wang LN, Zhou SY, Zhang H, et al. Application of MLPA in prenatal diagnosis of 22q11.2 microdeletion syndrome[J]. J Zhengzhou Univ (Med Sci), 2015, 50(1): 52-54. [王莉娜, 周世媛, 张华, 等. MLPA技术在22q11.2微缺失综合征产前诊断中的应用[J]. 郑州大学学报(医学版), 2015, 50(1): 52-54.]
[5] Dimaras H, Kimani K, Dimba EA, et al. Retinoblastoma[J].Lancet, 2012, 379(9824): 1436-1446.
[6] Usmanov RH, Kivela T. Predicted trends in the incidence of retinoblastoma in the Asia-Pacific region[J]. Asia Pac J Ophthalmol (Phila), 2014, 3(3): 151-157.
[7] Dimaras H, Corson TW, Cobrinik D, et al. Retinoblastoma[J].Nat Rev Dis Primers, 2015, 1: 15021.
[8] Mitter D, Ullmann R, Muradyan A, et al. Genotype-phenotype correlations in patients with retinoblastoma and interstitial 13q deletions[J]. Eur J Hum Genet, 2011, 19(9): 947-958.
[9] Castera L, Dehainault C, Michaux D, et al. Fine mapping of whole RB1 gene deletions in retinoblastoma patients confirms PCDH8 as a candidate gene for psychomotor delay[J]. Eur J Hum Genet, 2013, 21(4): 460-464.
[10] Xue K, Wu JH, Ren H, et al. Analysis of gene mutation in a Chinese family with low penetrance retinoblastoma[J]. Chin J Ocul Fundus Dis, 2015, 31(6): 553-555. [薛康, 吴继红, 任慧,等. 视网膜母细胞瘤低外显率一家系基因研究[J]. 中华眼底病杂志, 2015, 31(6): 553-555.]
[11] Du Q, Wang YH, Brenda L. Low-penetrance retinoblastoma due to exons 24 and 25 deletions in the Rb1 gene[J]. ChinJ Med Genet, 2002, 19(5): 7-11. [杜琴, 江悦华, L.Galli B. Rb1基因第24和25外显子缺失导致低外显性视网膜母细胞瘤[J]. 中华医学遗传学杂志, 2002, 19(5): 7-11.]
[12] He MY, An Y, Gao YJ, et al. Screening of RB1 gene mutations in Chinese patients with retinoblastoma and preliminary exploration of genotype-phenotype correlations[J]. Mol Vis,2014, 20: 545-552.
[13] Kanber D, Berulava T, Ammerpohl O, et al. The human retinoblastoma gene is imprinted[J]. PLoS Genetics, 2009,5(12): e1000790.
[14] Klutz M, Brockmann D, Lohmann DR. A parent-of-origin effect in two families with retinoblastoma is associated with a distinct splice mutation in the RB1 gene[J]. Am J Hum Genet, 2002,71(1): 174-179.
