听神经瘤患者Ki-67、PCNA、TGF-β 1水平及其临床意义研究
2018-07-09王颖温晓慧辛忠海北京市昌平区中西医结合医院耳鼻喉科北京008首都医科大学北京朝阳医院耳鼻喉头颈外科北京00069中国中医科学院望京医院耳鼻喉科北京000
王颖,温晓慧,辛忠海北京市昌平区中西医结合医院耳鼻喉科,北京008首都医科大学北京朝阳医院耳鼻喉头颈外科,北京00069中国中医科学院望京医院耳鼻喉科,北京000
听神经瘤是指起源于听神经鞘的一类肿瘤,为良性肿瘤,是常见颅内肿瘤之一,占颅内肿瘤的8%~10%,占桥小脑角肿瘤的80%[1]。听神经瘤多发于成年人,高峰发病年龄为30~50岁,儿童单发性听神经瘤十分少见,该病无明显性别差异,左、右侧发生率相仿,偶见双侧性[2]。临床以桥小脑角综合征和颅内压增高征为主要表现[3]。治疗手段包括外科手术治疗和立体定向放射治疗,其中听神经瘤首选手术治疗,可以完全切除,彻底治愈[4]。本研究选取接受治疗的听神经瘤患者为研究对象,与同期接受手术治疗的脑外伤患者作为对比,观察两组患者细胞核相关抗原(Ki-67)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、转化生长因子-β1(transforming growth factor-β1,TGF-β 1)的表达情况,并分析其临床意义,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年4月至2017年8月在北京市昌平区中西医结合医院接受治疗的听神经瘤患者为研究对象。纳入标准:①年龄≥18岁;②经病理和临床诊断确诊为听神经瘤者;③无其他原发肿瘤疾病者。排除标准:①临床资料不全者;②合并免疫功能障碍者。根据纳入和排除标准共纳入病例50例,男28例,女22例;年龄42~70岁,平均(60.45±3.19)岁。选取在北京市昌平区中西医结合医院接受手术治疗的脑外伤患者为脑外伤组,年龄≥18岁,无严重基础疾病。共纳入病例50例,男26例,女24例;年龄45~73岁,平均(60.42±2.98)岁。两组患者年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。本项研究所有患者均知情同意,且签署知情同意书。
1.2 方法
取患者术后新鲜听神经瘤标本,常规制备石蜡病理切片。切片置于恒温电烤箱中烤片过夜,选用二甲苯脱蜡,再进行常规梯度酒精洗脱,蒸馏水冲洗2次,浸入磷酸盐缓冲液(PBS)5 min,放置在枸缘酸盐缓冲液中10 min,再用PBS冲洗3次,在常温下放入H2O2中孵育。加入一抗后,用PBS冲洗3次,然后加入已经标记的二抗,再用PBS冲洗3次,最后加入显色剂显色,选择自来水进行充分冲洗,以终止反应进行,终止后用苏木精轻度复染,再用自来水冲洗,梯度酒精脱水,二甲苯透明,最后用中性树胶进行封片。由检验科医师对所得病理切片在显微镜下观察Ki-67、PCNA、TGF-β1的表达情况。
1.3 评价标准
观察两组组织中的Ki-67、PCNA、TGF-β1表达情况,比较不同临床特征听神经瘤患者的Ki-67、PCNA、TGF-β1表达水平,并分析影响听神经瘤患者Ki-67、PCNA、TGF-β1表达的因素。阳性表达判断标准:石蜡切片染色呈棕黄色或深棕色。根据阳性细胞百分比计分:0分,阳性细胞百分比<10%;1分,阳性细胞百分比为10%~20%;2分,阳性细胞百分比为21%~50%;3分,阳性细胞百分比>50%。根据染色强度计分:0分,细胞无染色;1分,细胞染色为浅黄色;2分,细胞染色为棕黄色;3分,细胞染色为黄褐色。总分为阳性细胞百分比计分×染色强度计分,分值为0~9分。根据总分的高低分为3个等级:阴性(-),≤2分;阳性(+),3分≤总分<6分;强阳性(++),6~9分。肿瘤临床年生长速率(mm/y)=肿瘤大小/病程,以<10 mm/y为缓慢生长,≥10 mm/y为快速生长。
1.4 统计学方法
采用SPSS 11.5统计-软件进行数据分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验;采用Logistic回归分析法分析影响听神经瘤患者Ki-67、PCNA、TGF-β1表达的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 两组组织中Ki-67、PCNA、TGF- β 1表达情况的比较
听神经瘤组患者的Ki-67、PCNA、TGF-β1阳性表达率均明显高于脑外伤组,差异均有统计学意义(P<0.01)。(表1)
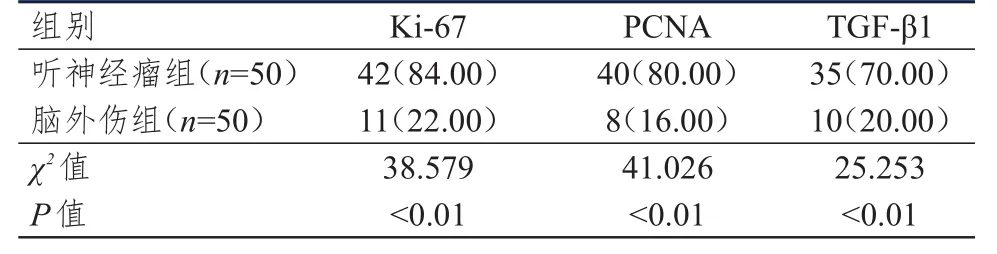
表1 两组组织中Ki-67、PCNA、TGF-β 1阳性表达率的比较[ n(%)]
2.2 不同临床特征听神经瘤患者Ki-67、PCNA、TGF- β 1表达情况的比较
肿瘤大小>35 mm、生长速度≥10 mm/y、肿瘤性质为复发性患者的Ki-67、PCNA、TGF-β1阳性表达率均高于肿瘤大小≤35 mm、生长速度<10 mm/y、肿瘤性质为原发性患者,差异均有统计学意义(P<0.05);而不同年龄、性别的患者 Ki-67、PCNA、TGF-β1阳性表达率比较,差异均无统计学意义(P>0.05)。(表2)
2.3 影响听神经瘤患者Ki-67、PCNA、TGF- β 1表达的多因素分析
将各因素赋值,生长速度:1=≥10 mm/y,0=<10 mm/y;肿瘤性质:1=复发性,0=原发性。Logistic回归分析结果显示,生长速度和肿瘤性质是影响Ki-67、PCNA、TGF-β1阳性表达的因素(P<0.05)。(表3~表5)
3 讨论
听神经瘤多源于第Ⅷ脑神经内耳道段,亦可发自内耳道口神经鞘膜起始处或内耳道底,听神经瘤极少真正发自蜗神经,而多来自前庭上神经,其次为前庭下神经,一般为单侧,两侧同时发生较少[5]。当肿瘤体积小时,患者多会出现一侧耳鸣、听力减退及眩晕,少数患者时间稍长后出现耳聋,随着肿瘤继续增大,患者会出现面肌抽搐、泪腺分泌减少、面部麻木、痛触觉减退、角膜反射减弱等症状[6]。患者本身若还有脑脊液循环梗阻,则会有头痛、呕吐、视力减退、视乳头水肿或继发性视神经萎缩[7]。治疗方式包括外科手术治疗、立体定向放射治疗,随着CT和MRI等影像学技术的发展,使得听神经瘤的定位、定性诊断更加准确,通过手术治疗,可以完全切除,彻底治愈[8]。
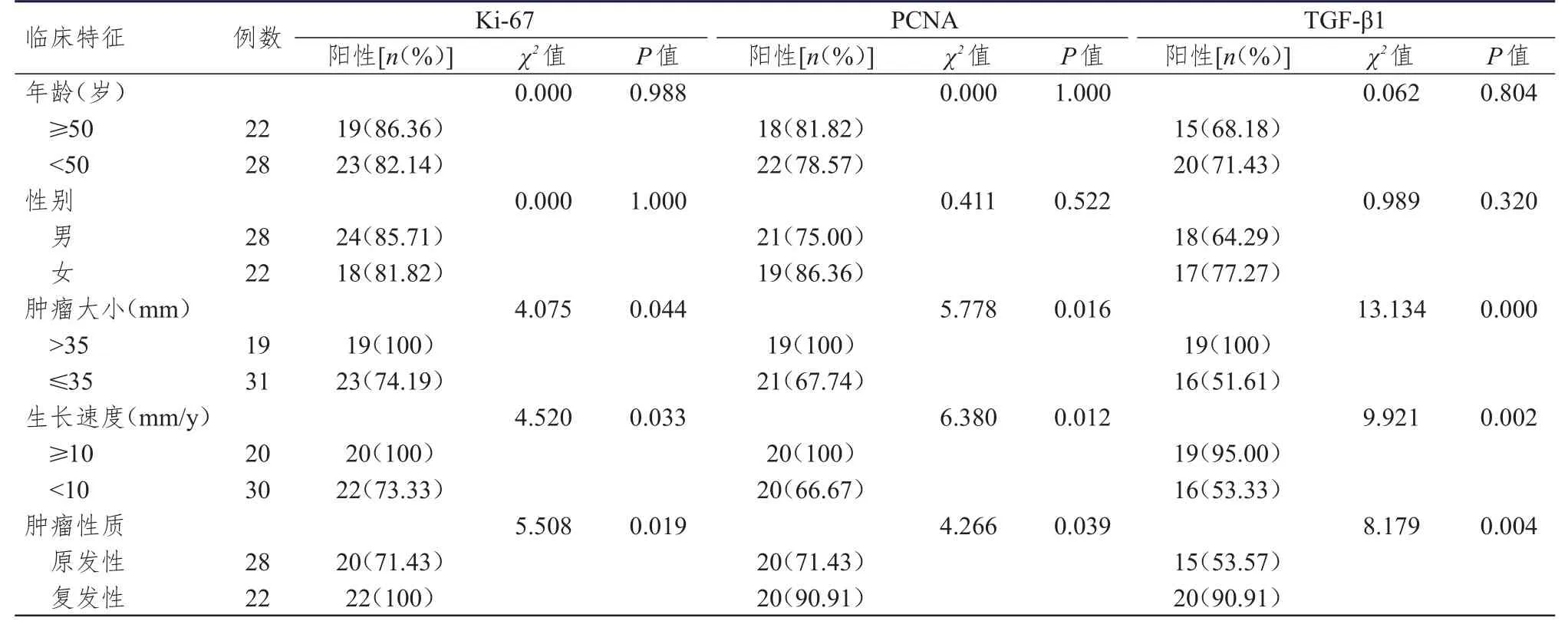
表2 不同临床特征听神经瘤患者Ki-67、PCNA、TGF-β 1阳性表达情况的比较
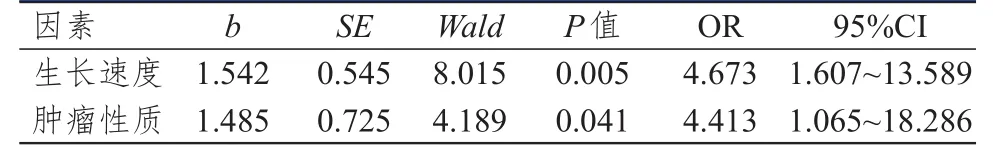
表3 影响听神经瘤患者Ki-67表达的多因素分析
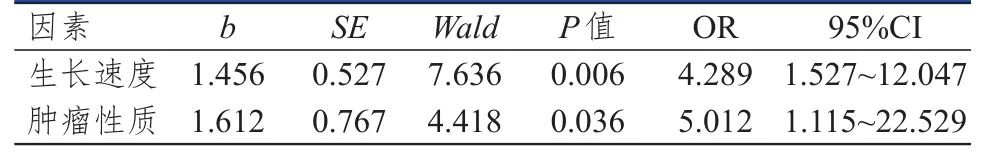
表4 影响听神经瘤患者PCNA表达的多因素分析
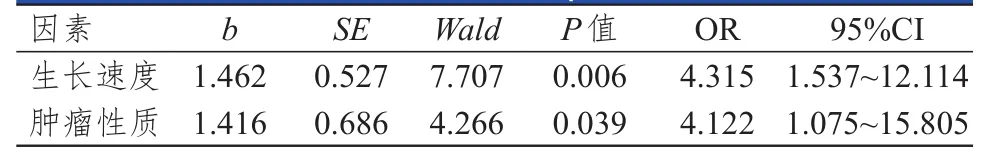
表5 影响听神经瘤患者TGF-β 1表达的多因素分析
Ki-67是一种核蛋白质,由MKI-67基因编码,又称之为MKI-67,在病理免疫组化中经常用到,提示细胞的增殖活跃程度,在病理报告中的指数高低与许多肿瘤的分化程度、浸润、转移及预后密切相关[9]。PCNA是促进聚合酶延伸链的多聚酶辅助蛋白,为DNA的合成提供物质基础,在细胞增殖期以及非增殖期均有表达,研究发现PCNA与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的良好指标,可通过其表达水平反映细胞增殖活性,与肿瘤生长速度呈正相关[10]。TGF-β1抑制免疫活性细胞的增殖,抑制淋巴细胞的分化,在肿瘤组织中含量高于正常组织[11]。现如今,免疫组织化学技术是研究肿瘤增殖行为的重要手段之一,通过增殖抗原计数比衡量肿瘤细胞的增殖活性,可通过相关因子的表达来判断病理进程[12]。
本研究中,听神经瘤组患者的Ki-67、PCNA、TGF-β1阳性表达率明显高于脑外伤组,提示肿瘤细胞增殖行为与Ki-67、PCNA、TGF-β1阳性表达率存在一定的关系。表2显示,肿瘤大小>35 mm、生长速度≥10 mm/y、肿瘤性质为复发性患者的Ki-67、PCNA、TGF-β1阳性表达率高于肿瘤大小≤35 mm、生长速度<10 mm/y、肿瘤性质为原发性患者,而不同年龄、性别的患者Ki-67、PCNA、TGF-β1阳性表达率比较,差异均无统计学意义(P>0.05)。表明Ki-67、PCNA、TGF-β1的阳性强弱可反映肿瘤细胞增殖活性的强弱,同时阳性表达率高也提示患者术后复发的危险较大。有资料显示,Ki-67、PCNA、TGF-β1含量与良性肿瘤增殖亦有较大相关性,生长指数与瘤体大小呈相关性,表明较大瘤体更易发生增殖行为[13-15]。Logistic回归分析结果显示,生长速度和肿瘤性质是影响Ki-67、PCNA、TGF-β1阳性表达率的因素,证明了肿瘤的生长速度和病理类型与相关因子表达之间存在密切关系,可通过表达程度来预测患者肿瘤恶性或良性状态,更好地选择治疗手段,可作为一类灵敏准确的检测方式进行肿瘤诊断及预后评估。
综上所述,听神经瘤患者的Ki-67、PCNA、TGF-β1阳性表达率较高,且受瘤体生长速度和肿瘤性质的影响,可用于听神经瘤的诊断。
[1]张婷,胡容峰,郑德燕,等.巨大听神经瘤切除后复发患者一例的护理[J].解放军护理杂志,2010,27(19):1496-1497.
[2]蔡林志,袁贤瑞,刘庆,等.伽玛刀治疗不同类型听神经瘤的疗效分析[J].中华神经外科杂志,2016,32(1):13-17.
[3]郝淑华.改良侧俯卧位在乙状窦后入路听神经瘤切除术患者中的应用研究[J].实用临床医药杂志,2016,20(8):163-164.
[4]丁维亮,蒲珂,王宏.听神经瘤术后面神经功能恢复规律及肿瘤大小对其的影响[J].天津医药,2016,44(3):370-372.
[5]Aihara N,Yamada H,Takahashi M,et al.Postoperative headache after undergoing acoustic neuroma surgery via the retrosigmoid approach[J].Neurol Med Chir(Tokyo),2017,57(12):634-640.
[6]孙守家,高攀,张晓静,等.超声吸引刀的磨骨功能在听神经瘤显微手术内听道处理中的应用[J].中华神经外科杂志,2016,32(8):836-839.
[7]党连锋,千超,左毅,等.乙状窦后入路切除听神经瘤术中神经电生理监测保护面神经的应用[J].实用癌症杂志,2016,31(6):912-914.
[8]李欢,王亮,郝淑煜,等.弥散张量成像面神经追踪技术在听神经瘤手术中的应用[J].中华神经外科杂志,2016,32(11):1109-1112.
[9]贾欢,樊碧云,胡凌翔,等.听神经瘤术中面神经最大阈上刺激的波幅变化与术后早期面神经功能的关系及其影响因素[J].中华耳鼻咽喉头颈外科杂志,2016,51(6):414-418.
[10]Foresti C,Cagnoni L,Rottoli MR,et al.78.Predictive value of facial nerve neurophysiological evaluation in acoustic neuroma surgery[J].Clin Neurophysiol,2017,128(12):e433-e434.
[11]谢乔林,陈文斗,玉石,等.听神经瘤术中不同肿瘤切除程度对面神经功能及肿瘤复发的影响对比[J].中国医师进修杂志,2017,40(4):313-315.
[12]徐海英,张丽花,贺艳,等.标准化术前访视在神经电生理监测下听神经瘤手术中的应用[J].护理学杂志,2017,32(14):38-40.
[13]Kristin J,Glaas MF,Stenin I,et al.Multistep translation and cultural adaptation of the Penn acoustic neuroma quality-of-life scale for German-speaking patients[J].Acta Neurochir(Wien),2017,159(11):2161-2168.
[14]褚峥,张鹏远.听神经瘤切除术后脑血管痉挛的危险因素分析[J].中国现代医学杂志,2017,27(12):121-124.
[15]周杰,芦戬.30岁以下听神经瘤患者临床特点及术后面神经功能评估[J].肿瘤研究与临床,2017,29(6):409-411.
