下调SRGN基因表达对乳腺癌细胞凋亡及JAK/STAT信号通路的影响
2018-07-09马剑锋张艳彩孙慧
马剑锋,张艳彩,孙慧
郑州市第七人民医院1普外科,2实验室,郑州4500003河南省人民医院呼吸内科,郑州450000
乳腺癌是女性常见的恶性肿瘤之一,近些年该病在中国的发病率呈上升趋势,成为威胁女性健康的主要恶性肿瘤[1]。乳腺癌的发生发展是一个涉及多基因、多阶段的复杂过程,已有大量研究表明抑癌基因失活、癌基因激活影响乳腺癌的发生发展。因此,研究乳腺癌中抑癌基因及癌基因的表达情况,并研究其作用机制,对于乳腺癌的临床及分子靶向治疗具有重要意义。研究发现,小分子糖蛋白丝甘蛋白聚糖(serglycin,SRGN)的表达与癌细胞的侵袭和转移有关,SRGN可以促进乳腺癌细胞的侵袭及转移,抑制SRGN的表达可以降低乳腺癌细胞的侵袭及转移能力[2-3],但关于SRGN对乳腺癌细胞凋亡的影响及机制尚未清楚。因此,本研究通过RNA干扰技术沉默乳腺癌细胞中SRGN的表达,旨在研究其对乳腺癌细胞凋亡的影响,并研究其可能的分子机制,为乳腺癌的治疗提供新的方法。
1 材料与方法
1.1 材料
正常乳腺上皮细胞MCF-10A及乳腺癌细胞MDA-MB-231、SMMC-7721、MCF7、HCC1569均购自美国模式菌种收集中心(ATCC);胎牛血清、RPMI1640培养基、胰蛋白酶均购自美国Gibco公司;LipofectamineTM2000购自美国Invitrogen公司;二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒均购自碧云天生物技术研究所;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,cleaved caspase 3)、磷酸化的蛋白酪氨酸激酶2(phosphorylated Janus kinase 2,p-JAK2)、磷酸化的信号转导与转录因子3(phosphorylated signal transducers and activators of transcription 3,p-STAT3)抗体均购自美国Cell Signaling Technology公司;流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养 将细胞置于水浴锅中,37℃解冻后,加入RPMI1640培养基(含有10%胎牛血清),置于体积分数为5%CO2、饱和湿度为95%的培养箱中培养。采用生长至对数期的细胞进行实验。
1.2.2 Western blot检测SRGN蛋白的表达水平取出培养瓶中融合度超过90%的细胞,采用预冷的磷酸盐缓冲液(PBS)洗涤细胞,于培养皿中每106个细胞加入裂解液100 μ(lRIPA∶PMSF=100∶1),冰上裂解30 min,离心,上清液即为总蛋白。采用BCA试剂盒检测蛋白浓度,每孔道加入总蛋白50 μg,行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE),电泳的初始电压为60 V,30 min后将电压调整至110 V,于溴酚蓝迁移至分离胶下缘1 cm时结束电泳,整个过程约2 h。电转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)后,采用5%的脱脂奶粉封闭过夜,置于水平摇床中,4℃孵育一抗过夜,SRGN及内参GAPDH抗体分别按照1∶500和1∶1000稀释,洗膜,加入辣根过氧化物酶标记的羊抗兔IgG(1∶10000稀释),置于水平摇床中,室温下孵育1 h,洗膜,在化学发光凝胶成像仪上进行拍照分析。
1.2.3SRGNsiRNA转染MDA-MB-231细胞 将MDA-MB-231细胞接种于6孔板中,培养24 h,待细胞生长达70%~80%融合时进行转染,将SRGNsiRNA(siRNA-SRGN组)及阴性对照siRNA-Con(siRNA-Con组)经脂质体LipofectamineTM2000转染至MDA-MB-231细胞,仅加入脂质体的为空白对照组,培养4 h后换成完全培养基,收集转染48 h的细胞,采用Western blot检测各组细胞中SRGN蛋白的表达水平。
1.2.4 流式细胞术检测各组细胞的凋亡率 收集转染48 h的各组细胞,加入预冷的PBS洗涤细胞,胰酶消化细胞,调整细胞密度为5×105/ml,加入结合缓冲液 500 μl悬浮细胞,避光,于冰上加入 5 μl Annexin V-FITC和5 μl PI稀释液,充分混匀后避光室温培养10 min,再加入冷却的400 μl结合缓冲液,1 h内采用流式细胞仪进行细胞计数,观察并比较各组细胞的凋亡率。实验重复3次。
1.2.5 凋亡蛋白及JAK/STAT信号通路蛋白表达水平的检测 凋亡蛋白cleaved caspase 3及JAK/STAT信号通路蛋白p-JAK2和p-STAT3表达水平的检测参照1.2.2方法。
1.3 统计学方法
采用SPSS 21.0软件对-数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SRGN蛋白在乳腺癌细胞及正常乳腺上皮细胞中的表达水平
Western blot检测结果显示,正常乳腺上皮细胞MCF-10A及乳腺癌细胞MDA-MB-231、SMMC-7721、MCF7、HCC1569中SRGN蛋白的表达水平分别为(0.096±0.011)、(0.526±0.057)、(0.312±0.038)、(0.488±0.052)、(0.301±0.029),5 种细胞中SRGN蛋白的表达水平比较,差异有统计学意义(F=53.043,P<0.01)。乳腺癌细胞MDA-MB-231、SMMC-7721、MCF7、HCC1569中SRGN蛋白的表达水平均高于正常乳腺上皮细胞MCF-10A,差异均有统计学意义(P<0.05)。(图1)

图1 SRGN在乳腺癌细胞及正常乳腺上皮细胞中的表达
2.2 转染SRGN siRNA对MDA-MB-231细胞中SRGN蛋白表达水平的影响
SRGNsiRNA转染MDA-MB-231细胞48 h,Western blot检测结果显示,空白对照组、siRNACon组和siRNA-SRGN组中SRGN蛋白的表达水平分别为(0.337±0.042)、(0.316±0.040)、(0.087±0.010),3组比较,差异有统计学意义(F=49.963,P<0.01)。siRNA-SRGN组的SRGN蛋白表达水平低于空白对照组,差异有统计学意义(P<0.05),siRNA-Con组和空白对照组的SRGN蛋白表达水平比较,差异无统计学意义(P>0.05)。(图2)

图2 转染SRGN siRNA对MDA-MB-231细胞中SRGN蛋白表达水平的影响
2.3 转染SRGN siRNA对MDA-MB-231细胞凋亡的影响
空白对照组、siRNA-Con组和siRNA-SRGN组的细胞凋亡率分别为(2.20±0.32)%、(2.28±0.38)%、(11.16±1.22)%,3组比较,差异有统计学意义(F=137.571,P<0.01)。与空白对照组比较,siRNA-SRGN组的细胞凋亡率升高,差异有统计学意义(P<0.05)。(图3)
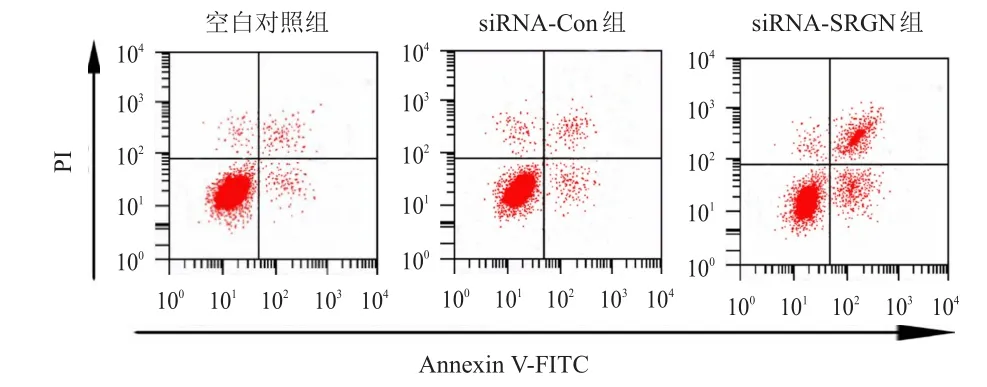
图3 转染SRGN siRNA对MDA-MB-231细胞凋亡的影响
2.4 转染SRGN siRNA对凋亡蛋白及JAK/STAT信号通路蛋白表达水平的影响
空白对照组、siRNA-Con组和siRNA-SRGN组的cleaved caspase 3蛋白表达水平分别为(0.037±0.007)、(0.048±0.008)、(0.125±0.012),p-JAK2蛋白表达水平分别为(0.189±0.020)、(0.192±0.022)、(0.044±0.010),p-STAT3蛋白表达水平分别为(0.147±0.013)、(0.156±0.015)、(0.028±0.006),3组的cleaved caspase 3、p-JAK2、p-STAT3蛋白表达水平比较,差异均有统计学意义(F1=80.510、F2=65.454、F3=106.835,P<0.01)。与空白对照组比较,siRNA-SRGN组的cleaved caspase 3蛋白表达水平升高,p-JAK2和p-STAT3蛋白表达水平均下降,差异均有统计学意义(P<0.05)。(图4)
3 讨论

图4 转染SRGN siRNA对凋亡蛋白及JAK/STAT信号通路蛋白表达水平的影响
近年来乳腺癌基因的研究成为热点,已有多个分子标志物应用于乳腺癌的临床诊断及治疗,但仍需发现更多的基因治疗靶点。SRGN属于小分子蛋白聚糖家族中的一员,可存在于细胞内,也可存在于细胞外,主要在内皮细胞、一些肿瘤细胞及胚胎干细胞中表达[4-6]。有研究发现,SRGN的表达与肿瘤的形成及转移密切相关,鼻咽癌细胞中SRGN的表达可促进癌细胞转移及上皮间质转化样改变[7];SRGN在急性髓系白血病中的表达升高与肿瘤形成有关[8];乳腺癌细胞中SRGN的表达升高,可提高肿瘤细胞的转移及侵袭能力[2-3],然而SRGN对乳腺癌细胞凋亡的影响尚未清楚。
本研究采用Western blot检测正常乳腺上皮细胞和不同乳腺癌细胞中SRGN蛋白的表达水平,结果发现乳腺癌细胞中SRGN蛋白的表达水平高于正常乳腺上皮细胞,由于SRGN在乳腺癌细胞MDA-MB-231中的表达水平最高,因此被选择作为本实验的研究对象。RNA干扰技术是近些年来发展起来的可使基因在转染后发生沉默的技术,具有特异性和高效性,在肿瘤治疗及基因功能研究等领域广泛应用[9-10]。本研究通过RNA干扰技术沉默MDA-MB-231细胞中SRGN的表达,并采用流式细胞术检测细胞凋亡率,结果发现,抑制SRGN的表达可使MDA-MB-231细胞的凋亡率升高。细胞凋亡受到Caspases家族影响,caspase 3是Caspases家族中的关键酶,位于级联反应的下游,生理条件下caspase 3以无活性的酶原形式在哺乳动物细胞及组织中存在,当有凋亡刺激时被活化,活化的caspase 3可导致细胞凋亡的不可逆[11-12]。目前caspase 3已作为包括乳腺癌细胞在内的多种细胞凋亡的检测[13-14]。本研究结果显示,SRGN表达受抑制后cleaved caspase 3的表达升高,提示SRGN促进乳腺癌细胞凋亡可能是通过上调cleaved caspase 3的表达实现。JAK/STAT信号通路参与细胞的增殖、凋亡、迁移、分化及免疫调节等生理过程,在多种肿瘤细胞中处于激活状态[15-16]。有研究表明,JAK/STAT信号通路对于乳腺癌细胞的增殖及凋亡具有重要作用,抑制该信号通路可抑制癌细胞的发生及发展[17]。本研究发现,抑制SRGN的表达可抑制JAK/STAT信号通路中p-JAK2和p-STAT3蛋白的表达,提示SRGN可正向调控JAK/STAT信号,诱导乳腺癌细胞凋亡。
综上所述,SRGN在乳腺癌细胞中的表达升高,通过RNA干扰抑制其表达后可诱导癌细胞凋亡,并下调JAK/STAT信号通路蛋白的表达水平,其诱导细胞凋亡的方式是上调cleaved caspase 3的表达。本研究为深入探讨乳腺癌的发病机制奠定了一定的基础,提示SRGN可能成为乳腺癌的分子诊断及治疗靶点。但本研究内容有限,且未在体内试验中验证,因此尚需进一步研究。
[1]Neophytou CM,Constantinou C,Papageorgis P,et al.D-alpha-tocopheryl polyethylene glycol succinate(TPGS)induces cell cycle arrest and apoptosis selectively in Survivinoverexpressing breast cancer cells[J].Biochem Pharmacol,2014,89(1):31-42.
[2]Roy A,Femel J,Huijbers EJ,et al.Targeting serglycin prevents metastasis in murine mammary carcinoma[J].PLoS One,2016,11(5):e0156151.
[3]张志杰,邓印根,尹江,等.miR-181b/c靶向调控SRGN抑制乳腺癌细胞侵袭转移[J].中国医师杂志,2014,16(9):1164-1167;1171.
[4]Reine TM,Vuong TT,Jenssen TG,et al.Serglycin secretion is part of the inflammatory response in activated primary human endothelial cells in vitro[J].Biochim Biophys Acta,2014,1840(8):2498-2505.
[5]Roy A,Attarha S,Weishaupt H,et al.Serglycin as a potential biomarker for glioma:association of serglycin expression,extent of mast cell recruitment and glioblastoma progression[J].Oncotarget,2017,8(15):24815-24827.
[6]Purushothaman A,Bandari SK,Chandrashekar DS,et al.Chondroitin sulfate proteoglycan serglycin influences protein cargo loading and functions of tumor-derived exosomes[J].Oncotarget,2017,8(43):73723-737732.
[7]Chia CS,Ong WS,Li XJ,et al.Serglycin expression:an independent marker of distant metastases in nasopharyngeal carcinoma[J].Head Neck,2016,38(1):21-28.
[8]Purushothaman A,Toole BP.Serglycin proteoglycan is required for multiple myeloma cell adhesion,in vivo growth,and vascularization[J].J Biol Chem,2014,289(9):5499-5509.
[9]樊蓓,李红霞,吴玉梅,等.小分子干扰RNA抑制TNC基因的表达并逆转卵巢癌紫杉醇耐药[J].癌症进展,2017,15(7):749-753.
[10]Li-Byarlay H,Li Y,Stroud H,et al.RNA interference knockdown of DNA methyl-transferase 3 affects gene alternative splicing in the honey bee[J].Proc Natl Acad Sci U S A,2013,110(31):12750-12755.
[11]任吉祥,刘爽,孙洋,等.新型肿瘤抑素对C6神经胶质瘤细胞抑制作用的影响[J].中国老年学杂志,2016,36(19):4705-4706.
[12]Wu R,Tang S,Wang M,et al.MicroRNA-497 induces apoptosis and suppresses proliferation via the Bcl-2/Bax-Caspase9-Caspase3 pathway and cyclin D2 protein in HUVECs[J].PLoS One,2016,11(12):e0167052.
[13]Xie X,Hu Y,Xu L,et al.The role of miR-125b-mitochondria-caspase-3 pathway in doxorubicin resistance and therapy in human breast cancer[J].Tumour Biol,2015,36(9):7185-7194.
[14]刘宁,谭文成,夏吉生,等.miR-34a靶向MMP-13调控大鼠软骨细胞凋亡的机制[J].暨南大学学报(自然科学与医学版),2016,37(2):139-145.
[15]Kowshik J,Baba AB,Giri H,et al.Astaxanthin inhibits JAK/STAT-3 signaling to abrogate cell proliferation,invasion and angiogenesis in a hamster model of oral cancer[J].PLoS One,2014,9(10):e109114.
[16]Hu Y,Hong Y,Xu Y J,et al.Inhibition of the JAK/STAT pathway with ruxolitinib overcomes cisplatin resistance in non-small-cell lung cancer NSCLC[J].Apoptosis,2014,19(11):1627-1636.
[17]Slattery ML,Lundgreen A,Hines LM,et al.Genetic variation in the JAK/STAT/SOCS signaling pathway influences breast cancer-specific mortality through interaction with cigarette smoking and use of aspirin/NSAIDs:the Breast Cancer Health Disparities Study[J].Breast Cancer Res Treat,2014,147(1):145-158.
