巢氏PCR检测血片中低密度间日疟原虫的研究*
2018-07-06尚婧晔郁涛邹晏李黎刘阳
尚婧晔 郁涛 邹晏 李黎 刘阳
(四川省疾病预防控制中心,四川 成都 610041)
疟疾是严重危害人类身体健康和生命安全,影响流行区社会经济发展的全球性重要虫媒传染病[1-3]。四川省曾经是全国疟疾疫情最严重的地区之一,最高感染率达87.4/万,发病人数一度超过50多万[4-5]。建国以来,经过半个世纪的努力,四川省疟疾防治工作取得了显著成效,流行范围逐步减小,人群发病率逐渐降低,2010年全省疟疾防治工作正式进入消除阶段,自2011年起已连续7年无本地感染病例报道[5-8]。尽管如此,疟疾仍然是目前四川省最重要的公共卫生问题之一。近年来,随着赴境外务工人数的不断增加,输入性疟疾病例数不断增加,并持续出现死亡病例,输入性疟疾形势异常严峻[8]。在现阶段新发病例少、感染程度低、用药普遍、输入性为主的防控新形势下,如何提升早期、药后低密度疟原虫检测能力,实现及时诊断,准确鉴别本地、输入、变异病例,控制继发性感染,防止疫情爆发,是目前疟疾防控面临的重要难题。
本研究以人工模拟制成不同浓度梯度的间日疟原虫血片,通过优化DNA提取前处理方法,结合巢式PCR扩增,测定其最低检出限,探索巢式PCR用于低密度疟原虫血片DNA检测的可行性,为疟疾低度感染病例提供行之有效的早期诊断方法,并为下一步探索区分本地流行与输入性、变异性疟疾提供实验基础。
1 材料与方法
1.1 样本来源及试剂、设备 感染性血液样本保存于四川省疾病预防控制中心疟疾诊断参比实验室,来源为1例2014年广安市岳池县间日疟死亡病例,经四川省疾控中心专家镜检、PCR复核,确认为高密度间日疟原虫感染血样。稀释用血样保存于四川省疾控中心门诊,来源为健康人抗凝血。DNA抽提试剂盒(QIAamp DNAMini Kit)购自德国Qiagen公司,2×Power Taq PCR Master Mix以及引物购自成都擎科生物技术有限公司,DNA标志物购自宝生物工程(大连)有限公司,核酸染料购自北京索莱宝科技有限公司,琼脂糖购自西班牙Biowest公司,甲醇、无水乙醇和二甲苯购自国药集团化学试剂有限公司,吉氏色素购自成都市科龙化工试剂厂,2.58%的吉氏染料自制备用。DNA自动提取采用Qiagen核酸纯化仪QIAcube。
1.2 方法
1.2.1 不同浓度梯度间日疟原虫血片的制备 将具有较高密度的原始间日疟原虫抗凝血血样常温放置溶解,观测无血凝块后,采用健康人抗凝血作为稀释液,按照1:10、1:100、1:1000、1:2000、1:4000、1:8000、1:16000、1:32000对原浓度血样进行稀释,制成9个浓度梯度血样。每个浓度同时制作2张标准血片,厚血膜、薄血膜分别以5ul、2ul进行定量制作,采用吉氏染色法染色。原样标准血片标记为O,其余血样片按照稀释度的增加依次标记为A、B、C、D、E、H。
1.2.2 血片镜检 每张血片同时由两名具有丰富经验的疟原虫镜检专家进行显微镜观察,确定每一浓度所有血片的镜下计数结果。镜检计数方法采用由WHO推荐的白细胞疟原虫计算公式:疟原虫数÷白细胞数×每uL血中白细胞数= 疟原虫数/uL血。此计算公式若用于无法进行白细胞计数的样本,则以国际标准按8000个/mL血白细胞进行计算。厚血膜检查200个油镜视野,若未发现疟原虫则记为阴性[9],当某一浓度2张血片都为阴性时,该浓度的上一浓度即作为间日疟疟原虫的显微镜检出限。
1.2.3 DNA提取
1.2.3.1 所有浓度血片在镜检后进行一次简单的脱片晾干。
1.2.3.2 根据文献报道[10],采用DNA试剂盒改良法,在厚血膜表面滴1~2滴预热的ATL裂解液,用无菌手术刀片将整个血膜刮下,使其全部与ATL液混合后加入无菌2 ml EP管底。薄血膜直接采用无菌手术刀片缓慢刮取,最后滴上ATL裂解液混合加入EP管底。
1.2.3.3 所有样本漩涡震荡10s,8000×g离心l min,加入适量ATL裂解液,85℃孵育10min。根据DNA抽提试剂盒(QIAamp DNA Mini Kit)操作步骤设置程序,将样本放入核酸自动提取仪中进行DNA自动提取。
1.2.4 巢式PCR扩增
1.2.4.1 参照文献设计引物[11-12](根据疟原虫SSU rRNA基因保守区所设计的PCR引物)进行巢氏PCR扩增。rPLU5和rPLU6为疟原虫属特异性引物,RVIV为间日疟原虫(P. vivax)种特异性引物。引物由成都擎科生物科技有限公司合成,具体引物序列和预期片段长度,见表1。

表1 疟原虫特异性引物 Table 1 Specific primers
1.2.4.2 反应体系 2 ×Master Mix 10μl, 上、下游引物(10 μmol/L) 各1μl, DNA模板2μl,ddH2O6μl,总反应体积20μl。
1.2.4.3 反应条件 第1 轮94 ℃3 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃90 s, 共34个循环, 72 ℃ 5 min。第2轮94 ℃ 3 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 60 s, 共34个循环, 72 ℃5 min。
1.3 电泳检测 取10μl第2轮PCR产物进行2%琼脂糖凝胶电泳分析。
1.4 测序比对 第2轮PCR产物送往成都擎科生物有限公司测序,结果上传NCBI进行Blast比对分析。
2 结果
2.1 血片镜检 由2名具有丰富经验的疟原虫镜检专家镜下观察计数,在第3个稀释度后镜检结果均为阴性,即1:100为疟原虫血片的显微镜检出限,见表2。
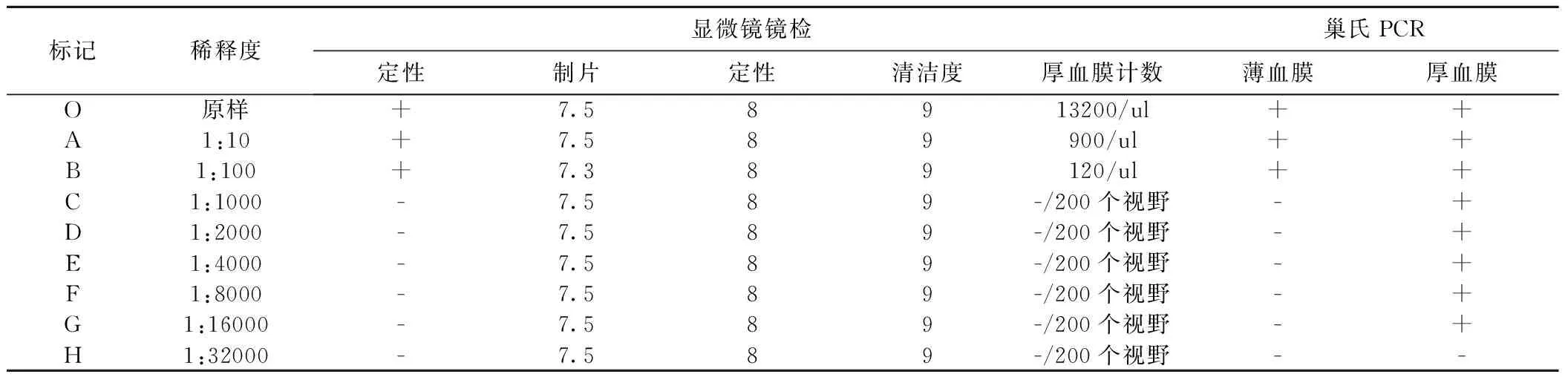
表2 不同浓度梯度检出限汇总表 Table 2 The detection threshold for P. vivax
2.2 巢式PCR扩增 经过巢氏PCR扩增、琼脂糖电泳,疟原虫血片薄血膜、厚血膜分别在第3个和第8个稀释度后检出均为阴性,即疟原虫血片薄血膜检出限为1:100,厚血膜检出限1:16000,见图1、表2。
2.3 测序和序列比对结果 第二轮PCR扩增产物经测序、blast比对,结果显示产物序列与GenBank中已登记的间日疟原虫参考序列一致性为100%,见图2。
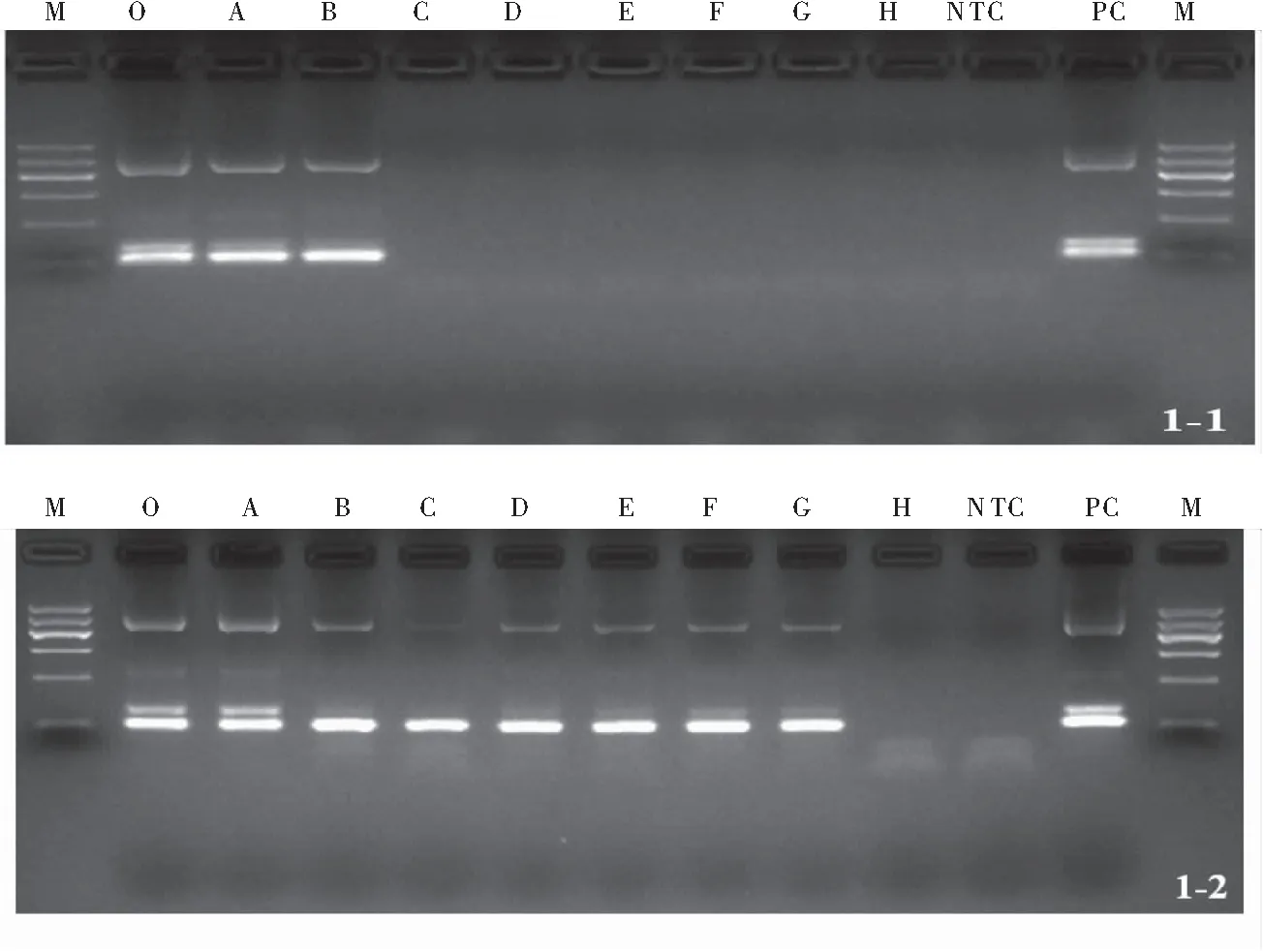
图1 PCR扩增结果 Figure 1 PCR results
注:1-1:薄血膜提取DNA PCR扩增结果;1-2:厚血膜提取DNA PCR扩增结果。O:原样; A:1:10稀释度;B:1:100稀释度;C:1:1000稀释度;D:1:2000稀释度;E:1:4000稀释度;F:1:8000稀释度;G:1:16000稀释度;H:1:32000稀释度;M:DNA标志物;NTC:无模板对照;PC:阳性对照
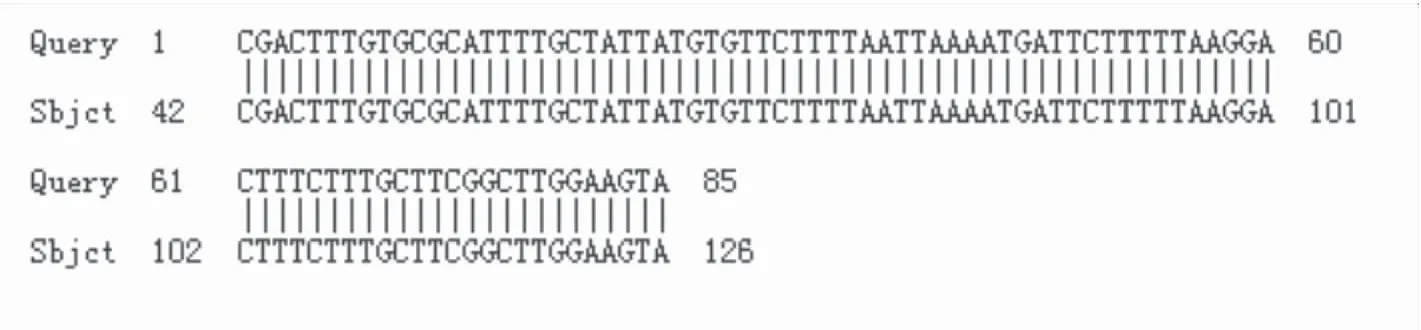
图2 核酸序列比对图 Figure 2 The alignment of nucleotide sequence
3 讨论
近年来随着分子生物学技术的不断发展,以巢式PCR为代表的分子生物学方法开始逐渐被应用于疟疾的实验室检测中[13-17]。尽管显微镜下观察、鉴别、计数作为病原学的经典方法目前仍被视为金标准广泛应用于疟疾诊断,但在当下已进入疟疾消除阶段,流行程度普遍较低,感染程度往往较轻的情况下,对于早期仅含有较低密度病原的无症状或症状较轻的患者,以及已服用抗疟药物的患者,若仅采用显微镜观察,显然具有较大的局限性,难以进行及时诊断并实现准确鉴别,极易造成漏诊。本次研究结果表明,巢式PCR检测间日疟原虫血片厚血膜提取DNA的检出限为0.8个虫/μl血,符合此前Scopel等[18]的报道结果——厚血膜中疟原虫密度小于20个/μl时,巢式PCR依然能够扩增出阳性条带——相较之下本次检出灵敏度更高,更远低于显微镜检出限132个/ul血。薄血膜DNA的提取与扩增效果相对较差,其检出限与镜下检查水平一致,这可能与薄血膜涂制血量少,涂布面大而导致血片刮取样本耗损多,以及血片镜检后进行过一次脱片有关。总的来说,相较于镜下观察,基于DNA提取的巢式PCR技术作为显微镜检查的有效补充方法之一,灵敏度显著提升,对于低密度疟原虫感染诊断具有较高的应用意义。
PCR的扩增效果取决于多种因素,其中从样本中提取到的DNA浓度和质量是决定PCR成功与否及其检出灵敏度的关键因素。李轲[19]等报道以血样直接提取DNA为样本进行巢式PCR扩增,最低可检出达到0.0856个虫/ul血,检出灵敏度相较于以血片为载体、从血膜中提取DNA为样本的本次研究结果高出近一个数量级,其原因一方面在于全血样本可用于提取DNA的血样量大,提取病原总量较多(同等密度下),另一方面可能与血片取膜时具有一定损耗有关。尽管全血样用于疟原虫DNA的提取效果较佳,尤其是在病原密度较低的情况下,但其运输条件相对复杂,且无法长期保存,难以满足现阶段疟疾多项目检测并行的需求。血片作为疟疾样本检测、保存最主要、最常见的载体之一,具有制作所需血量小、价格低廉、可长久保存的特点,长期以来被广泛应用于各级检测机构,也是多数早期疟疾病人现有留存的唯一样本证据。从血片中提取疟原虫DNA具有较大的困难性,尤其是对于年代已久的陈旧血片,因早年制作不规范,保存条件不当,加上经过染色、反复洗脱、复染而导致留存疟原虫处于较低密度状态[20]。本次研究结果显示,通过改进前处理方法结合巢式PCR扩增可从血片中成功检出疟原虫,尤其是厚血膜,在较低密度下仍可获得较高质量的核酸,证实了血片应用于疟疾的分子生物学检测的可行性,为提取陈旧性血片中疟原虫DNA用于回顾性研究不同阶段疟疾防治进程中疟原虫基因型和多态性变化,以实现病例来源(本地、输入、变异)追溯提供了实验基础。本次研究结果也提示我们,在血片薄血膜的DNA提取方法上还有待进一步的探索和提高,尝试耗损更小、精确度更高的DNA提取方法。
值得注意的是,尽管制成的血片可以固定疟原虫虫体,但在其长期保存与反复用于镜检的过程中,仍然存在部分虫体发生变形、裂解,在镜下难以识别辨认的可能,造成镜检计数低于实际感染水平的情况,而类似状况在在现实工作中实际普遍存在。不同于依赖形态鉴别为手段的显微镜检查,以DNA为模板的PCR方法更为稳定,因为DNA在虫体裂解后仍可长期存在,形态是否完整对其扩增并不具有太大影响,这也是造成分子生物学检测灵敏度远高于镜检的重要原因之一。为准确、定量反应血片样本尤其是陈旧性血片样本中疟原虫载量,比较显微镜镜下计数与实际感染水平、巢式PCR与其它不同分子生物学方法检测能力的差异大小,并进一步提升疟原虫血片中病原DNA的检测灵敏度,本课题组后续将进一步采用qPCR方法进行相关检测,以期获得更为全面、准确的比对数据。
4 结论
研究结果显示,血片作为常规检测和保存载体,可有效应用于疟原虫DNA的提取,结合巢氏PCR扩增,获得显著高于显微镜的检测水平,尤其是厚血膜检出限达到0.8个虫/μl血,提示以高质量DNA提取为基础的巢氏PCR方法更适宜于作为检测低密度感染疟疾的有效手段。
【参考文献】
[1]World Health Organization. World malaria report 2010[M]. Geneva: WHO Press, 2010.
[2]中华人民共和国卫生部疾病预防控制局.疟疾防治手册[M]. 第3版. 北京: 人民卫生出版社, 2007: 256-263.
[3]高琪. 我国消除疟疾面临的机遇与挑战[J]. 中国血吸虫病防治杂志,2011, 23(04): 347-349.
[4]吴先萍,许国君,康杨, 等. 四川省输入性疟疾现况与特征[J]. 现代预防医学, 2009, 36(24): 4667-4669.
[5]许国君,李黎,郁涛, 等. 四川省疟疾流行态势与消除疟疾进展[J]. 预防医学情报杂志, 2014, 30(09): 783-787.
[6]李黎,刘阳,许国君, 等. 2012-2014年四川省疟疾疫情分析[J]. 中国血吸虫病防治杂志, 2016, 28(04): 397-400.
[7]李黎, 许国君, 郁涛, 等. 2011年-2013年四川省输入性疟疾疫情与诊治情况分析[J]. 预防医学情报杂志, 2015, 31(6): 471-475.
[8]李黎, 刘阳, 许国君, 等. 四川省2015年输入性疟疾流行病学特征分析[J]. 中国寄生虫学与寄生虫病杂志, 2017, 35(01): 75-79.
[9]疟原虫镜检手册[M]. 成都: 四川科学技术出版社, 1990. 37.
[10] 徐超, 魏庆宽, 李瑾, 等. 提取陈旧阳性血膜疟原虫DNA方法的研究[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(5): 372-376.
[11] 李静宜, 齐志群, 薛燕萍, 等. Chelex法从恶性疟原虫薄血涂片提取 DNA 的基因诊断[J].中华传染病杂志, 2008, 26( 5): 372-376.
[12] Snounou G, Viriyakosol S, Zhu XP,etal. High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction[J]. Mol Biochem Parasitol, 1993, 61(2): 315-320.
[13] 武松, 黄芳, 张国庆, 等. 巢氏PCR判定西藏疟疾流行区传疟媒介[J]. 中国人兽共患病学报, 2010, 26(07): 648-650,653.
[14] 周瑞敏,刘颖,钱丹, 等. 2012年河南省疟疾标本的实验室检测分析[J]. 中国病原生物学杂志,2014,9(02):177-179.
[15] 田斌, 段绩辉, 徐明忠, 等. 三例输入性卵形疟的实验室诊断[J]. 检验医学, 2014, 29(08): 851-855.
[16] 周瑞敏, 张红卫, 邓艳, 等. 2例输入性卵形疟的实验室检测[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(02): 127-130.
[17] 陈玉凤, 纪颖, 肖冰. 2015年大连市疟疾病例实验室检测结果分析[J]. 微量元素与健康研究, 2016, 33(6): 67-68.
[18] Scopel KKG, Fontes CJF, Nunes C,etal. Low sensitivity of nested PCR using Plasmodium DNA extracted from stained thick blood smears: an epidemiological retrospective study among subjects with low parasitaemia in an endemic area of the Brazilian Amazon region[J]. Malaria J, 2004, 3(1): 8.
[19] 李轲, 周水森, 黄芳, 等. 3种PCR方法检测低密度恶性疟原虫血症的比较研究[J]. 中国病原生物学杂志, 2013, 8(04): 331-335.
[20] Kimura M, Kaneko O, Inoue A,etal. Amplification by polymerase chain reaction of Plasmodium falciparum DNA from Giemsa-stained thin blood smears[J]. Mol Biochem Parasitol, 1995, 70 (1):193-197.
