结缔组织病相关间质性肺病继发肺动脉 高压的临床及影像分析
2018-07-06冯艳郭兆军杨奕陈宏山李志军
冯艳 郭兆军 杨奕 陈宏山 李志军
(安徽省淮南市第一人民医院·安徽理工大学第一附属医院1.风湿免疫科;2.CT室,安徽 淮南232000; 3.蚌埠医学院第一附属医院风湿免疫科,安徽 蚌埠233004)
结缔组织病是以免疫紊乱为基础的累及多系统、多脏器的全身性疾病,包括系统性红斑狼疮(SLE)、类风湿关节炎(RA)、干燥综合征(SS)、多发性肌炎/皮肌炎(PM/DM)、系统性硬化症(SSc)、混合结缔组织病(MCTD)等。间 质 性 肺 病是指急、慢性肺间质病变导致肺泡壁、肺泡腔发生不同程度的炎症及纤维素性渗出,以弥漫性肺实质、肺泡炎症和间质纤维化为基本病理改变,以活动性呼吸困难、胸片示弥漫阴影、限制性通气障碍、弥散功能降低和低氧血症为临床表现的不同类疾病群构成的临床病理实体的总称。ILD是CTD常见并发症之一,其发病隐匿,临床症状无特异性,早期诊断困难。肺动脉高压(pulmonary arterial hypertension,PH)是一组以肺动脉平均压升高为特征的临床病理生理综合征。结缔组织疾病(CTD)是继发性PH第二大常见病因[1]。CTD继发PH发病率高,约占PH的20%,是结缔组织最重要的致残及死亡因素。早期预防、诊断和治疗PH是影响PH预后的重要因素。本文就CTD-ILD有无继发PH临床及影像学特点进行分析,为CTD-ILD继发PH患者的早期预防、诊断、治疗提供帮助。
1 资料与方法
1.1 一般资料 收集2011年8月~2017年6月安徽省淮南市第一人民医院·安徽理工大学第一附属医院风湿免疫科住院的CTD-ILD患者278例,分为CTD-ILD组233例和CTD-ILD-PH组45例。
1.2 诊断标准
1.2.1 CTD-ILD的诊断 目前国内尚无明确的诊断标准,本研究采用张晓等[2]提出的诊断标准:①临床确定弥漫性CTD。②有以下4项中的任意2项:临床上有咳嗽、气促、胸闷、肺底啰音中的任意1项或以上表现;HRCT表现为小叶间隔增厚、胸膜下弧影、毛玻璃影、实变影、网格影、蜂窝影;肺功能为限制性通气功能障碍(用力肺活量预计值FVC%pred<80%)和/或一氧化碳弥散量预计值D1CO%pred<60%;肺活检为肺间质病变,表现为肺泡间隔增厚、淋巴细胞浸润、胶原沉积、纤维组织增生。③临床未见任何病原体感染证据且抗感染治疗5~7d无效。符合以上3点考虑CTD-ILD。
1.2.2 PH的诊断 以经胸心脏彩色多普勒超声估测肺动脉压力,彩色多普勒超声测肺动脉压力≥40 mmHg为阳性结果[3]。
1.2.3 排除标准 凡确诊先天性心脏病、风湿性心脏病、心脏瓣膜病、左心衰竭、肺癌、肺栓塞、COPD、结节病、原发性血管炎、病毒感染、HIV感染、门静脉高压、恶性肿瘤放、化疗者均需排除。
1.3 方法 分析两组患者临床症状、血清学指标、肺功能、心脏彩超、肺CT/HRCT。

2 结果
2.1 两组患者患病率 CTD-ILD患者与CTD-ILD-PH患者原发病患病率,见表1。
2.2 两组患者临床表现 45例PH患者肺动脉压力在40~109mmHg之间,肺动脉压力在40~69mmHg之间有37例占82.2%,肺动脉压力≥70 mmHg者有8例占17.8%。两组患者的性别、年龄、咳嗽、咳痰、发热、乏力、关节痛、晨僵、皮疹、口干、眼干、口腔溃疡、脱发、肌痛、胸闷差异无统计学意义(P<0.05);CTD-ILD组 气短65例占27.9%,CTD-ILD-PH组气短27例占60%,CTD-ILD组呼吸困难14例占6%,CTD-ILD-PH组呼吸困难11例占24.4%,CTD-ILD组雷诺现象47例占20.2%,CTD-ILD-PH组雷诺现象23例占51.1%,CTD-ILD组皮肤硬化7例占3%,CTD-ILD-PH组皮肤硬化4例占8.9%,CTD-ILD-PH组气短、呼吸困难、雷诺现象和皮肤硬化的发生率显著高于CTD-ILD组,差异均有统计学意义(P<0.05)。

表1 两组患者CTD原发病患病率 Table 1 Prevalence of CTD in the two groups
注:SLE为系统性红斑狼疮;RA为类风湿关节炎;pSS为原发性干燥综合征;PM/DM为多发性肌炎/皮肌炎;MCTD为混合性结缔组织病;SSc为系统性硬化症。余表备注同此。
2.3 两组患者血清抗体比较 两组患者全部行血清抗体检测,CTD-ILD-PH组ANA抗体阳性率显著高于CTD-ILD组(P<0.05),Sm、dsDNA、SSA、SSB、Ro-52、U1RNP、Scl-70、Jo-1、AMA、P0、核小体抗体两组抗体阳性率无统计学意义(P>0.05),见表2。
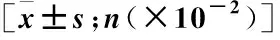
表2 两组患者血清抗体阳性率比较 Table 2 Comparison of positive rate of serum antibody between the two groups
注:与CTD-ILD组比较,①P<0.05;与CTD-ILD组比较,②P>0.05
2.4 两组患者肺功能比较 由于患者依从性、病情严重程度等因素影响,临床上对肺功能检查完成率较低,278例患者中,30例患者完善例肺功能检查,CTD-ILD组21例、CTD-ILD-PH组9例。CTD-ILD组、CTD-ILD-PH组FVC%pred分别为(72.8±17.1)、(59.6±23.7),两组D1CO%pred分别为(65.3±18.9)、(50.2±22.6),CTD-ILD-PH组FVC%pred、D1CO%pred显著低于CTD-ILD组(P<0.05)。
2.5 两组患者心脏彩超比较 CTD-ILD-PH组患者右室内径、右室流出道内径、肺动脉内径显著高于CTD-ILD组(P>0.05),见表3。

表3 两组心脏彩超比较 Table 3 Comparison of cardiac color Doppler ultrasound between the two groups
注:与CTD-ILD组比较,①P<0.05
2.6 两组患者胸部CT/HRCT比较 两组患者均行肺部CT/HRCT检查,肺部CT/HRCT下可见不规则线状影或胸膜下线、网格影、实变影、薄壁囊肿、结节灶、支气管血管束增厚、肺大泡、蜂窝肺、毛玻璃样变、小叶间隔增厚、肺动脉增粗、心影增大等表现(见图1);CTD-ILD-PH组网格影、实变影、肺动脉增粗、心影增大的发生率较CTD-ILD组显著增高(P>0.05),见表4。
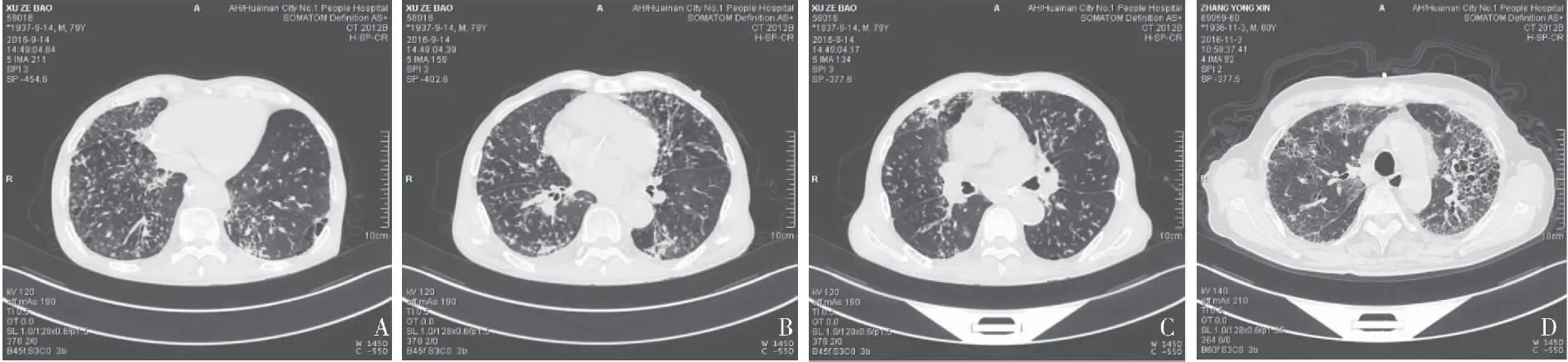
图1CTD-ILD肺HRCT影像学表现[n(×10-2]Figure1CTD-ILDlungHRCTimagingfinding
注:a:小叶间隔增厚,小肺大泡,薄壁囊肿;b:小叶间隔增厚,胸膜下线,支气管血管束增厚;C:毛玻璃结节、网格影、小叶间隔增厚;d:网格影、支气管血管束增厚、蜂窝肺、小叶间隔增厚

表4 两组胸部CT/HRCT 比较 Table 4 Comparison of chest CT / HRCT between the two groups
注:与CTD-ILD组比较,①P<0.05
3 讨论
CTD-PH的发病机制尚未完全阐明,肺血管收缩和重塑是其重要发病环节。多种炎症细胞和炎症因子均参与CTD-PH的发病。临床症状如气短、呼吸困难、雷诺现象等发病机制可能与肺小动脉收缩、肺血管炎、肺小动脉血栓的发病机制有关,提示气短、呼吸困难、雷诺现象等临床症状可能于PH的发生有关。该研究证实CTD-ILD-PH组气短、呼吸困难、雷诺现象和皮肤硬化的发生率显著高于CTD-ILD组,这与温海艳[4]等研究结果相一致。
CTD-ILD 发生率报道差异较大,约在 19% ~34%,CTD 中RA 、SLE、pSS、PM/DM合并 ILD 较多见[5-6]。 本研究CTD-ILD 患者原发病与上述报道较多见相一致。本研究中CTD继发ILD的发病率为18.9%,与唐开奖研究结果相一致[7]。本研究CTD-ILD继发PH的发病率为16.2%,温海艳[4]等研究证实CTD-ILD发生PH的发病率为13.11%,两研究结果基本相符。Can Huang[8]等通过二元多元逻辑回归分析相关变量证实间质性肺病的存在等因素于SLE患者的PH相关。
温海艳[4]、李杰[9]等研究证实,ANA阳性者更易继发PH,本研究 CTD-ILD-PH组ANA抗体阳性率显著高于CTD-ILD组。StephenC Mathai[10]等提出, CTD-ILD患者可能具有临床特征,存在非特异性抗体如阳性ANA,但是不存在更特异性的抗体,提出了一种新的CTD类别,又被称为自身免疫性ILD。ATS/ERS协商一致声明为特定用于研究目的间质性肺炎与自身免疫特征的分类提供了一些指导,这种新的设计可能有助于CTD-ILD持续的研究,但对于某些患者诊断的不确定性并没有帮助[11]。
右心导管是确诊PH最可靠的方法,也是诊断PH的金标准,但是有创诊断。多普勒超声心动图因其无创、操作简便等特点在临床广泛应用。国内文斌[12]研究显示右心导管测量肺动脉压力与多普勒超声心动图测量结果无明显差异。本研究经多普勒超声心动图检查CTD-ILD-PH组右室内径、右室流出道内径、肺动脉内径结果与文斌[12]、温海艳[4]等研究结果相一致。但国外Srinivast Rajagopala[13]等研究证实无症状和一氧化碳弥散量预计值正常的SSc患者常规超声心动图不具有非常低的监测值和假阴性;通过结构性评估单独检测超声心动图31%的患者SSc-PH可能会漏诊。因此多普勒超声心动图可作为PH筛查、治疗随访有价值的指标,但作为PH早期诊断标准还有待进一步研究证实。
CTD-ILD患者肺功能的主要表现为弥散功能障碍和限制性通气功能障碍,且弥散功能障碍是反映 ILD 最灵敏的肺功能指标。本研究CTD-ILD-PH组、CTD-ILD组FVC%pred、D1CO%pred降低,存在弥散功能障碍和限制性通气功能障碍,且CTD-ILD-PH组FVC%pred、D1CO%pred显著低于CTD-ILD组,与温海艳[4]等研究结果相一致。Chaisson NF[14]等研究证实SSc风险因素包括年龄、长期持续性疾病、局限性SSc、晚期或进展期ILD(FVC%pred、D1CO%pred降低)、临床表现(雷诺现象,广泛毛细血管扩张症)和免疫学(着丝粒,抗U1核糖核蛋白和核仁型抗核抗体)。 最近的前瞻性研究[15]发现低水平的一氧化碳弥散量(D1CO)、高水平的用力肺活量(FVC)与一氧化碳弥散量(D1CO)的比值、运动诱发的低氧血症以及彩色超声心动图提示肺动脉收缩压>40mmHg 均与SSc相关PAH 密切相关。
CTD-ILD早期诊断与治疗对提高CTD病人生存质量及生存期有重要意义。张静等[16]通过对90例CTD-ILD患者临床特征、影像等分析证实对ILD患者进行CTD筛查,将有利于指导临床治疗,有助于对疾病的诊断、治疗方案选择及预后的判断。国外Arqiriadiar等[17]研究认为HRCT是一种可以对全肺进行无间隔的扫描技术,无创伤性,其不但对疾病在整个肺内的情况有全面的认识,且敏感性及特异性均高于X线,能清晰分辨毛玻璃影、实变影、网格影、蜂窝影、结节影、肉芽肿影、肺气肿和支气管扩张,并能区分出那些病人能够从肺活检中获益,是诊断CTD-ILD有效手段。CTD-ILD的放射学和组织病理学表现广泛模型[18-19],包括间质性肺炎模型、细胞和纤维化非特异性间质性肺炎模型、通常间质性肺炎模型、淋巴细胞性间质性肺炎模型、组织性肺炎模型。Ramy Karam[20]等研究证实胸部HRCT具有优异的准确性,用于描述间质性肺病的特异性放射学异常,胸部高分辨率CT(HRCT)可显示多达90%的系统性硬化症患者间质性肺病,该研究患者中40%~75%的肺功能检查结果异常。在肺部CT/HRCT下,肺及胸膜改变主要包括不规则线状影或胸膜下线、网格影、实变影、薄壁囊肿、结节灶、支气管血管束增厚、肺大泡、蜂窝肺、毛玻璃样变、小叶间隔增厚、肺动脉增粗、心影增大等。当出现PH时,可出现肺动脉干增粗、心影增大等表现。本研究中,CTD-ILD-PH组的肺部CT/HRCT中网格影、实变影、肺动脉增粗、心影增大的发生率较CTD-ILD组高。因此,当CTD-ILD患者肺部CT/HRCT有上述影像学表现,尤其出现肺动脉干增粗、心影增大的表现时,完善心脏超声、肺功能并随访显得尤为重要。
4 结论
CTD-ILD患者出现气短、呼吸困难、雷诺现象、皮肤硬化、ANA抗体阳性,需完善肺部CT/HRCT、心脏彩超等检查;肺部CT/HRCT提示网格影、实变影、肺动脉增粗、心影增大和或心脏彩超提示右室内径、右室流出道内径、肺动脉内径增大,需考虑继发PH,及时监测肺动脉压力,给予临床干预治疗;CTD-ILD患者肺功能提示FVC%pred、D1CO%pred显著下降,需警惕PH的发生。
【参考文献】
[1]Ahned S,Palevsky HI.Pulmonary arterial hypertension related to co- nnectivetissue disease[J].Rheum Dis Clin North Am,2014,40(1):103- 124.
[2]张晓,林莉,崔广恒.几种弥漫性结缔组织病肺间质病变的影像分析[J].中华 风湿病学杂志,2007,11(11):669.
[3]陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:88-97.
[4]温海艳,姜莉.结缔组织病相关间质性肺疾病继发肺动脉高压的临床分析[J]. 国际呼吸杂志,2015,85(16):1213-1218.
[5]Vi jR,Noth I,Strek ME.Autoimmune featured interstital lung disease:a distinct entity[J].Chest,2011,140(5):1292-1299.
[6]Alhamad EH.Interstitial lung diseases in Saudi Arabia:A single center study[J].Ann Thorac Med,2013,8(1):33-37.
[7]唐开奖,宋星慧,蒋茵,等.风湿性疾病相关性间质性肺病患者的临床特点分析[J].实用心脑肺血管病杂志,2016,24(2):109-111.
[8]Can Huang,Mengtao Li, MD, Yongtai Liu,etal.Baseline Characteristics and Risk Factors of Pulmonary Arterial Hypertension in Systemic Lupus Erythematosus Patients[J],Medicine,2016,95,(10):1-7.
[9]李杰,刘双,杨京华,等.结缔组织病相关肺动脉高压59例临床分析[J].心肺血管病杂志,2013,32(2):179-182.
[10] Stephen C Mathai, Sonye K Danoff.Management of interstitial lung disease associated with connective tissue disease [J].BMJ,2016,68:1-14.
[11] Fischer A,Antoniou KM,Brown KK,etal.An official European Respira tory Society/American Thoracic Society research statement:intersti tial pneumonia with autoimmune features[J].Eur Respir J,2015,46: 976-87.
[12] 文斌.超声心动图诊断肺动脉高压157例分析[J].临床肺科杂志,2013,18 (7):1248-1250.
[13] Srinivas Rajagopala, Molly Mary Thabah.Pulmonary HypertensionAssociated with Connective Tissue Disease[J].InRdian Journal of Rheumatology,2017,12(1):38-47.
[14] Chaisson NF, Hassoun PM.Systemic Sclerosis associated pulmonary hypertension[J].Chest,2013,144:1364-1356.
[15] Hsu VM,Chung L,Hummers LK,etal.Development of pulmonary hyperten sion in a high risk population with systemic sclerosis in the pul Monary Hypertensiom Assessment and Recognition of out comes in Scleroderma(PHAROS)cohor study[J].Semin Arthritis Rheum,2014,44 (1):55-62.
[16] 张静,梁宗安,杨阳,等.结缔组织病相关性间质性肺病90例临床分析[J].西部医学,2016,28(4):947-952.
[17] Arqiriadi PA,Mendelson DS.High resolution computed tomography in idiopthic interstitial pneumonias[J].Mt Sinai J Med,2009,76(1):37-39.
[18] Vivero M, Padera RF. Histopathology of lung disease in the connective tissue diseases[J].Rheum Dis Clin North Am, 2015,41(2):197-211.
[19] Ruano CA,Lucas RN,Leal CI,etal.Thoracic manifestations of connec tive tissue diseases[J]. Curr Probl Diagn Radiol, 2015,44(1):47-59.
[20] Ramy Karam, Francesca Proulx, Som Mai Le,etal.Imaging of Systemic Sclerosis (Scleroderma)[J].Comemporary Diagnostic Radiolgy,2016,39(7):1-7.
