丹皮酚在肝癌前病变大鼠体内的药动学研究*
2018-07-06宋艺君杨史军张东星李京涛蔡大勇王玥琦
宋艺君 杨史军 王 湘 张东星 李京涛 蔡大勇 王玥琦Δ
1.陕西中医药大学 (陕西 咸阳, 712046) 2.北京中医药大学 3.中国医学科学院药用植物研究所
丹皮酚(Pae),是从中药徐长卿(萝藦科植物徐长卿的干燥根及根茎)和牡丹皮(毛茛科植物牡丹的干燥根皮)中分离得到的生物活性物质。其药理活性广泛,具有抗心肌缺血、抗心律失常、抗动脉粥样硬化、抗高血压、抗血栓、抗肿瘤、增强免疫力、抗炎等作用[1]。从中药牡丹皮得到的丹皮酚已经被作为一种重要成分来预防肝癌[2]。丹皮酚对肝癌的防护作用,有关专家分别从体外和体内进行了大量研究,关于其作用机制,也分别从杀伤肿瘤细胞、诱导凋亡,影响肿瘤血管生成等方面进行了探索[3~5]。
肝癌前病变是指在慢性肝病中出现的肝细胞不典型增生、腺瘤样增生、肝细胞小管状化生等, 其发展为肝癌的几率高, 尤其是肝硬化病灶中出现的异型增生病灶和异型增生的细胞[6]。近年来,虽然肝癌的治疗取得了一定进展,但临床疗效仍未得到明显提高[7,8]。肝癌前病变是肝细胞癌变进展中启动、促进和演变过程的中间阶段,它是阻断癌变的理想靶点。因而阻止或延缓肝癌前病变的发生发展,对于预防肝脏癌症的发生,具有重要的现实意义。
雌激素硫酸转移酶(EST)是一种胞质酶,近年来,有学者研究发现EST在肝癌细胞存在阳性表达,比如其在HepG2肝癌细胞的表达[9]等。
本文在前期实验研究的基础上[10],建立肝癌前病变大鼠模型,研究丹皮酚在肝癌前病变大鼠病程发展不同阶段的药动学结果的差异,并通过SULTIEI在大鼠肝、肾的表达研究,从药动学方面论证丹皮酚的药效优势,为其临床用药提供指导。
1 材料与方法
1.1 仪器 Acquity超高效液相色谱仪、PDA 检测器(美国Waters公司);AL104-IC电子分析天平(上海梅特勒-托利多仪器有限公司);Olympus Bx53显微镜(日本奥林巴斯公司)。
1.2 药品与试剂 丹皮酚原料药(批号101021,广西亿康药业股份有限公司);丹皮酚对照品(批号0708-9704,中国药品生物制品检定所);甲醇、乙腈(色谱级,美国Fisher Scientific公司);二乙基亚硝胺(DEN)(批号1000928405,Sigma公司);兔抗大鼠EST多克隆抗体(编码107232,上海田源生物技术有限公司);即用型SABC免疫组化染色试剂盒(编号SA1022-兔IgG,含生物素化二抗、封闭液及SABC)。
1.3 动物 清洁级Wistar大鼠,雄性,体重(220±20) g,购于北京维通利华实验动物技术有限公司, 许可证号SCXK(京)2008-0013。
1.4 分组与造模 将72只清洁级大鼠随机分为高、中、低剂量组,每组又分为d000、d028、d056、d1124小组,每组6只;适应性饲养1周后,模型组大鼠以DEN(0.5 mL/100g)腹腔注射,每周50 mg/kg,连续16周,对照组大鼠给予等体积生理盐水(d000:给 DEN 0天;d028:给DEN 4周;d056:给DEN 8周;d112:给DEN 16周)。
1.5 给药与取样 大鼠于造模16周时,禁食不禁水12 h后,分别灌胃给予高、中、低剂量(259.2、194.4、129.6 mg/kg)丹皮酚。在大鼠清醒状态下,分别于给药后0.5、3、5、7、10、20、30、45、60、90、120、180、240、360 min球后静脉丛取血0.2 mL于含有肝素的EP管中,离心,取血浆;解剖取出肝脏和肾脏,处理后和血浆同置-80 ℃冰箱保存待测。
1.6 药动学研究 ①色谱条件:Waters高效液相色谱仪,色谱柱为Waters Acquity C18 (100 mm×2.1 mm,1.7μm);流动相:甲醇-水(70∶30);流速:0.3 ml/min;检测波长:274 nm;柱温:25 ℃。 ②对照品溶液制备:取丹皮酚对照品2.07 mg,精密称定,用流动相溶解制成0.207 mg/mL的丹皮酚储备液,4 ℃冰箱保存备用。③血浆样品处理:精密吸取25 μl血浆,置EP管内,先加入稀盐酸2 μl,涡旋10 s,再加入3倍量体积乙酸乙酯萃取,涡旋30 s,12000 r/min离心8 min,取上清液置于另一个EP管,同法再萃取1次,合并2次上清液自然挥发干燥,残渣用流动相70 μl溶解,涡旋30 s,离心8 min,取上清液55 μl置EP管,-4 ℃冰箱放置30 min,离心8 min,再取上清液40 μl置进样瓶中,UPLC自动进样。④药代动力学分析:样品直接注入色谱仪中,按照①色谱条件进行检测,采用标准曲线法计算血药浓度。对血药浓度数据用WinNonlin软件进行房室模型判别,计算最大血药浓度(Cmax)、达峰时间(Tmax)、总体清除率(CL)、药时曲线下面积(AUC)、表观分布容积(V)、平均滞留时间(MRT)等药动学参数。
1.7 测定大鼠肝、肾组织EST含量 采用免疫组化法(SABC)测定肝、肾中EST含量,严格按照试剂盒说明书操作。结果判定:每张切片各随机选取5张40倍视野的图片,采用Image Pro Plus 7.0.1软件,计算阳性面积AP,总面积AT, 总光密度IOD,用[IOD×(AP/AT)3/2/N]公式计算EST水平,取5张照片的均值代表该切片染色情况。
2 结果
2.1 方法学验证 ①标准曲线制备:在空白血浆中加入适量对照品溶液,分别制成浓度为41.4、20.7、10.35、5.18、2.59、1.29、0.65、0.323 mg/L的含丹皮酚血浆样品,血浆样品处理方法处理,进样分析。以丹皮酚峰面积Y对丹皮酚质量浓度X(mg/L)进行线性回归,回归方程Y=17955X+16.721,R2=0.9997。丹皮酚在0.323~41.4 mg/L范围内线性关系良好。②精密度试验:按照标准曲线项下操作,分别制备浓度为20.7、5.18、1.29 mg/L的含丹皮酚血浆样品,按血浆样品处理方法进行操作,进样分析。于日内平行处理5份样品,考察日内精密度;每天各测定5份样品,连续5天,考察日间精密度。丹皮酚低、中、高浓度日内精密度RSD分别为1.56%、2.38%、2.25%;日间精密度RSD分别为6.45%、1.95%、2.57%。精密度RSD均小于6.45%,符合试验要求。③稳定性试验:按照标准曲线项下操作,分别制备丹皮酚浓度为20.7、5.18、1.29 mg/L的标准空白血浆样本各5份,按血浆样品处理方法处理,室温保存,于0、2、4、8、10 h分别进样分析,记录丹皮酚峰面积,计算丹皮酚浓度。丹皮酚低、中、高浓度的RSD分别为4.80%、2.18%、3.19%。表明丹皮酚的含药血浆经过处理后室温放置10 h,仍可被准确测定。④绝对回收率试验:取25 μl的空白血浆3份,分别加入3个浓度的丹皮酚对照品溶液10 μl,配置成含丹皮酚20.7、5.18、1.29 mg/L的含药血浆样品。按血浆样品处理方法处理,进样分析记录色谱峰面积。每个浓度平行操作5份。以血浆中丹皮酚测得量与加入量之比计算绝对回收率。丹皮酚低、中、高浓度的绝对回收率分别为(89.9±2.3)%、(90.7±6.1)%、(92.1±1.8)%,丹皮酚在血浆中回收率稳定,平均回收率均达89%以上,符合试验要求。⑤相对回收率试验:取25 μl的空白血浆3份,分别加入3个浓度的丹皮酚对照品溶液10 μl,配置成含丹皮酚20.7、5.18、1.29 mg/L的含药血浆样品,按血浆样品处理方法处理,得到丹皮酚色谱峰面积A1;用水代替空白血浆,按照上述方法操作,进样测定,得到丹皮酚色谱峰面积A2。每个浓度平行操作5份,以A1/A2×100%计算相对回收率。低、中、高浓度的相对回收率分别为(90.4±8.1)%、(93.3±2.8)%、(94.2±5.6)%,丹皮酚在血浆中相对回收率稳定,平均回收率均达89%以上,符合试验要求。
2.2 药动学结果 丹皮酚高、中、低剂量(259.2、194.4、129.6 mg/kg)大鼠灌胃给药后各个时间点的平均血药浓度-时间曲线(AUC)见图1。丹皮酚在大鼠体内的血药浓度-时间过程符合非房室模型,药动学参数见图1及表1。
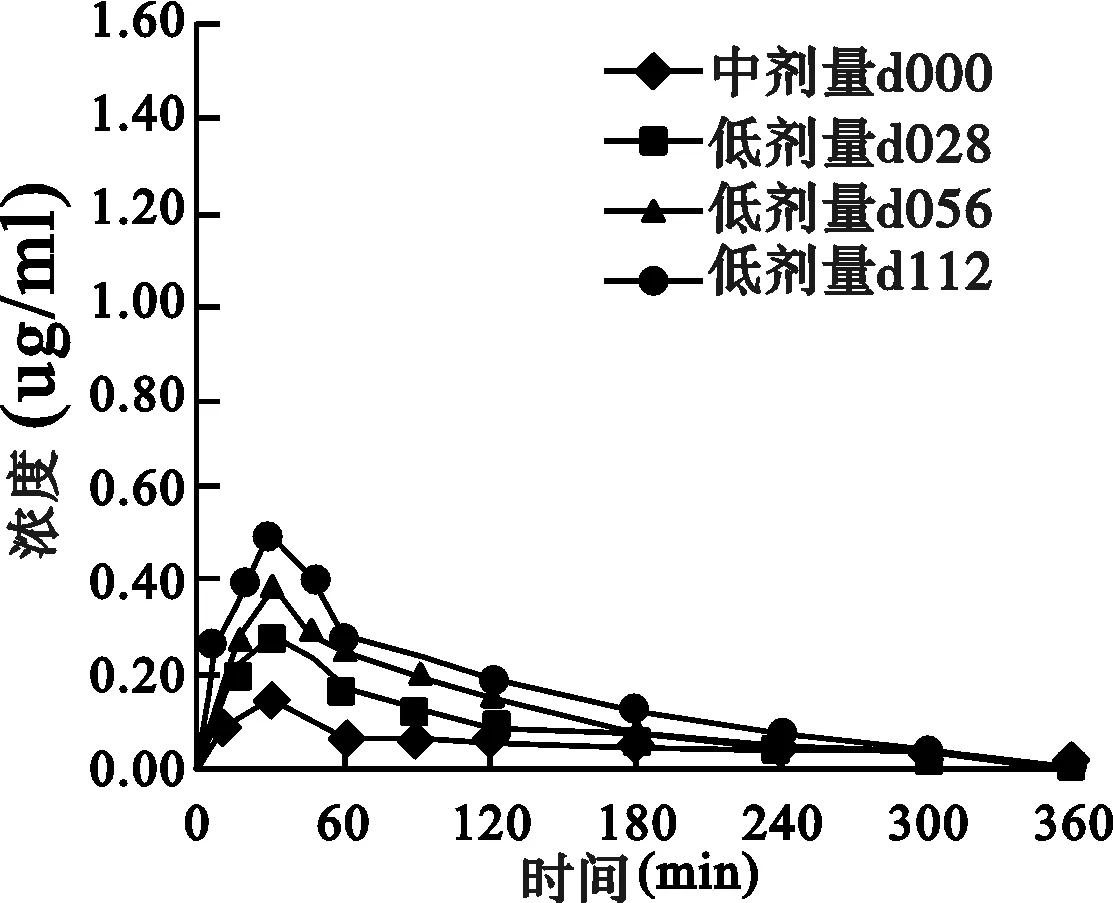
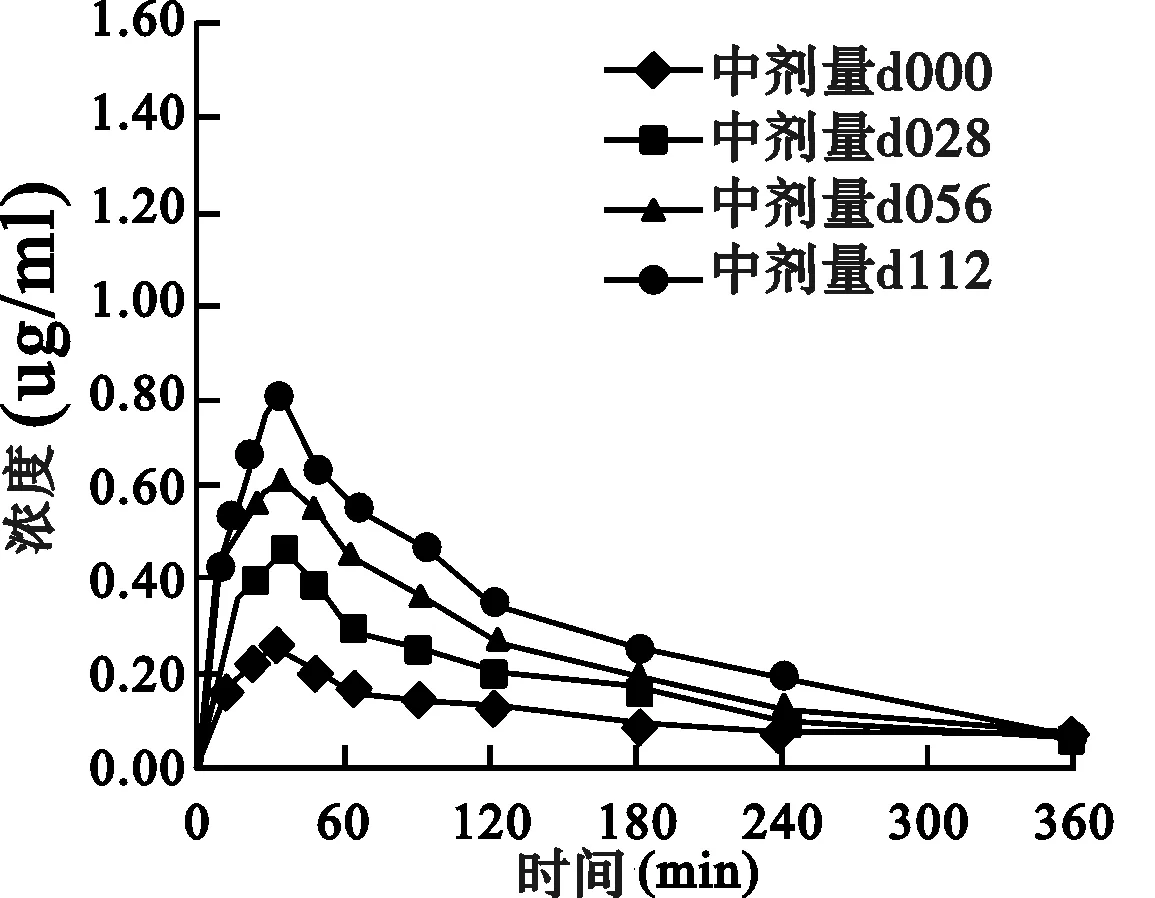
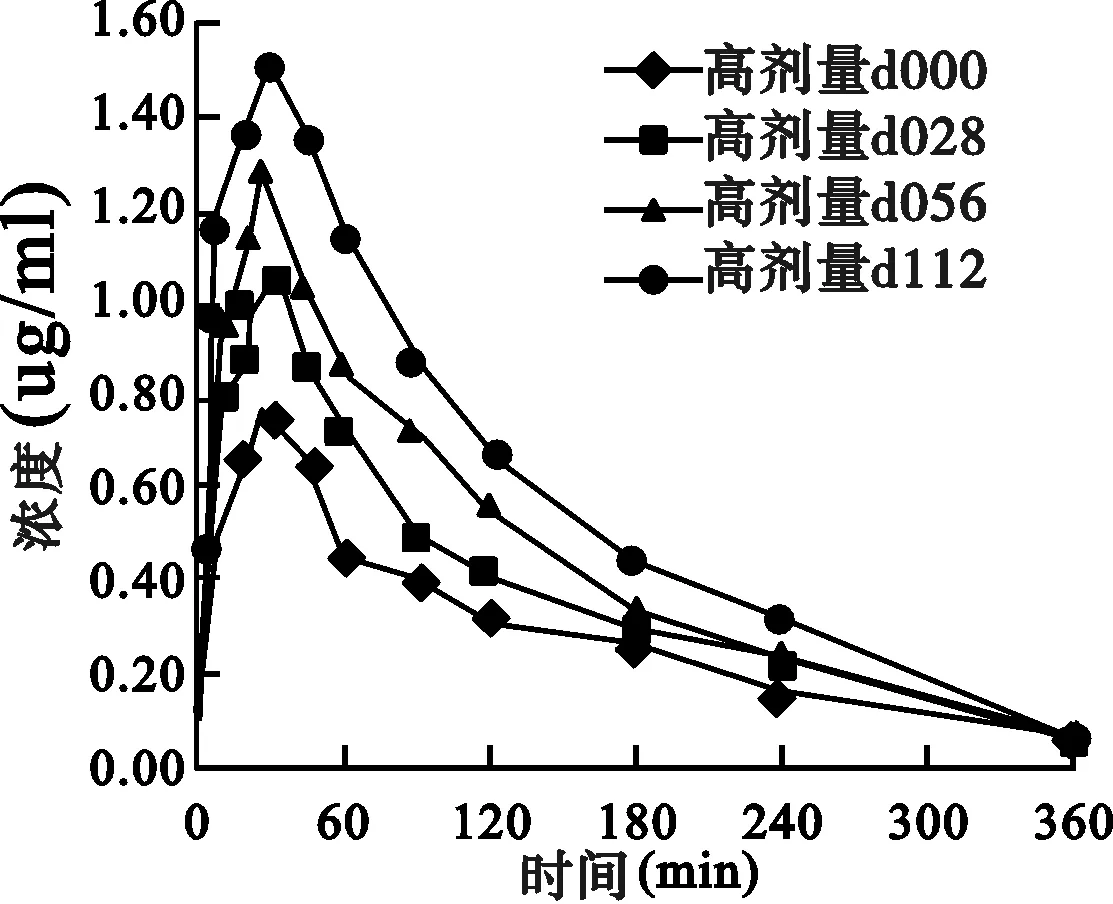
图1 大鼠灌胃不同剂量丹皮酚的平均血药浓度-时间曲线图
低剂量组:由d000-d028-d056-d112,AUC、Cmax依次增加,CL、V、MRT依次降低。
中剂量组:由d000-d028-d056-d112,AUC、Cmax依次增加,V、MRT依次降低;由d000-d028-d056,CL降低;由d056-d112,CL增加。
高剂量组:由d000-d028-d056-d112,AUC、Cmax依次增加,CL、V、MRT依次降低。
2.3 各组大鼠肝组织EST蛋白表达 EST蛋白阳性反应定位在肝细胞和内皮细胞胞浆内,呈黄色或棕黄色,见插页图2。各组大鼠肝组织均可见EST阳性表达,EST在肝细胞中的表达由d000-d028-d056-d112依次降低,在内皮细胞中的表达由d000-d028-d056-d112依次升高。肝脏EST蛋白相对表达量见表2。

表2 各组大鼠肝组织EST蛋白相对表达量比较
与d000组比较,△P<0.05,▲P<0.01;与d028比较,□P<0.05,■P<0.01;与d056比较,○P<0.05,●P<0.01
2.4 各组大鼠肾组织EST蛋白表达 EST蛋白阳性反应定位在肾组织集合管和远曲小管的上皮细胞胞浆内,近端小管上皮细胞也有少许,呈黄色或棕黄色,见插页图3。各组肾组织均可见EST阳性表达,EST在肾脏集合管和远曲小管中的表达由d000-d028-d056-d112依次升高。肾脏EST蛋白相对表达量见表3。

表3 各组大鼠肾组织EST蛋白相对表达量比较
与d000比较,△P<0.05,▲P<0.01;与d028比较,□P<0.05,■P<0.01;与d056比较,●P<0.01
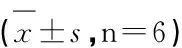
表1 丹皮酚灌胃给药后的药代动力学参数
3 讨论
药动学参数是反映药物在体内动态变化规律的参数,可为临床制定给药剂量和给药间隔提供参考,为毒性试验设计和毒理效应分析提供依据,而机体在病理状态下的药动学参数研究较正常状态下更有意义。丹皮酚的药动学结果分析表明,高、中、低剂量之间,剂量与CL、AUC、Cmax、V、MRT有一定的线性关系,说明CL、AUC、Cmax,V、MRT呈剂量依赖性。丹皮酚各剂量组,由d000-d028-d056-d112过程中,Cmax逐渐增大,显示对丹皮酚的吸收速度依次增加;CL逐渐减小,显示对丹皮酚的消除速度依次减小;AUC逐渐增大,显示对丹皮酚的吸收量依次增加;MRT逐渐减小,显示丹皮酚在体内停留时间依次缩短;V逐渐减小,显示丹皮酚按照血浆浓度分布时,所需要体液的理论容积逐渐减小。
肝癌是一种无有效预防措施的致命的恶性肿瘤疾病[11,12]。按照肝癌的炎症发病机理[13~15],在用来预防肝癌的中药中[16~20],丹皮酚被认为是非常有效的[17]。肝癌前病变是肝癌发生的前期阶段,笔者故以大鼠肝癌前病变模型去评价治疗肝癌的候选药物是合理的。由表1可以看出,造模到4周,其药动学参数和对照组比较变化不大,可能因为此时肝脏还只是发生了肝损伤,没有器质性病变,对丹皮酚在体内的药动学影响不大,这和病理结果一致,即第4周大鼠只是变质性炎症,出现肝水肿,脂肪变性,点状坏死等;造模到8周,肝脏发生了不可逆病变,部分假小叶开始形成,汇管区淋巴细胞浸润突出等,属于纤维化和硬化阶段,对丹皮酚药动学参数有大的影响;造模到16周,丹皮酚药动学参数的变化趋势更大,此时属于肝癌前病变阶段(有关病理结果另文发表)。通过实验,总结出了丹皮酚预防肝癌的两条新颖的途径。一是丹皮酚药动学:在不断恶化的肝癌前病变大鼠的血浆和组织中,因为排泄减慢和吸收加快,丹皮酚浓度是升高的,尤其是肝肾组织,这样是为了保持丹皮酚在病变部位更长的治疗时间(组织分布研究另文发表);二是雌激素硫酸转移酶(EST):从肝癌前病变大鼠的免疫组化结果可知,肝脏内皮细胞和肾上皮细胞的EST增加,肝细胞的EST减少。由肝癌前病变大鼠EST细胞定位的变化,我们可以看出丹皮酚预防肝癌的优势。
(致谢: 感谢中国医学科学院药用植物研究所为本实验开展提供相关仪器设备,感谢赵欣、祖承哲两位同学在实验中给予的帮助)
[1] 郭齐,李贻奎,王志国,等.丹皮酚药理研究进展[J].中医药信息, 2009,26(1),20-22.
[2] 孙国平. 抗肿瘤新药丹皮酚[P].2012.
[3] 陈岳涛,曹蔚,王四旺,等.丹皮酚抗肿瘤作用及其机制研究[J].现代生物医学进展,2016,12(21):4163-4165.
[4] 孙爱华,陈劲,关恒明,等.丹皮酚对肝癌HepG2 /ADM 细胞株多药耐药性的逆转作用及其机制[J].山东医药,2016,56(1):1-4.
[5] 宋艺君,杨史军,王湘,等.丹皮酚对二乙基亚硝胺诱发大鼠肝癌前病变的预防作用[J].陕西中医,2015,36(9):1270.
[6] 谢晶日,任公平,李明,等.中医药防治肝癌前病变机制研究概况[J].中国医药导报,2008,5(8),25-26.
[7] Mohamed El-Shahat, Sabah El-Abd, Mohamed Alkafafy,etal.Potential chemoprevention of diethylnitrosamine-induced hepatocarcinogenesis in rats: Myrrh (Commiphora molmol) vs. turmeric (Curcuma longa)[J]. Acta Histochemica,2012,114:421-428.
[8] Dimitrios Stagos, Gregorios D. Amoutzias, Antonios Matakos,etal. Chemoprevention of liver cancer by plant polyphenols[J]. Food and Chemical Toxicology, 2012, 50:2155-2170.
[9] Dongning He,Teresa W.Wilborn, Josie L.Falany,etal. Repression of CFTR activity in human MMNK-1 cholangiocytes induces sulfotransferase 1E1 expression in co-cultured HepG2 hepatocytes[J]. Biochimica et Biophysica Acta,2008,(1783) : 2391-97.
[10] 宋艺君,刘晓婷,冯丽莉,等.二乙基亚硝胺诱发肝癌前病变大鼠模型的建立[J].世界华人消化杂志,2012,20(27):2562-2569.
[11] Song TJ, Fong Y, Cho SJ,etal. Comparison of hepatocellular carcinoma in American and Asian patients by tissue array analysis[J]. J Surg Oncol, 2012,106: 84-88.
[12] Shimizu M, Sakai H, Moriwaki H. Chemoprevention of hepatocellular carcinoma by acyclic retinoid[J]. Front Biosci,2011,1:759-769.
[13] Tarao K, Ohkawa S, Miyagi Y,etal. Inflammation in background cirrhosis evokes malignant progression in HCC development from HCV-associated liver cirrhosis[J]. Scand J Gastroenterol, 2013, 48: 729-735.
[14] Potikha T, Stoyanov E, Pappo O,etal. Interstrain differences in chronic hepatitis and tumor.development in a murine model of inflammation-mediated hepatocarcinogenesis[J]. Hepatology, 2013, 58:192-204.
[15] Nikolaou K, Sarris M, Talianidis I. Molecular pathways: the complex roles of inflammation pathways in the development and treatment of liver cancer[J]. Clin Cancer Res, 2013,19: 2810-2816.
[16] Xing G, Zhang Z, Liu J,etal. Antitumor effect of extracts from moutan cortex on DLD-1 human colon cancer cells in vitro[J]. Mol Med Rep, 2010,3: 57-61.
[17] Xiao Y, Zhang YH, Sheng YX,etal. LC-MS determination and pharmacokinetic studies of paeonol in rat plasma after administration of different compatibility of Su-Xiao-Xin-Tong prescriptions[J]. Biomed Chromatogr, 2008, 22: 527-756.
[18] Ying Xie , Hua Zhou, Yuen-Fan Wong,etal. Study on the pharmacokinetics and metabolism of paeonol in rats treated with pure paeonol and an herbal preparation containing paeonol by using HPLC-DAD-MS method[J]. J Pharm Biomed Anal,2008, 46: 748-534.
[19] Lu Chen, Dawei Wang, Jie Wu,etal. Identification of multiple constituents in the traditional Chinese medicine formula GuiZhiFuLing-Wan by HPLC-DAD-MS/MS[J]. J Pharm Biomed Anal, 2009, 49: 267-275.
[20] Ji Ye, Xi Zhang, Weixing Dai,etal. Chemical fingerprinting of Liuwei Dihuang Pill and simultaneous determination of its major bioactive constituents by HPLC coupled with multiple detections of DAD, ELSD and ESI-MS[J]. J Pharm Biomed Anal, 2009, 49: 638-645.
