灵猫方通过增强天然免疫功能抑制乙型肝炎病毒复制的研究*
2018-07-06朱晓骏周振华金树根高雅婷孙学华杨婉凤高月求
朱晓骏 张 鑫 周振华 金树根 高雅婷 孙学华 杨婉凤 高月求△
1.上海中医药大学附属曙光医院肝病科 (上海, 201203) 2.上海中医药大学附属曙光医院细胞免疫实验室
据世界卫生组织报道,全球约有2.4 亿慢性HBV 感染者[1],每年约有65 万人死于HBV 感染所致的肝功能衰竭、肝硬化和肝细胞癌( HCC)[2],我国有慢性HBV 感染者约9300 万人,其中慢性乙型肝炎(CHB) 患者约2000 万例[3],CHB治疗的关键是抗病毒,核苷(酸)类似物在临床上广泛应用,但血清转换率低、停药问题困扰着临床医生,中医药在我国乙型肝炎防治中发挥着重要作用。前期临床研究发现灵猫方与恩替卡韦联合治疗CHB具有协同作用[4],因此我们进一步研究了灵猫方治疗CHB的免疫学机制,现报告如下。
1 材料与方法
1.1 细胞 HepG2中科院上海细胞库购买。
1.2 质粒 pHBV1.3-pCR2.1质粒,华中科技大学同济医院附属协和医院病毒研究室惠赠[5]。
1.3 药物与试剂 灵猫方(醋青皮,胡黄连各9 g,猫爪草、黄芪、仙灵脾、女贞子各15 g),由上海中医药大学中药学院制剂工程中心加工提取水提物。方法如下:中药材加入10倍的80%乙醇回流提取两次,每次1.5 h。药液通过80目过滤,减压浓缩至2L,-20 ℃冷冻干燥,-70 ℃冷藏备用。
DMEM培养液、胎牛血清、胰蛋白酶(美国Gibco公司);AMV First Strand cDNA Synthesis Kit(美国);SG Fast qPCR Master Mix(High Rox) (2X) [生工生物工程(上海)股份有限公司,中国];HBsAg和HBeAg ELISA试剂盒(雅培,美国);Lipofectamine®3000(ThermoFisher,美国)。
1.4 仪器 二氧化碳培养箱(HF151),Heal Force公司;洁净工作台(SA-1480-2),上海净化设备厂;雅培i2000化学发光免疫分析仪,美国;ABI 7500型荧光定量PCR仪,美国。
1.5 pHBV1.3-pCR2.1质粒转染HepG2 依据Lipfectamine 3000 Reagent 转染试剂说明书进行转染。
1.6 细胞培养、分组和干预 HepG2细胞接种于6孔板,每孔5×105个细胞,加入1 ml含10% 胎牛血清的DMEM培养液;在37 ℃、5%CO2和100%湿度的条件下培养24 h。共分为3个组:灵猫方低剂量组(0.25mg/ml)、灵猫方高剂量组(0.5mg/ml)和空白对照组(0.9%NaCl)。分别向空白对照组、低剂量组、高剂量组加入0.9%NaCl溶液、0.25mg/ml和0.5mg/ml灵猫方水提物干预HepG2细胞,培养24h,然后pHBV1.3-pCR2.1质粒转染48h,收集细胞和上清液。
1.7 观察指标及检测方法
1.7.1 HBsAg、HBeAg水平 采用ELISA法检测HBsAg和HBeAg水平,方法按照试剂盒说明书进行。
1.7.2 RNA提取和 IFN-α、IFN-β、IFN-λ1、OAS1、MxA、RIG-ImRNA定量 按照Trizol说明书提取总RNA,取1 μl总RNA逆转录为cDNA,取2 μl的cDNA进行PCR反应。PCR扩增:第1步3 min,95 ℃,第2步95 ℃、7 s变性,57 ℃、10s退火,72 ℃、15 s延伸,40个循环,根据2-△△Ct法,以 β-actin作为内参照,检测IFN-α、IFN-λ1、OAS1、MxA、PRK、RIG-ImRNA的表达量。引物详见表1。

表1 RT-PCR引物(10.5 PCR 3.20PCR)
2 结果
2.1 3组转染HepG2细胞分泌HBsAg、HBeAg情况 见图1。与空白对照组比较,高、低剂量灵猫方组的HBsAg和HBeAg水平明显下降;与低剂量灵猫方组比较,高剂量灵猫方组的HBsAg、HBeAg水平更低,这提示高、低剂量的灵猫方可抑制转染HepG2细胞分泌HBsAg、HBeAg,且高剂量灵猫方作用更强。
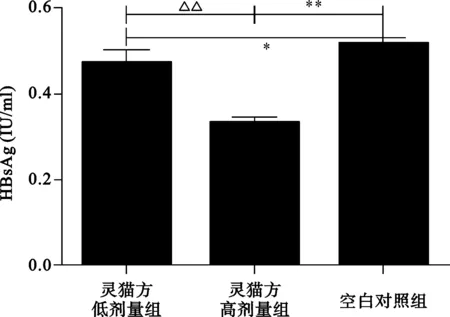

与空白对照组比较,*P<0.05,**P<0.01;与低剂量灵猫方组比较,△P<0.05
图1 3组转染HepG2细胞分泌HBsAg、HBeAg水平
2.2 2组转染HepG2细胞分泌IFN-αmRNA、IFN-βmRNA、IFN-λ1情况 见图2。
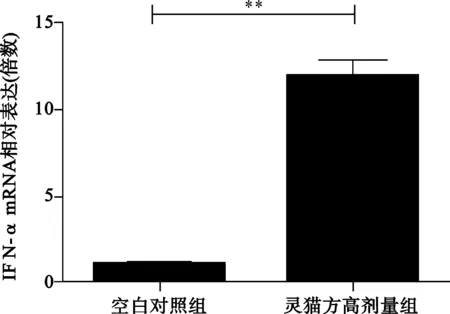
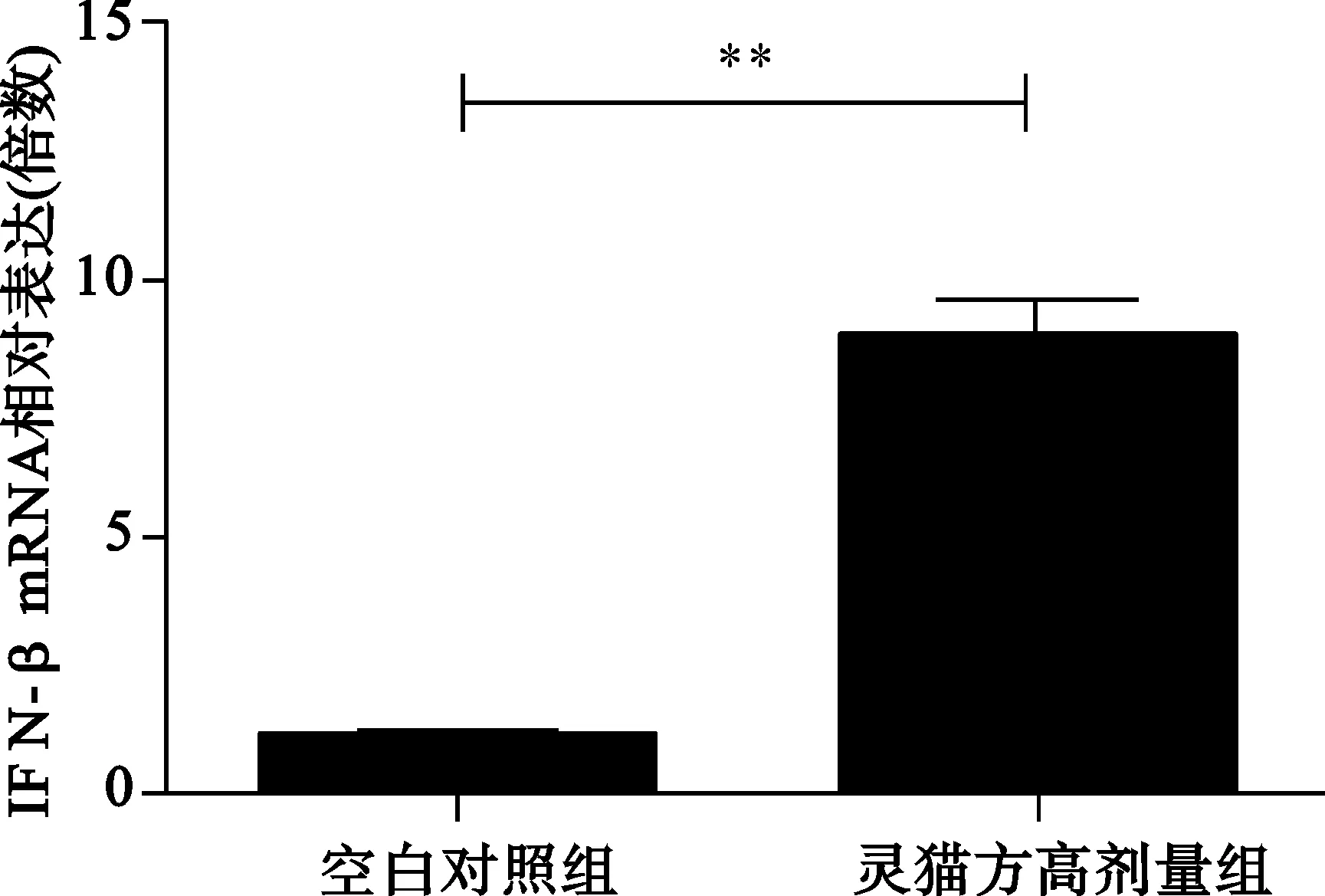
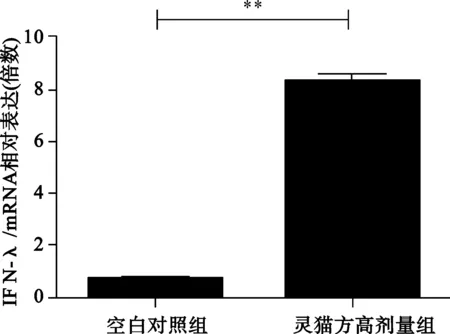
与空白对照组比较,**P<0.01;
图2 2组转染HepG2细胞分泌IFN-αmRNA、IFN-βmRNA、IFN-λ1mRNA水平
2.3 2组转染HepG2细胞分泌OAS1、MxA、PRKmRNA情况 见图3。
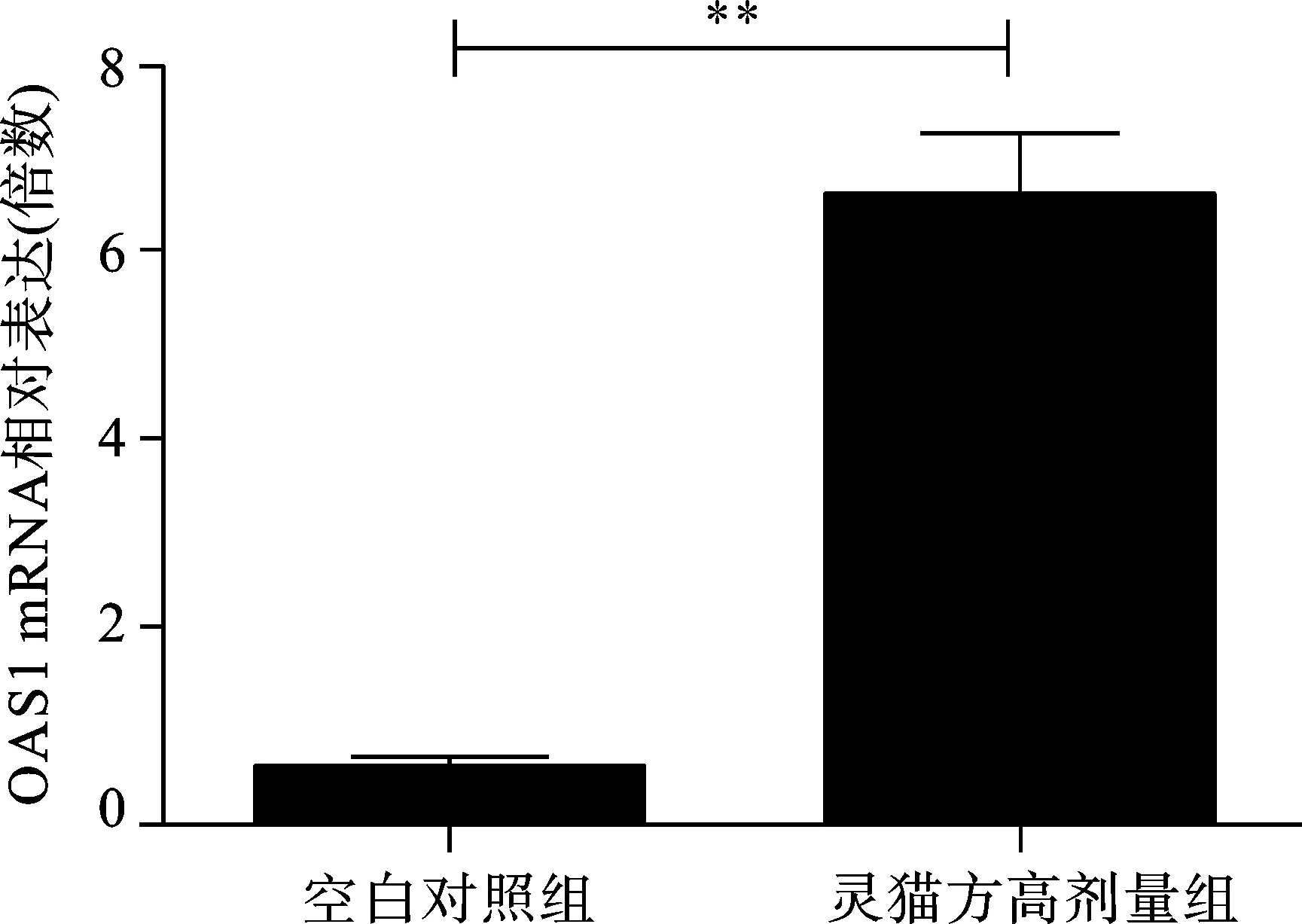
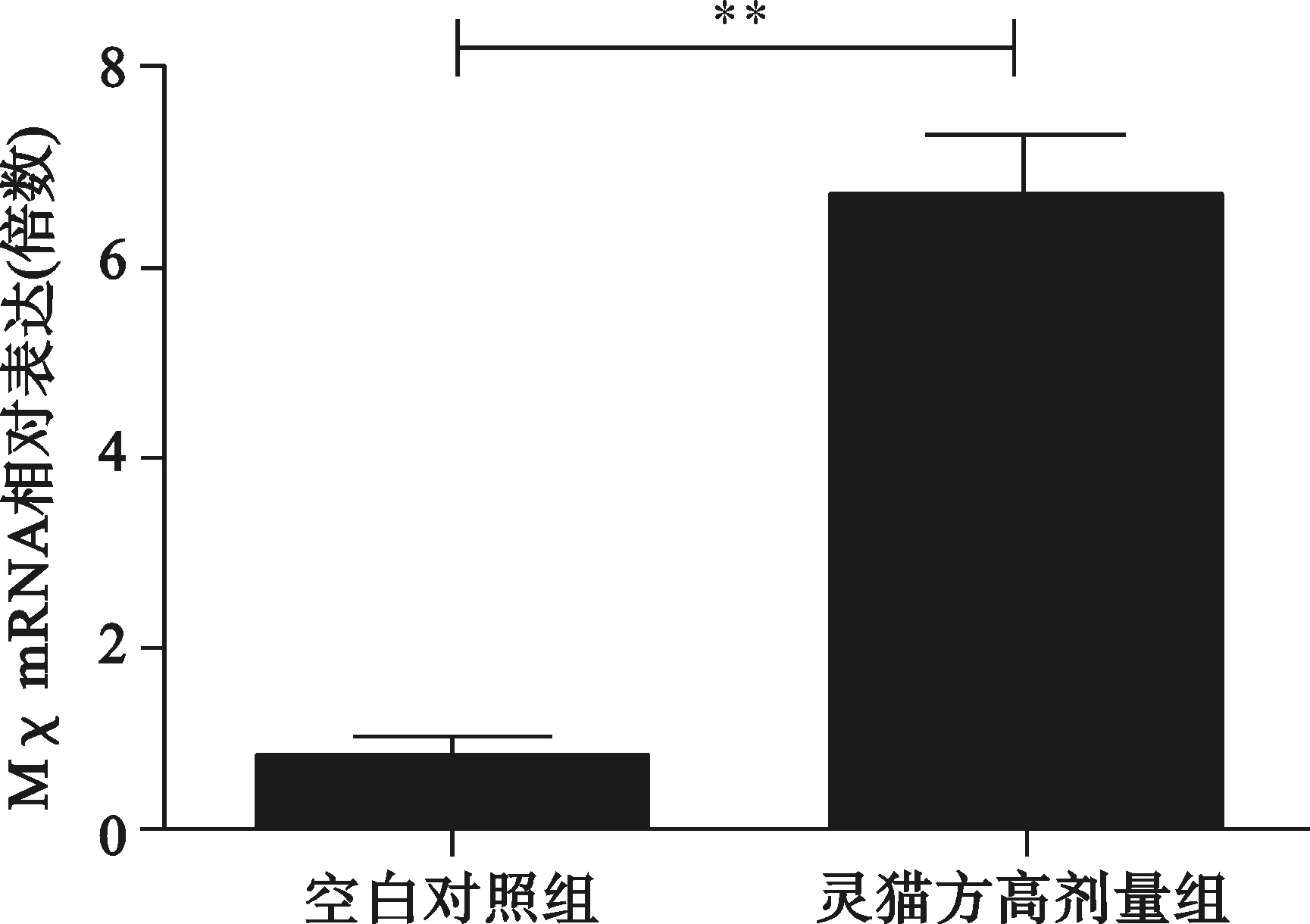
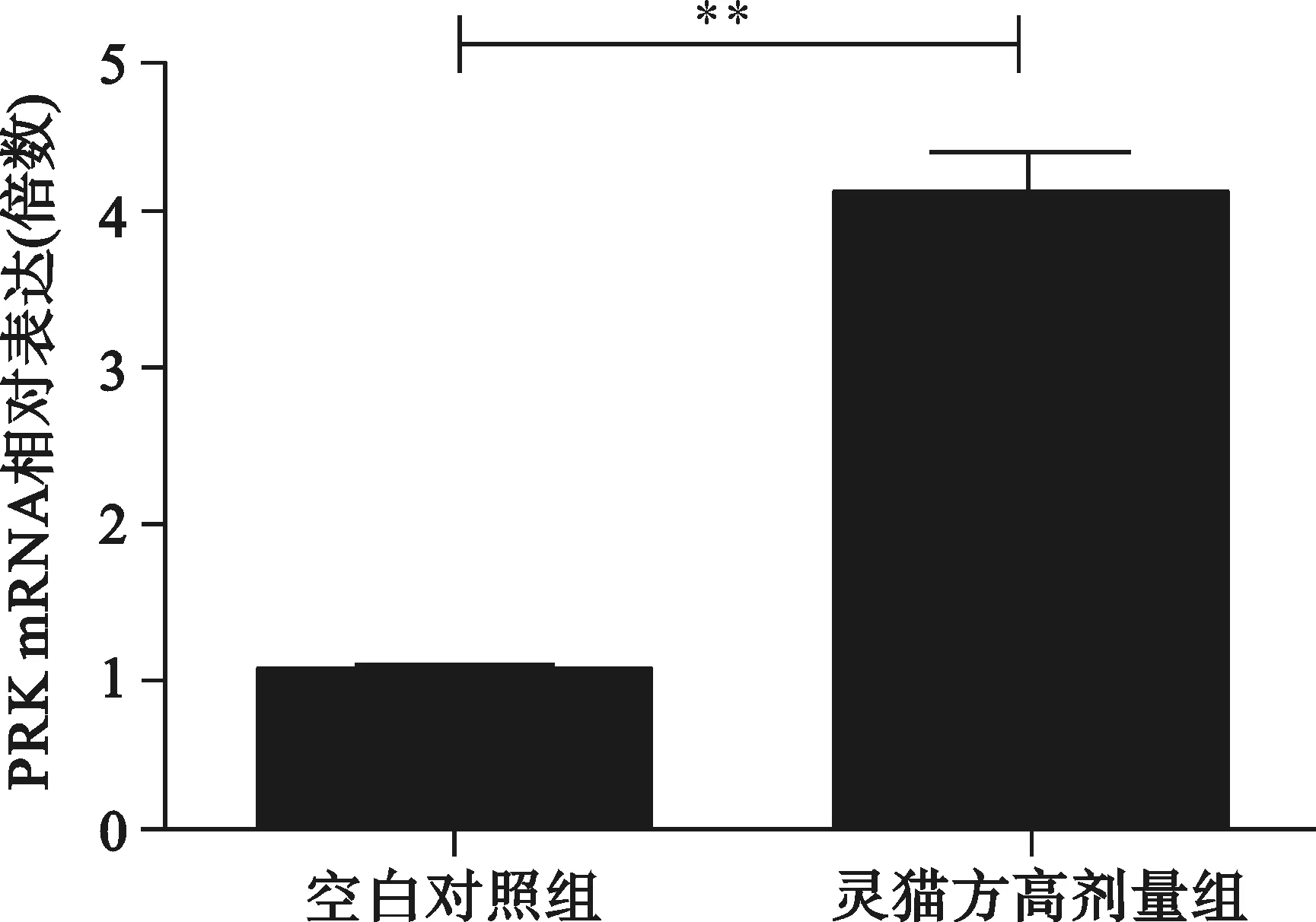
与空白对照组比较,**P<0.01
图3 2组转染HepG2细胞OAS1、MxA、PRKmRNA相对表达量
2.4 2组转染HepG2细胞分泌RIG-ImRNA情况 见图4。
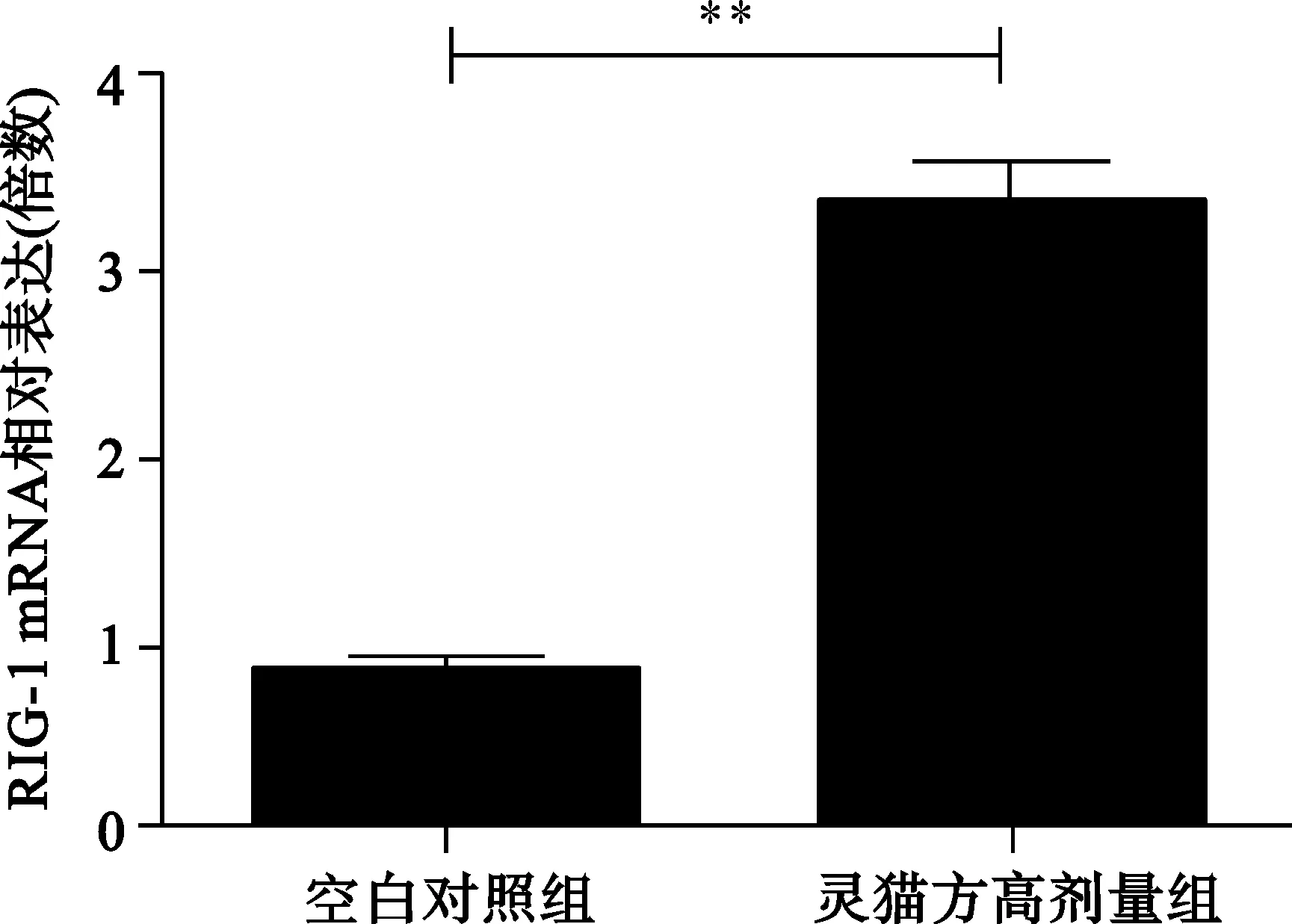
与空白对照组比较,**P<0.01
图4 2组转染HepG2细胞RIG-ImRNA图相对表达量
3 讨论
清热解毒利湿健脾法可以起到改善肝功能、明显减轻或消除临床症状的良好效果,但无法使HBV得到抑制,在临床治疗中,在清热化湿健脾基础之上应用补肾法往往能提高疗效。王灵台教授提出“补肾法”治疗CHB[6],灵猫方就是在此基础之上创立。中医学认为人体免疫功能低下系属机体正气不足,而人体之正气源于脾肾,充实肾精肾气,健运脾胃可能是提高机体免疫功能,清除或抑制HBV,促使病情改善和恢复的有效途径[6]。 天然免疫应答在机体抗病毒免疫中发挥着重要作用。入侵病毒的病原体相关分子模式(PAMP)会被机体的模式识别受体(PRRs)识别,从而启动天然免疫应答,如通过分泌干扰素等细胞因子抵御病毒的入侵[7]。干扰素通过信号通路引起下游基因的转录和表达,从而起到抗病毒的作用[8]。OAS1、MxA、PRK 均为干扰素的效应蛋白;慢性HBV 感染者的天然免疫应答是受到损伤的[9,10],恢复慢性HBV 感染者的天然免疫应答是治疗CHB方法之一。我们研究发现灵猫方可以明显增加肝细胞I、III型干扰素的产生,其干扰素的效应蛋白也明显升高,因此推测灵猫方是通过增强天然免疫抑制HBV复制。
HBV 可通过自身HBeAg 和HBx 等多种蛋白成分,干扰Toll 样受体( TLRs) 和维甲酸诱导基因( RIG-I) 两种抗病毒信号转导途径,来抑制天然免疫应答的强度[11]。RIG-I介导的干扰素诱导通路主要是在细胞质内,RIG-I可识别HBVpgRNA的50-ε结构域,诱导III型干扰素的形成[12]。RIG-I-IFN-β信号通路在慢性HBV感染者中的功能受到损伤[13]。我们的研究发现灵猫方高、低剂量组细胞胞质中的RIG-I mRNA明显提高,因此推测灵猫方可能是通过提高RIG-I的表达,恢复RIG-I-IFN-β信号通路,增加干扰素合成,增强天然免疫功能,从而起到抗HBV的作用。
[1] Ott JJ,Stevens GA, Groeger J,etal.Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity[J]. Vaccine,2012,30( 12) : 2212- 2219.
[2] Lozano R,Naghavi M, Foreman K,etal.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380( 9859) : 2095-2128.
[3] Lu FM,Zhuang H. Management of hepatitis B in China[J]. Chin Med J ( Engl) ,2009,122( 1) : 3-4.
[4] Zhu XJ, Sun XH, Zhou ZH,etal.Lingmao Formula Combined with Entecavir for HBeAg-Positive Chronic Hepatitis B Patients with Mildly Elevated Alanine Aminotransferase: A Multicenter, Randomized,Double-Blind, Placebo-Controlled Trial[J].Evid Based Complement Alternat Med, 2013,现在发表:620230.
[5] 卢银平, 董继华 , 刘朝 , 等. 乙型肝炎病毒感染性复制子构建及其意义[J].中国公共卫生,2008,24(6):687-689.
[6] 赵钢,陈建杰. 王灵台教授论补肾法为主治疗慢性乙型肝炎的机制[J].中国中西医结合杂志,2005,25(1):78-79。
[7] Kotenko SV, Gallagher G, Baurin W,etal.IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex[J]. Nat Immunol, 2003,4(1):69-77.
[8] 刘颖,侯利华,陈薇. 干扰素的信号传导和抗病毒效应机制[J].生物技术通讯,2011,23(1):123-126.
[9] Dandri M,Locarn S. New insight in the pathobiology of hepatitis B virus infection[J].Gut,2012,61 (suppl1) :i.6-9.
[10] Zang Z,Zhang JY,Wang LF,etal. Immunopathogenesis and prognostic immune markers of chronic hepatitis B virus infection[J].J Gastroenterol Hepatol,2012,27( 2) : 223-230.
[11] 中华医学会肝病学分会,中华医学会感染病学分会.2015年慢性乙型肝炎防治指南[J]. 临床肝胆病杂志,2015,31(12):1941-1960.
[12] Seiichi Sato, Kai Li, Takeshi Kameyama,etal. The RNA Sensor RIG-I Dually Functions as an Innate Sensor and Direct Antiviral Factor for Hepatitis B Virus [J].Immunity ,2015,42(1):123-132.
[13] Zhao G1, An B, Zhou H,etal.Impairment of the retinoic acid-inducible gene-I-IFN-β signaling pathway in chronic hepatitis B virus infection[J]. Int J Mol Med, 2012,30(6): 1498-1504.
