乳酸杆菌与细菌性阴道病相关致病菌之间的关系
2013-10-25陈佳宁苏建荣康熙雄
陈佳宁 吕 志 苏建荣* 康熙雄
(1.首都医科大学附属北京友谊医院临床检验中心,北京100050;2.首都医科大学附属北京天坛医院实验诊断中心,北京100050)
正常阴道菌群以乳酸杆菌为优势菌,同时含有少量其他类型的厌氧菌等微生物[1]。阴道菌群维持着阴道微生态环境的平衡。
细菌性阴道病(bacterial vaginosis,BV)是一种菌群失衡的疾病状态,其特征是阴道菌群中以乳酸杆菌为主的正常定植菌数量减少和(或)种类缺失,而以厌氧菌为主的条件致病菌占据了优势菌的地位,从而导致了阴道微生态的失衡,容易引起一系列的合并症,如早产、盆腔炎性反应甚至肿瘤等[2-3]。目前引起BV阴道菌群失衡的病因学机制尚未明确[4],乳酸杆菌与其他条件致病性厌氧菌之间的关系仍有待深入研究。
阴道菌群中的大多数细菌为苛刻厌氧菌,难以进行常规培养和分离,只能利用分子生物学方法进行鉴定。本研究采用16S rRNA PCR方法对阴道菌群中的8种细菌进行检测,包括正常阴道菌群中常见的3种乳酸杆菌:卷曲乳酸杆菌(lactobacillus crispatus,L.crispatus)、詹氏乳酸杆菌(lactobacillus jensenii,L.jensenii)和惰性乳酸杆菌(lactobacillus iners,L.iners);5种在BV阴道菌群中分离率较高的细菌[5]:包括阴道加德纳菌(gardnerella vaginalis,G.vaginalis)、阴道阿托波菌(atopobium vaginae,A.vaginae)、普雷沃菌属(prevotella sp)、纤毛菌属(leptotrichia sp)和巨球菌属(megasphaera sp)。对这8种细菌的分离率进行分析,研究阴道菌群中乳酸杆菌和BV相关条件致病菌之间以及致病菌和致病菌之间的关系,以加深对BV阴道菌群构成状况的理解,为实验室更准确地诊断BV奠定基础。
1 材料与方法
1.1 研究对象
筛选170例18~45岁非妊娠期育龄妇女,研究对象均来自首都医科大学附属北京友谊医院妇科门诊和北京市房山区妇幼保健院门诊,除外滴虫、真菌等特异性阴道感染性疾病,除外梅毒等性传播疾病。按照Amsel标准[1]和Nugent积分方法进行分组。符合Amsel标准、同时Nugent积分≥7的划入BV组,共86例;不符合Amsel标准且Nugent评分为0~6分的划入非BV组(对照组),共84例。
Amsel标准:① 分泌物外观稀薄、均匀黏附于阴道壁;② 阴道pH值>4.7;③ 胺试验阳性;④ 分泌物涂片中找到线索细胞。找到线索细胞为必备项目,同时需有其他任意2项阳性。
1.2 标本采集
无菌棉拭子在受检者阴道壁下1/3处采集分泌物,放入无菌试管中立即送检。
1.3 主要试剂和仪器
1)试剂:细菌基因组DNA试剂盒(美国OMEGA公司),琼脂糖(北京赛百盛基因技术有限公司,中国)。
2)仪器:ABI7300PCR分析仪(美国 ABI公司),DYY-10C型电泳仪(北京六一仪器厂,中国),Gel Doc 2000凝胶成像系统(美国Bio-Rad公司)。
1.4 细菌基因组DNA提取
棉拭子在PBS缓冲液中悬浮振荡30 s,12 000 r/min离心5 min,取菌体沉淀按照DNA提取试剂盒说明书提取基因组DNA。提取的总DNA经1%琼脂糖凝胶电泳检测后,-20℃保存。
1.5 细菌特异性16S rRNA PCR检测及扩增产物分析
1)PCR:以样本总DNA为模板,分别采用卷曲乳酸杆菌、詹氏乳酸杆菌、惰性乳酸杆菌、阴道加德纳菌、阴道阿托波菌、普雷沃菌属、纤毛菌属和巨球菌属共8种细菌特异性引物扩增其中的16S rRNA片段。引物序列、PCR扩增片段长度及扩增条件见本课题组已发文章[5-6]。
2)产物分析:扩增产物在2%琼脂糖凝胶(含0.15 mg/L溴化乙啶)中以100 V电压电泳30~40 min,全自动凝胶图像分析系统显像观察。符合片段大小的阳性扩增产物经切胶纯化后由上海英俊生物技术有限公司进行DNA测序,并通过BLAST与Gene Bank比对。
1.6 统计学方法
数据用SPSS 11.5统计软件进行分析。任意2种细菌之间的相关性利用χ2检验和Spearman等级相关系数(Spearman’s rank correlation coefficient,rs)进行分析,以P<0.05为差异有统计学意义,相关性显著。rs相关程度判断标准:0.9~1.0,存在非常高的相关性;0.7 ~0.9,高度相关;0.5 ~0.7,中度相关;0.3 ~0.5,低度相关;0~0.3,微相关;0为无线性相关。3种及3种以上的细菌间相关性判断利用Kendall和谐系数W进行W假设检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR检测乳酸菌和BV相关细菌
卷曲乳酸杆菌、詹氏乳酸杆菌在非BV组的检出率明显高于BV组(P<0.05),而惰性乳酸杆菌在2组的检出率比较,差异无统计学意义。阴道加德纳菌、阴道阿托波菌、普雷沃菌属、巨球菌属以及纤毛菌属在BV组的检出率明显高于非BV组(P<0.05),详见表1。
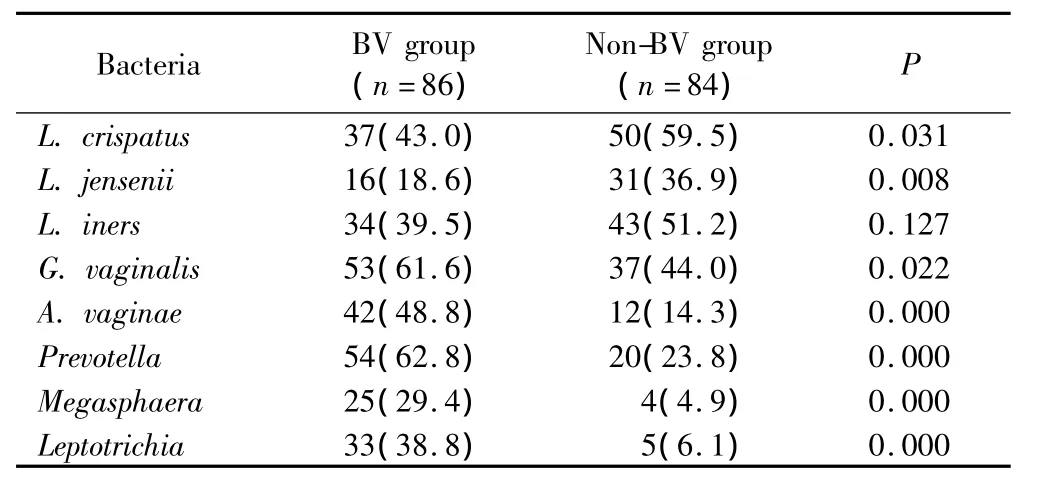
表1 乳酸杆菌和BV相关细菌在BV组及非BV组的PCR检测结果Tab.1 Distribution of lactobacilli and bacterial vaginosis associated bacteria in women in non-BV and BV groups determined by PCR n(%)
2.2 卷曲乳酸杆菌、詹氏乳酸杆菌与惰性乳酸杆菌之间的关系
170位BV及非BV妇女中,卷曲乳酸杆菌的检出率为51.2%(87/170),詹氏乳酸杆菌为27.6%(47/170),惰性乳酸杆菌为45.3%(77/170)。任意2种乳酸杆菌之间存在显著的正相关性,相关程度为低度相关(表2)。对Kendall和谐系数进行W假设检验,结果说明3种乳酸杆菌之间也存在显著的相关性(χ2=26.000,P <0.001)。
以卷曲乳酸杆菌为例,在检出卷曲乳酸杆菌的标本中,詹氏乳酸杆菌和惰性乳酸杆菌的检出率明显升高,详见表3。
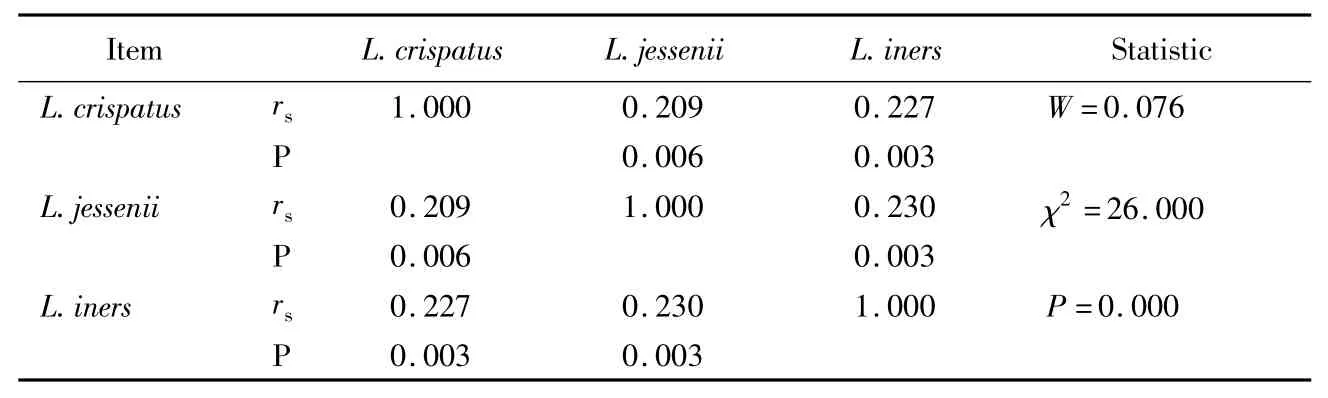
表2 乳酸杆菌之间的Spearman等级相关系数(rs)Tab.2 Spearman’s rank correlation coefficient(rs)of lactobacillus

表3 卷曲乳酸杆菌存在和不存在时不同细菌的检出率Tab.3 Prevalence of various bacteria according to the presence or absence of L.crispatus
2.3 BV相关致病菌之间的关系
阴道加德纳菌、阴道阿托波菌、普雷沃菌属、纤毛菌属、巨球菌属在170名被检妇女中的检出率依次为52.9%(90/170)、31.8%(54/170)、43.5%(74/170)、22.4%(38/170)、17.1%(29/170)。阴道加德纳菌与阴道阿托波菌(rs=0.415,P <0.05)、普雷沃菌属(rs=0.210,P <0.05)以及纤毛菌属(rs=0.273,P<0.05)存在显著的正相关关系(表4),在阴道加德纳菌存在的标本中,此3种细菌的检出率明显升高(表5)。巨球菌属与阴道加德纳菌没有相关性(rs=0.107,P>0.05)。阴道阿托波菌和其他4种 BV 相关细菌均具有显著的正相关性,普雷沃菌属和纤毛菌属也是如此。阴道阿托波菌与阴道加德纳菌、纤毛菌属间为中等程度的正相关,其余存在相关性的任意2种BV相关致病菌间均为低度相关。Kendall和谐系数的W假设检验结果显示5种BV相关致病菌之间存在显著的相关性(χ2=87.612,P < 0.001),详见表4。
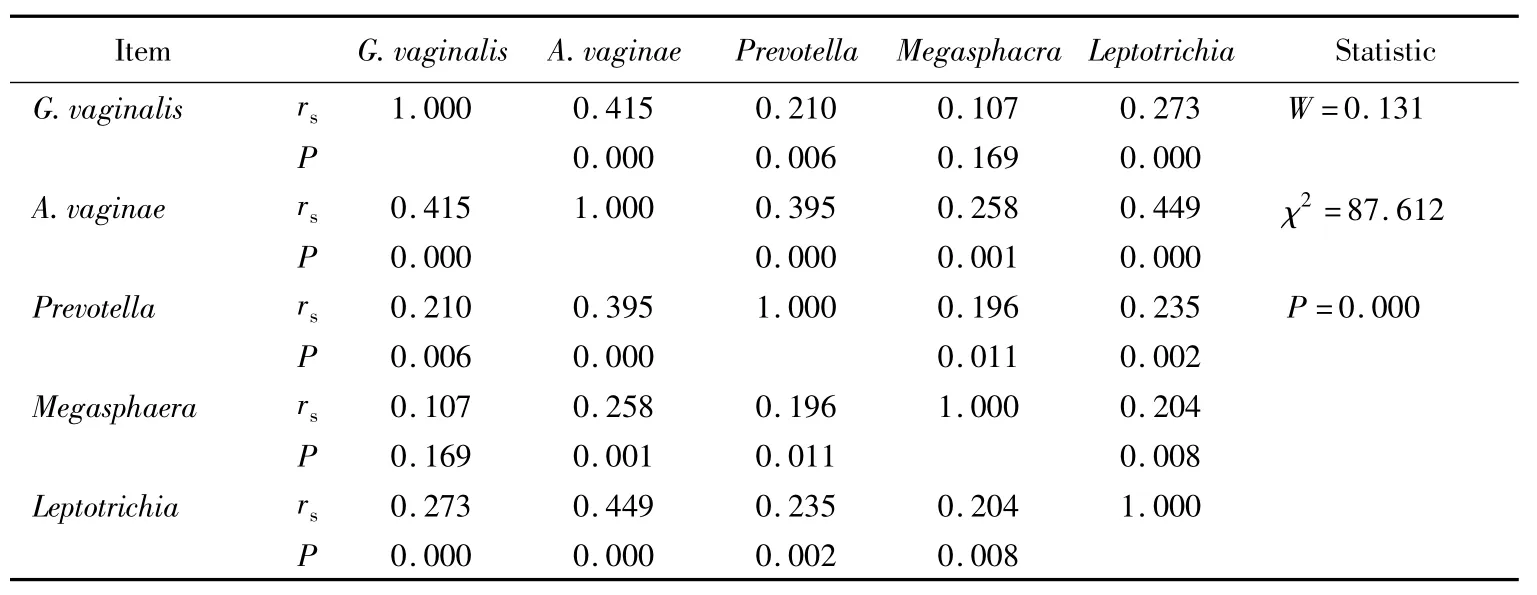
表4 BV相关致病菌之间的Spearman等级相关系数(rs)Tab.4 Spearman’s rank correlation coefficient(rs)of BV-associated bacteria
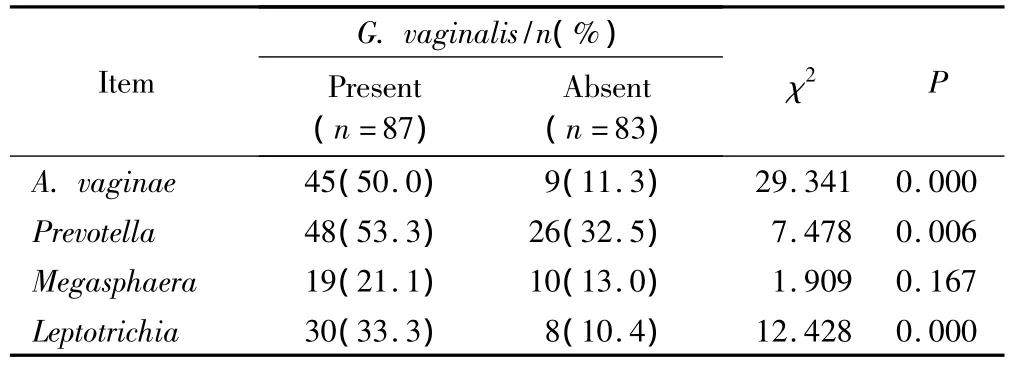
表5 阴道加德纳菌存在和不存在时BV相关细菌的检出率Tab.5 Prevalence of BV-associated bacteria according to the presence or absence of G.vaginalis
2.4 乳酸杆菌与BV相关致病菌之间的关系
卷曲乳酸杆菌与普雷沃菌属存在显著的负相关性,而其他4种BV相关细菌的检出率与卷曲乳酸杆菌无显著关联(表6)。惰性乳酸杆菌与阴道加德纳菌呈显著的负相关关系。普雷沃菌属、巨球菌属和纤毛菌属的检出率与惰性乳酸杆菌存在与否没有显著的关联。詹氏乳酸杆菌与阴道加德纳菌、阴道阿托波菌和纤毛菌属呈负相关。普雷沃菌属和巨球菌属与詹氏乳酸杆菌没有相关性。乳酸杆菌与对应有关联的BV相关致病菌间相关程度均为低度。
Kendall和谐系数的W假设检验结果显示乳酸杆菌与BV相关致病菌之间有显著的负相关关系(χ2=99.142,P <0.001)。
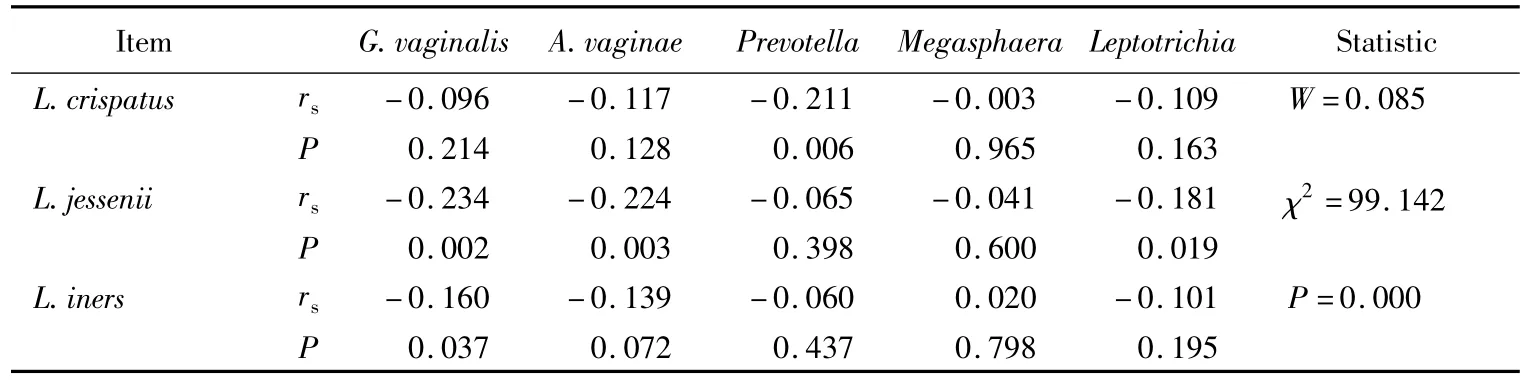
表6 乳酸杆菌与BV相关致病菌间的Spearman等级相关分析Tab.6 Spearman’s rank correlation coefficient(rs)between lactobacilli and BV-associated bacterium
3 讨论
细菌性阴道病是阴道菌群失衡的一种疾病状态,正常优势菌乳酸杆菌的比例下降或缺失、阴道加德纳菌和其他厌氧菌的比例升高,阴道的正常微生态环境被破坏[7]。
正常阴道定植的乳酸杆菌种类很多,大量的研究[8-11]认为乳酸杆菌特别是产过氧化氢的乳酸杆菌在维持阴道自洁、抑制致病微生物过量繁殖中起着重要的作用。本研究选择了卷曲乳酸杆菌、詹氏乳酸杆菌和惰性乳酸杆菌3种阴道常见乳酸杆菌[12-13]进行研究。Antonio等[14]报道,卷曲乳酸杆菌和詹氏乳酸杆菌产过氧化氢的能力最强。惰性乳酸杆菌是已知产过氧化氢较弱的乳酸杆菌。在现有的报道中,几乎所有的卷曲乳酸杆菌和詹氏乳酸杆菌的菌株都可以产生过氧化氢,而惰性乳酸杆菌仅有约9%的菌株能够产生过氧化氢[14-15]。
本研究中,卷曲乳酸杆菌和詹氏乳酸杆菌在非BV组的检出率显著高于BV组,而惰性乳酸杆菌在2组间的检出率无显著差别,与Tamrakar等[13]的报道相符。这也符合乳酸杆菌的产过氧化氢理论,即在BV时产过氧化氢能力强的卷曲乳酸杆菌和詹氏乳酸杆菌明显减少,而产过氧化氢能力弱的惰性乳酸杆菌在BV阴道菌群与非BV阴道菌群中变化不明显。
本研究显示,卷曲乳酸杆菌、詹氏乳酸杆菌、惰性乳酸杆菌3种乳酸杆菌具有显著的共存性。证明阴道菌群中乳酸杆菌是多种类并存的。
在本研究涉及的5种BV相关致病菌中,只有普雷沃菌属与卷曲乳酸杆菌存在显著的负相关关系,即在卷曲乳酸杆菌不存在的标本中,普雷沃菌属的检出率增高,阴道加德纳菌等的检出率和卷曲乳酸杆菌的存在与否并无明确关联,这与卷曲乳酸杆菌的强产过氧化氢能力似乎不符。因为本研究是基于定性PCR检测,不能反映检测菌的量和比例关系,所以也可以推断可能是阴道菌群中卷曲乳酸杆菌的量和比例关系决定了其对BV相关细菌的影响。
詹氏乳酸杆菌与阴道加德纳菌、阴道阿托波菌和纤毛菌属均存在显著的负相关,证明这3种BV相关致病菌通常不与詹氏乳酸杆菌共存于阴道菌群中。说明詹氏乳酸杆菌的存在对阴道加德纳菌、阴道阿托波菌和纤毛菌属有明显的负性影响,即可能会抑制这3种菌的生长。这与詹氏乳酸杆菌的强过氧化氢产生能力相符合。普雷沃菌属、巨球菌属与詹氏乳酸杆菌无明确关联。
惰性乳酸杆菌与阴道加德纳菌呈负相关,阴道阿托波菌、普雷沃菌属、纤毛菌属和巨球菌属的检出率与惰性乳酸杆菌无明确关联,这与Tamrakar等[15]的报道相反。Tamrakar等[15]研究认为惰性乳酸杆菌与BV相关细菌有共存关系。本文的结果表明惰性乳酸菌作为阴道正常定植乳酸菌的一种,与阴道加德纳菌有显著的“不共存性”,而与阴道阿托波菌、普雷沃菌属、纤毛菌属和巨球菌属之间也无明显依存关系。这或可说明惰性乳酸杆菌对BV常见的致病菌阴道加德纳菌具有一定的抑制作用,也可能惰性乳酸杆菌是通过与其他乳酸杆菌的共生来达到某种稳态以抑制阴道加德纳菌的生长。而惰性乳酸杆菌与其他4种BV相关致病菌无显著关联性,这与其较弱的过氧化氢产生能力是相符的。
本研究对BV相关致病菌分析后发现,除阴道加德纳菌与巨球菌属无明显关联外,5种BV相关细菌之间均存在正相关关系。这证明BV阴道菌群是多种致病菌共存的复杂的生态环境,并非单一致病菌在起作用。本研究显示阴道阿托波菌与阴道加德纳菌、普雷沃菌属和纤毛菌属的共存关系较强,并且3种常见乳酸杆菌与5种BV相关致病菌之间存在显著的负相关关系,即不共存性。由此可见,单独对某一种BV相关细菌进行检测不能对BV进行有效的诊断,更不能反映阴道菌群的真实情况。对具有显著共存关系的BV相关细菌进行联合测定,能够给临床提供更准确的诊断结果和更真实的阴道菌群构成情况。通过本研究可推断联合检测阴道阿托波菌、普雷沃菌属、纤毛菌属会为BV提供更准确的诊断。如果同时引入与BV相关细菌有显著不共存关系的乳酸杆菌加入到上述联合检测中,也可能会有意想不到的良好效果。
[1]Srinivasan S,Fredricks D N.The human vaginal bacterial biota and bacterial vaginosis[J].Interdiscip Perspect Infect Dis,2008,750479.Epub 2009 Feb 16.
[2]Pretorius C,Jagatt A,Lamont R F.The relationship between periodontal disease,bacterial vaginosis,and preterm birth[J].J Perinat Med,2007,35(2):93-99.
[3]Livengood C H.Bacterial vaginosis:an overview for 2009[J].Rev Obstet Gynecol,2009,2(1):28-37.
[4]Schwebke J R.New concepts in the etiology of bacterial vaginosis[J].Curr Infect Dis Rep,2009,11(2):143-147.
[5]吕志,彭国丽,苏建荣.细菌16S rRNA基因PCR诊断细菌性阴道病的研究[J].首都医科大学学报,2012,33(2):153-157.
[6]彭国丽,吕志,苏建荣.荧光定量PCR比较不同季节妇女阴道主要乳酸杆菌的差异[J].中国实验诊断学,2010,14(2):236-239.
[7]White B A,Creedon D J,Nelson K E,et al.The vaginal microbiome in health and disease[J].Trends Endocrinol Metab,2011,22(10):389-393.
[8]Kilic A O,Pavlova S I,Alpay S,et al.Comparative study of vaginal lactobacillus phages isolated from women in the United States and Turkey:prevalence,morphology,host range,and DNA homology[J].Clin Diagn Lab Immunol,2001,8(1):31-39.
[9]Zhou X,Bent S J,Schneider M G,et al.Characterization of vaginal microbial communities in adult healthy women using cultivation-independent methods[J].Microbiology,2004,150(Pt8):2565-2573.
[10]宋娟.12460例阴道分泌物检验结果分析P[J].解放军医药杂志,2011,23(5):46-48.
[11]李全桂,王英.阴道分泌物检测754例结果分析[J].临床误诊误治,2010,23(6):528-530.
[12]Fredricks D N,Fiedler T L,Marrazzo J M.Molecular identification of bacteria associated with bacterial vaginosis[J].N Engl J Med,2005,353(18):1899-1911.
[13]Yan D H,Lü Z,Su J R.Comparison of main lactobacillus species between healthy women and women with bacterial vaginosis[J].Chin Med J(Engl),2009,122(22):2748-2751.
[14]Antonio M A D,Hawes S E,Hillier S L.The identification of vaginal Lactobacillus species and the demographic and microbiologic characteristics of women colonized by these species[J].J Infect Dis,1999,180(6):1950-1956.
[15]Tamrakar R,Yamada T,Furuta I,et al.Association between Lactobacillus species and bacterial vaginosis-related bacteria,and bacterial vaginosis scores in pregnant Japanese women[J].BMC Infect Dis,2007,7:128.
