TNF-α与Ca2+在大鼠创伤性脑水肿中的相关性研究
2018-07-04何济民郑晓梅陈礼刚
何济民,郑晓梅,张 烨,黄 浩,官 明,江 涌,陈礼刚,刘 亮
颅脑创伤是病死率和致残率最高的疾病之一。目前我国颅脑创伤的发病率在200~300/10万人,且国内外呈上升趋势[1-2]。脑水肿是导致颅脑创伤患者后期死亡的关键因素。如何更好地认识创伤后脑水肿发生发展机制及缓解创伤后脑水肿是颅脑创伤一直以来的重点。研究[3-5]表明,炎症反应与颅脑创伤密切相关,脑组织的炎症反应于颅脑创伤后几分钟即开始。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子对脑水肿发挥重要作用[6]。在创伤的脑细胞中TNF-α mRNA表达明显增加,潜在地导致继发性神经元损伤[7-8]。细胞内钙超载是导致细胞死亡的共同途径,已经证实在颅脑创伤后Ca2+通道拮抗剂的使用具有与治疗性低温相似的保护作用[9];同时已发现Ca2+在TBI后脑细胞水肿及细胞死亡中具有重要作用[10],下调钙传导蛋白表达显著改善了TBI模型中的神经元存活,更好地保留了神经功能[11]。然而对于颅脑创伤所致脑水肿目前未见TNF-α与Ca2+相互作用的相关报道,该研究通过分别抑制TNF-α表达及脑细胞Ca2+超载来观察相应脑水肿程度,探究两者在脑水肿中的作用及相关机制,为创伤后脑水肿提供新的线索。
1 材料与方法
1.1动物选择健康清洁级SD大鼠(雌雄无异)80只,体质量250~300 g,由西南医科大学SPF级实验动物中心提供。
1.2试剂TNF-α 抑制剂(环戊苯吡酮)由美国MEC公司提供;Ca2+通道阻滞剂(尼莫地平注射液)由德国拜耳医药保健有限公司提供;SDS-PAGE凝胶制备试剂盒、RIPA总蛋白裂解液、BCA蛋白质浓度测定试剂盒、ECL化学发光检测试剂盒、抗体洗脱液、显影定影液、脱脂奶粉均由阿斯本生物公司提供;蛋白酶抑制剂由上海玉博生物科技有限公司提供;RNA提取试剂盒、标记蛋白由赛默非世尔科技(中国)有限公司提供。
1.3制作颅脑创伤动物模型将大鼠随机分成4组:空白对照组、单纯处理组、环戊苯吡酮(TNF-α抑制剂)处理组、尼莫地平处理组。创伤处理模型参照Feeney’s自由落体模型设计制作[12]。将大鼠用3%水合氯醛腹腔内注射麻醉后,俯卧位置于大鼠立体定位仪平台上,固定头部。备皮消毒后,沿右侧颅顶旁正中切口,分离骨膜,用简易颅骨钻在前囱后1.5 mm,中线旁2 mm处钻一直径约4 mm的骨窗,保持硬脑膜完整,将撞杆头端置于骨窗硬膜外,用100 g重的击锤从50 cm高处自由坠落冲击撞杆,撞击能量为500 J,造成颅脑损伤,适量骨蜡填缝骨窗及缝合切开,制作大鼠创伤性脑损伤模型。单纯处理组只单纯创伤处理;环戊苯吡酮处理组于创伤后立即给予环戊苯吡酮(1 mg/100 g),以后每24 h同量腹腔给予1次,持续3 d;尼莫地平处理组于创伤后立即给予尼莫地平(0.5 mg/kg),以后每24 h同量腹腔给予一次,持续3 d。
1.4影像学检查及脑组织取材各组大鼠MRI采集影像后颈椎脱臼处死,根据MRI提示定位取出创伤区域脑组织,每组大鼠脑组织分别取材检测TNF-α、AQP-4与Ca2+。
1.5脑组织TNF-α、AQP-4检测
1.5.1Western blot法检测各组TNF-α、AQP-4蛋白表达量 创伤区域取材的脑组织块用预冷的PBS 缓冲液漂洗后剪成芝麻大小小块,按照组织蛋白提取试剂中的步骤提取总蛋白溶液。使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。根据样品浓度确定上样量,然后依次点样、电泳、孵育抗体、曝光检测,最后AlphaEaseFC软件处理系统分析目标带的光密度值。
1.5.2Real-time PCR法检测TNF-α、AQP-4 mRNA表达量 创伤区域取材的脑组织块于液氮中保存,于1 ml 预冷的TRIzol中充分研磨,依次按步骤提取RNA,第一链cDNA的合成采用逆转录试剂盒进行(日本TaKaRa公司);实时荧光定量PCR是在Life technologies公司的StepOneTMReal-Time PCR仪上完成,每个样品均设3个复孔,使用SYBR®Premix Ex TaqTM试剂盒进行(日本TaKaRa公司),最后采用SPSS 13.0统计软件进行数据分析。
1.5.3免疫组化检测TNF-α、AQP-4表达量 脑组织取材后依次经甲醛固定、石蜡包埋、切片、烘片、微波修复、封闭后,每张切片加入约50 μl稀释的兔抗鼠一抗覆盖组织,4 ℃过夜,PBS清洗,去除PBS液,每张切片加50~100 μl山羊抗兔二抗,37 ℃孵育50 min。清洗后用DAB溶液显微镜控制显色。显色完全后,苏木精复染,氨水返蓝,流水冲洗,梯度酒精脱水干燥,中性树胶封固后置于显微镜下取图。
1.6脑组织Ca2+检测各组大鼠脑组织取出后立即用PBS冲洗2次,并于PBS中剪成糊状,转移至离心管离心,离心后加入0.25%胰酶于37 ℃恒温水浴箱中消化40 min ,每隔5 min 吹打1次,消化完毕后加入等量DMEM培养液终止消化,以1 000 r/min离心10 min,去除上层液体,加入PBS,吹打均匀后通过300目细胞筛,取通过细胞筛后液体,1 000 r/min离心机中离心5 min,弃掉上清液,然后加入完全DMEM培养液,获得脑组织单细胞悬液。取100 μl脑组织悬液用苔盼蓝染色后上镜检测细胞存活率,若细胞存活率>95%,为合格的单细胞悬液,可以备用。将备用单细胞悬液放入4 ℃台式离心机以3 000 r/min离心5 min,离心后去掉上清液,加入GENMED裂解液充分混匀,转移入预冷离心管强力旋涡震荡15 s ,置于冰槽孵育30 min后于4 ℃离心机15 000 r/min离心10 min,抽取上清液待检,将待检液按照试剂盒说明顺序进行吸光度检测各组标本吸光度值,然后根据公式计算检测的细胞内Ca2+浓度:检测样品浓度=标准曲线获得样品对应钙浓度(mmol/L)×样品稀释倍数。

2 结果
2.1各组Ca2+浓度比较结果显示,4组脑组织中单纯处理组Ca2+浓度最高,其次为环戊苯吡酮处理组、尼莫地平处理组,空白对照组Ca2+浓度最低,见图1。
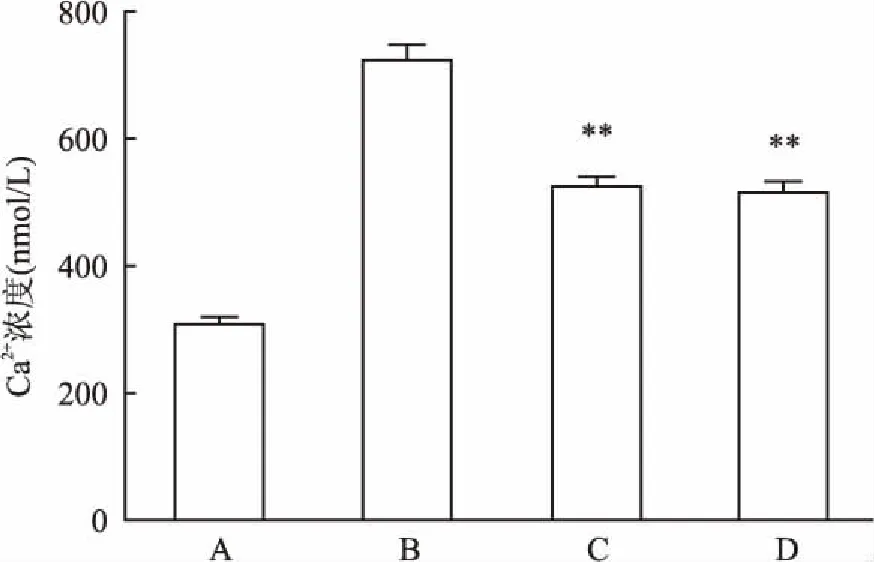
图1 各组脑组织中细胞内Ca2+浓度
A:空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组;与单纯处理组比较:**P<0.01
2.2各组创伤区脑组织中TNF-α表达经过聚丙烯酰胺凝胶电泳后可见TNF-α和GAPDH两条带分别为16 ku和37 ku,4组中均有表达。与单纯处理组相比,环戊苯吡酮处理组TNF-α蛋白表达量明显降低了52.58%(F=1.41,P<0.01),但仍明显高于空白对照组,说明TNF-α抑制剂环戊苯吡酮可以降低创伤脑组织中TNF-α蛋白的表达;与单纯处理组相比,尼莫地平处理组TNF-α蛋白表达量变化不大(F=1.30,P>0.05),提示Ca2+通道阻滞剂尼莫地平并不能降低创伤脑组织中TNF-α蛋白的表达。
各组脑组织TNF-α mRNA表达情况:与单纯处理组扩增倍数相比,环戊苯吡酮处理组明显降低(F=1.95,P<0.01),同样说明TNF-α抑制剂可以降低创伤脑组织中TNF-α mRNA的表达;与单纯处理组相比,尼莫地平处理组变化不大(F=2.67,P>0.05),同样说明Ca2+通道阻滞剂并不能降低创伤脑组织中TNF-α mRNA的表达。见图2。

图2 Western blot法检测各组脑组织内TNF-α蛋白表达量
A:空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组;与单纯处理组比较:**P<0.01
2.3各组创伤区脑组织中AQP-4表达不同处理组中创伤脑组织经Western blot蛋白检测可见,与单纯处理组相比,环戊苯吡酮处理组明显降低,尼莫地平处理组也明显降低(F=1.32、4.12,P<0.01),但较空白对照组仍较高。说明TNF-α抑制剂环戊苯吡酮和Ca2+通道阻滞剂尼莫地平均可以一定程度影响创伤脑组织中AQP-4蛋白的表达,见图3。
由图3、4可见,AQP-4在4组中均有表达,空白对照组AQP-4表达最低,单纯处理组最高,环戊苯吡酮处理组、尼莫地平处理组较单纯处理组均明显降低,但较空白对照组仍高;图4为各组脑组织AQP-4表达情况,与图5各组脑组织AQP-4基因表达情况相比,各组对比变化趋势大致相同,且空白对照组、环戊苯吡酮处理组、尼莫地平处理组各组与单纯处理组相比差异均有统计学单纯处理意义,环戊苯吡酮处理组和尼莫地平处理组较单纯处理组AQP-4表达明显降低。说明TNF-α抑制剂环戊苯吡酮和Ca2+通道阻滞剂尼莫地平均可以抑制水肿蛋白在脑组织中的表达。
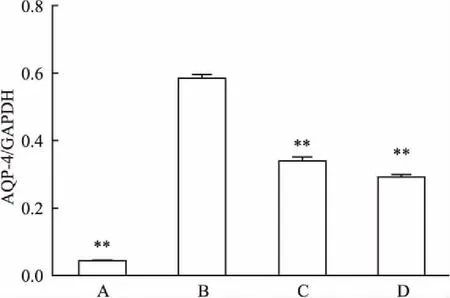
图3 Western blot法检测各组脑组织内AQP-4蛋白表达量
A:空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组;与单纯处理组比较:**P<0.01

图4 各组脑组织中AQP-4基因扩增对比
A:空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组;与单纯处理组比较:**P<0.01
2.4各组大鼠脑组织免疫组化结果图5、6分别为各组大鼠脑组织TNF-α、AQP-4的免疫组化图,箭头所指为目标染色所在。图5可见经TNF-α抑制剂处理的大鼠脑组织TNF-α表达比单纯创伤大鼠有明显降低,尼莫地平处理组较单纯处理组似乎变化不大;图6可见经环戊苯吡酮和尼莫地平处理过的大鼠脑组织较单纯处理组脑组织AQP-4均明显减少。此结果与Western blot、PCR检测结果一致。

图5 TNF-α的免疫组化图 苏木精染色×400
A空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组

图6 AQP-4的免疫组化图 苏木精染色×400
A:空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组
2.5各组大鼠脑组织影像学检测结果图7A为正常大鼠颅脑影像,图7B为单纯处理组大鼠脑组织影像,创伤后未经任何处理,伤后3 d 可见脑组织水肿仍较明显;图7C为经TNF-α抑制剂环戊苯吡酮处理过,伤后3 d 影像最大水肿层面比(4.26±0.61)/(24.6±0.97)提示较单纯创伤组最大水肿层面比(8.74±1.09)/(24.5±0.85)明显减小,有好转(F=3.98,P<0.01),说明抑制TNF-α表达可以降低脑水肿;图7D为经钙通道阻滞剂尼莫地平处理过后影像,最大水肿层面比(3.78±0.72)/(24.4±0.64)同样提示较单纯处理组最大水肿层面比(8.74±1.09)/(24.5±0.85)明显减小,水肿有好转(F=2.30,P<0.01),说明抑制钙通道可以降低脑水肿。见图7。
3 讨论

图7 各组大鼠脑组织MRI检查
A:空白对照组;B:单纯处理组;C:环戊苯吡酮处理组;D:尼莫地平处理组
急性颅脑损伤后继发性脑水肿程度对患者预后至关重要,许多炎性因子参与了颅脑创伤后脑水肿过程。创伤后炎性细胞因子在脑组织中过表达,使神经元赖以生存的环境改变,可导致神经元变性[13]。TNF-α是参与颅脑创伤后脑水肿重要的炎症因子,在颅脑创伤早期及继发性炎症反应中高表达,过度炎性反应时,TNF-α可改变血管内壁通透性,释放大量自由基,促发细胞毒性脑水肿,增加血脑屏障通透性,诱发脑水肿、炎症坏死及脑部微循环障碍[14]。研究[6]证明在不同程度颅脑损伤后第5天为TNF-α表达量高峰,并且其表达量与水肿程度呈相关性。同时,Ca2+是神经细胞内重要的第二信使,其在调节细胞黏附、细胞间通讯、酶活性、膜通透性、细胞代谢和多种蛋白激酶的活化中具有重要作用。细胞内外Ca2+浓度存在很大差异,维持细胞内外钙浓度稳定是细胞各项功能正常的基础,细胞内钙超载是导致细胞死亡的重要途径[15]。许多研究都已证明这两者在颅脑创伤后脑水肿中都起着重要作用。为探讨两者在创伤后脑水肿中的相关性及两者是否存在信号通路上的联系,笔者通过不同药物处理分别减少TNF-α和Ca2+在创伤后脑组织中的含量来控制实验组。
已有研究[16-18]证明,创伤后脑组织AQP-4表达量与脑水肿严重程度呈直线关系,所以可以通过AQP-4表达量及影像学等客观指标来探究不同因素影响下创伤后脑水肿的情况。通过对空白对照组和单纯处理组两组各指标及影像学的对比,显示在颅脑创伤后可出现脑水肿,创伤后组脑组织中TNF-α和AQP-4表达量及细胞内Ca2+浓度明显增加,这说明TNF-α、细胞内Ca2+浓度及AQP-4与创伤后脑水肿具有相关性;通过TNF-α抑制剂环戊苯吡酮处理后,再与单纯处理组比较,结果显示采用环戊苯吡酮处理组的创伤脑组织TNF-α、AQP-4表达量及细胞内Ca2+浓度都降低,且差异具有统计学意义。同时影像学提示环戊苯吡酮处理创伤组脑水肿较单纯处理组有明显降低,这说明在颅脑创伤后TNF-α的表达可影响细胞内Ca2+浓度及AQP-4表达量;采用Ca2+通道阻滞剂尼莫地平处理后,通过与单纯处理组比较,结果显示,采用尼莫地平处理的脑组织细胞内Ca2+浓度及AQP-4表达量明显降低,影像学也提示脑水肿较单纯处理组有明显降低;但其处理后的脑组织中TNF-α的表达量与单纯创处理相比并没有明显变化;这种现象提示在创伤后脑组织中Ca2+浓度的变化可以影响脑组织中AQP-4的表达及影响脑水肿,但并不能影响脑组织中TNF-α的表达。
综上,创伤后脑组织中TNF-α、细胞内Ca2+浓度变化都可以影响脑水肿的变化,且在相互影响上,TNF-α和细胞内Ca2+浓度变化是单向作用的,TNF-α表达可以影响细胞内Ca2+浓度变化,但是细胞内Ca2+浓度变化并不能影响组织中TNF-α表达。提示在颅脑创伤后TNF-α对脑水肿的影响可能是通过TNF-α影响细胞内Ca2+浓度来调节AQP-4表达量,从而参与颅脑创伤后脑水肿的发生;在影响脑水肿的信号通路中TNF-α可能是Ca2+的上游信号。这为进一步治疗创伤后脑水肿提供新的依据。
[1] 马定军,刘佰运,郝淑煜,等.颅脑创伤数据库平台的建立与初步应用[J].中华神经外科杂志,2014,30(2):159-61.
[2] Jones P G, Kool B, Dalziel S,et al. Time to cranial computerized tomography for acute traumatic brain injury in paediatric patients: effect of the shorter stays in emergency departments target in New Zealand[J]. J Paediatr Child Health,2017,53(7):685-90.
[3] Balu R. Inflammation and immune system activation after traumatic brain injury[J]. Curr Neurol Neurosci Rep,2014,14(10):484.
[4] Jha M K, Lee H W, Kim S Y, et al. Innate immune proteins as biomarkers for CNS injury: critical evaluation (WO2013119673 A1)[J]. Expert Opin Ther Pat,2015,25(2):241-5.
[5] Frugier T, Morganti-Kossmann M C, O'Reilly D,et al. In situ detection of inflammatory mediators in post mortem human brain tissue after traumatic injury[J]. Neurotrauma,2010,27(3):497-507.
[6] 王 佳,张红玉.不同程度颅脑损伤后炎症因子的表达及其临床意义[J].中国现代医学杂志,2016,3(26):72-5.
[7] Salvador E, Burek M, Förster C Y. Stretch and/or oxygen glucose deprivation (OGD) in aninvitrotraumatic brain injury (TBI) model induces calcium alteration and inflammatory cascade[J]. Front Cell Neurosci,2015,9:323.
[8] Baratz R, Tweedie D, Wang J Y, et al. Transiently lowering tumor necrosis factor-alpha synthesis ameliorates neuronal cell loss and cognitive impairments induced by minimal traumatic brain injury in mice[J].J Neuroinflammation,2015,12:45.
[9] Kim J Y, Kim N, Yenari M A,et al. Hypothermia and pharmacological regimens that prevent overexpression and overactivity of the extracellular calcium-sensing receptor protect neurons against traumatic brain injury[J]. J Neurotrauma,2013,30(13):1170-6.
[10] Weber J T. Altered calcium signaling following traumatic brain injury [J]. Front Pharmacol,2012,3:60.
[11] Rao W, Zhang L, Peng C,et al. Downregulation of STIM2 improves neuronal survival after traumatic brain injury by alleviating calcium overload and mitochondrial dysfunction[J]. Biochim Biophys Acta,2015,1852(11):2402-13.
[12] 李成长.Feeney's脑外伤模型造模体会[J].医药前沿,2013(26):318-9.
[13] Ahn M J, Sherwood E R, Prough D S,et al. The effects of traumatic brain injury on cerebral blood flow and brain tissue nitric oxide levels and cytokine expression[J]. J Neurotrauma,2004,21(10):1431-42.
[14] 郭梅凤,孙宝玲.急性颅脑损伤患者血清TNF-α和 IL-2 水平的变化及临床意义[J].实用临床医学,2012,13(3):1-3.
[15] 李燕华,孙善全. 大鼠脑出血后AQP4mRNA的表达与Ca2+关系的探讨[J]. 中国急救医学,2003,23(7):1-3.
[16] Finnie J W, Blumbergs P C, Manavis J. Aquaporin-4 expression after experimental contusional injury in an ovine impact-acceleration head injury model[J]. J Clin Neurosci,2011,18(7):947-50.
[17] Gandham E J, Vasudevan P, Moorthy R K,et al. Cortical Aquaporin-4 in relation to brain oedema and neurological function of cortical cryo-injured mice[J].J Clin Neurosc,2017,44:294-9.
[18] Lv Q, Fan X, Xu G,et al. Intranasal delivery of nerve growth factor attenuates aquaporins-4-induced edema following traumatic brain injury in rats [J]. Brain Res,2013,1493:80-9.
