PLA激活JNK信号通路促进NCI-H292细胞凋亡
2018-07-04吴莎莎范晓云梁雅雪徐玉菲王亚妮管明龙
吴莎莎,范晓云,梁雅雪,徐玉菲,王亚妮,管明龙
哮喘是以气道高反应性和气道重构为特征的一种常见的呼吸系统疾病,哮喘的本质是慢性气道炎症。气道上皮细胞(airway epithelial cell,AEC)是气道、肺内稳态和炎症的主要调节细胞,能够通过抑制内源性的PRR信号等机制抑制炎症过程[1],气道上皮损伤及损伤后的异常凋亡在哮喘发病中起到了重要作用,损伤的气道上皮细胞破坏了气道的屏障功能,并且能够合成释放多种炎症因子,调控哮喘气道炎症及气道重塑的病理过程[2]。聚阳离子蛋白多聚左旋精氨酸(poly-L-arginine,PLA)能够在不产生严重的上皮细胞毒性的情况下激活细胞内的激酶或磷酸酶,改变大分子透膜电位,体外研究中PLA常被来诱导气道上皮细胞模拟哮喘炎症反应[3]。实验组前期研究[4]显示体外 PLA 可引起气道上皮细胞凋亡,但其具体信号通路及分子调控机制尚不清楚,该研究旨在探讨c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路在此过程中的作用。
1 材料与方法
1.1材料与试剂
1.1.1细胞株 NCI-H292细胞属人肺的黏液上皮样癌细胞,由中国科学院上海生命科学研究院细胞库提供。
1.1.2主要试剂 胎牛血清(美国Gibco公司); Western blot检测试剂、RPMI 1640 培养液(美国 Thermo 公司);多聚左旋精氨酸、SP600125-JNK 通路特异性抑制剂(美国 Sigma 公司); 细胞凋亡相关蛋白B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,BCL-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, BAX)、含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase,Caspase-3)蛋白一抗(美国 CST 公司);抗β-actin 抗体、辣根酶标记山羊抗兔/小鼠 IgG(H+L)(北京中杉金桥公司);胰蛋白酶酶、Western blot 一抗稀释液、RIPA 裂解液(江苏碧云天公司);流式 Annexin V-66FITC/PI双染凋亡检测试剂盒(上海贝博生物公司)。
1.2方法
1.2.1细胞培养 NCI-H292细胞生长于10%胎牛血清+100 mg/L 青霉素+100 mg/L链霉素+12 mmol/L L-谷氨酰胺的RPMI1640培养液中,放置37 ℃、5%CO2培养箱内传代培养,每2~3 d换液1次。
1.2.2Western blot 法检测PLA处理24 h后的NCI-H292细胞内JNK及P-JNK 的表达 将加入PLA 的浓度梯度分5组: 0、10、20、40、60 mg/L,作用NCI-H292细胞24 h后提取各组细胞总蛋白,SDS-PAGE电泳分离蛋白并将目标蛋白转移至 PVDF 膜上,室温下在50 g/L的脱脂牛奶中封闭2 h,洗膜后孵化一抗过夜、再次洗膜后孵化二抗,最后将膜置于暗室中ECL显影。以β-actin为内参,Image J分析条带灰度值,分析各组JNK磷酸化有无差异。
1.2.3流式细胞仪双染色法检测JNK信号通路特异性阻断剂SP600125干预后PLA作用24 h的NCI-H292细胞凋亡率 设空白对照组、PLA 组、SP600125 组、PLA+ SP600125组,提前30 min用SP600125预处理NCI-H292细胞,然后按照分组要求加入PLA, 培养24 h后用胰酶消化转移至15 ml离心管离心5 min(1 500 r/min),弃上清液,PBS洗涤2次后离心5 min(1 500 r/min);用400 μl 1×Annexin V结合液悬浮细胞,室温下避光孵育15 min;再加入10 μl PI染色液,4 ℃下孵育 5 min,PBS洗涤重悬细胞,用流式细胞仪(BDFACSVERS,美国)检测,FlowJo软件分析结果。
1.2.4Western blot检测抑制JNK信号通路后凋亡蛋白及信号通路蛋白的表达 采用Western blot法分别检测空白对照组、PLA 组、PLA+ SP600125 组、SP600125 组中NCI-H292细胞内 Bax、Bcl-2、Casepase-3的表达和信号通路蛋白JNK、P-JNK的表达,具体操作方法同上。

2 结果
2.1PLA作用于NCI-H292细胞内的JNK磷酸化水平变化Western blot 法检测不同浓度 PLA( 0、10、20、40、60 mg/L)作用于NCI-H292细胞后各组的 JNK、P-JNK、β-actin 蛋白含量,与空白对照组比较, 10 mg/L组JNK 磷酸化水平差异无统计学意义(P=0.179),20、40、60 mg/L组的JNK 磷酸化水平均增加,且呈现浓度依赖性,差异有统计学意义(F=4.239,P均<0.05)。见图1。
2.2SP600125抑制PLA对NCI-H292细胞凋亡的诱导作用流式 Annexin V-FITC/PI 双染法检测NCIH292细胞凋亡率结果显示,空白对照组、PLA组、SP600125组、 PLA+SP600125组NCI-H292细胞凋亡率分别为(5.13±1.12)%、(22.62±1.66)%、(5.69±0.18)%、(8.99±1.74) %;采用单因素方差分析统计结果,显示各组间差异有统计学意义(F=113.961,P<0.001),与对照组相比,PLA 组NCI-H292细胞凋亡率增高(P<0.001);与PLA组比较,PLA+SP组细胞凋亡率降低(P<0.001)。说明PLA作用后NCI-H292细胞凋亡率增加,而SP600125能抑制PLA对NCI-H292细胞凋亡的诱导作用。见图2。
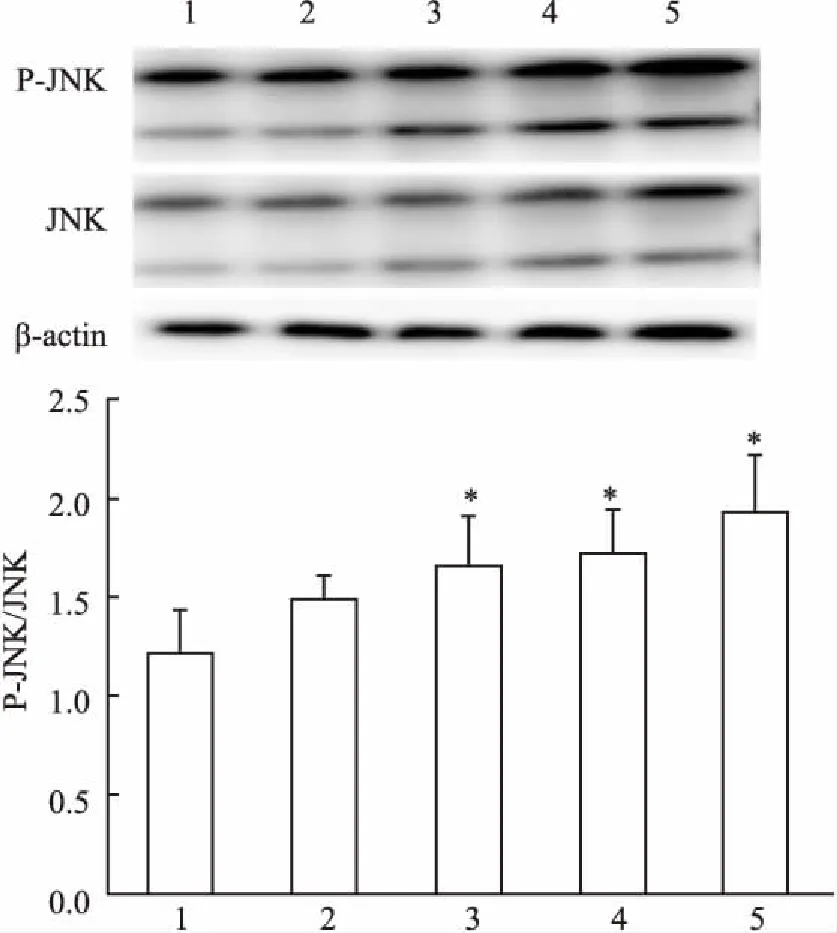
图1 Western blot法检测 PLA作用24 h后NCI-H292细胞内P-JNK/JNK的表达
1:0 mg/L PLA;2: 10 mg/L PLA; 3: 20 mg/L PLA; 4: 40 mg/L PLA; 5: 60 mg/L PLA;与对照组比较:*P<0.05
2.3SP600125对PLA诱导的NCI-H292细胞内Bcl-2、Bax、Caspase-3表达及JNK磷酸化的影响Western blot检测对照组、PLA 组、PLA+ SP组、SP组的BCL- 2 /Bax和Caspase-3、P-JNK/JNK水平,与空白对照组比较,PLA组Bcl-2/Bax比值降低(F=21.077,P<0.01); Caspase-3表达明显升高(F=31.768,P<0.001); P-JNK/JNK比值升高(F=31.778,P<0.001)。与PLA组比较,PLA+ SP组Bcl-2/Bax比值升高(P<0.001); Caspase-3表达下降(P<0.001); P-JNK/JNK比值降低(P<0.001)。见图3。
3 讨论
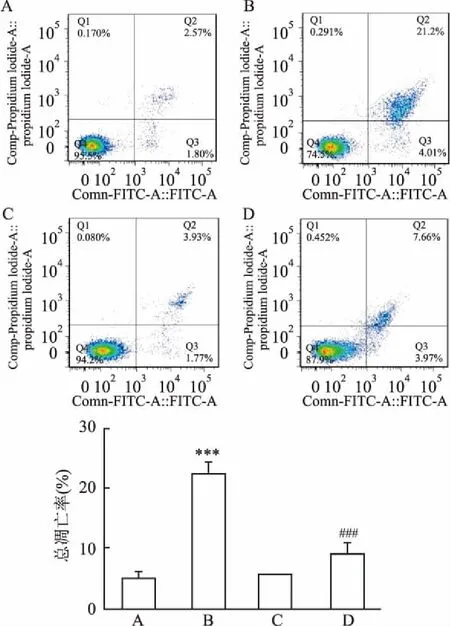
图2 流式细胞仪检测SP600125抑制PLA诱导 NCI-H292细胞凋亡
A:对照组;B:PLA组;C: SP组;D:PLA+SP组;与对照组比较:***P<0.001;与PLA组比较:###P<0.001
在支气管哮喘发病过程中气道上皮细胞易受到各种致炎因素攻击而发生凋亡[5],Bucchieri et al[6]发现吸烟可通过Caspase依赖途径引起哮喘气道上皮凋亡增多;Lin et al[7]研究证实来源于屋尘螨的吸入性变应原Der p2诱导支气管上皮BEAS-2B细胞株凋亡,本课题组前期研究[8]显示PLA可诱导NCI-H292细胞凋亡,说明外界刺激可引起哮喘患者气道上皮细胞调亡,气道上皮细胞异常凋亡可能是导致哮喘发病及气道重构的重要机制。JNK通路是MAPK家族代表性成员之一,可被应激刺激、细胞因子、氧化损伤等激活,是细胞凋亡的重要调节靶点,Lai et al[9]发现海洛因可通过激活JNK通路使原代培养的小脑颗粒细胞凋亡增多,使用JNK抑制剂SP600125,Caspase抑制剂z-VAD,或联合使用SP600125和z-VAD后该凋亡作用受到明显抑制。许多研究[10]证实JNK通路参与调控神经细胞、 心肌细胞、肝细胞及癌细胞的凋亡,但JNK在气道上皮细胞凋亡中作用的研究并不多见。本实验中,利用Western blot法检测不同浓度PLA( 0、10、20、40、60 mg/L)作用及使用JNK抑制剂SP600125后NCI-H292细胞中JNK的磷酸化水平,结果显示PLA诱导NCI-H292 细胞JNK磷酸化水平增加(P<0.001),且呈浓度依赖性,SP600125抑制PLA 诱导JNK 磷酸化(P<0.001),揭示PLA可能介导JNK信号通路引起气道上皮NCI-H292细胞凋亡水平增加。
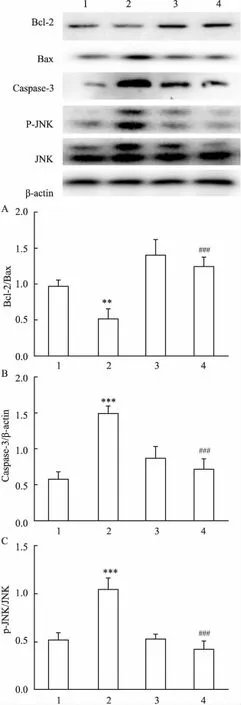
图3 Western blot法检测SP600125抑制PLA诱导 NCI-H292细胞内Bcl-2、Bax、Caspase-3及P-JNK/JNK的表达
A:统计分析Bcl-2与Bax条带灰度值比值;B:统计分析Caspase-3与β-actin条带灰度值比值;C:统计分析P-JNK与JNK条带灰度值比值;1:对照组;2: PLA 组;3: PLA+ SP组;4: SP组;与对照组比较:**P<0.01,***P<0.001;与PLA组比较:###P<0.001
Bcl-2是Bcl-2家族中抗凋亡的关键性蛋白,可通过抑制线粒体膜通透性减少由紫外线、自由基和生长因子缺乏等多种应激作用引起的细胞凋亡,研究[11]显示过敏性刺激后,支气管肺泡灌洗液Bcl-2蛋白表达增多,而Bcl-2抑制剂ABT-737和ABT-199可减少激素不敏感型哮喘的气道炎症反应,提示Bcl-2是哮喘气道炎症及气道上皮凋亡的调控因子。与之作用相反,Bcl-2家族另一成员Bax则诱导细胞死亡[12],Bax可通过BH3结构域与Bcl-2蛋白结合形成异二聚体,从而抑制 Bcl-2蛋白的抗凋亡作用。Caspase-3蛋白酶的激活是细胞凋亡过程中的核心步骤,在线粒体依赖的细胞凋亡途径激活后,Caspase-3通过细胞色素C介导引起DNA的降解或分裂,还可经Fas/FasL 介导的死亡受体细胞凋亡信号途径降解Bcl-2蛋白,从而诱导细胞凋亡。Rouabhia et al[13]研究表明电子烟烟雾通过Caspase-3途径诱导人牙龈上皮细胞凋亡。所以Bcl-2/Bax及Caspase-3均是反映细胞凋亡状态的重要指标,本实验中加入JNK抑制剂SP600125,PLA+SP组与PLA组相比Bcl-2/Bax升高,Caspase-3降低,说明PLA可能通过调控NCI-H292细胞内Bcl-2/Bax及Caspase-3水平诱导NCI-H292细胞胞凋亡。
[1] Weitnauer M, Mijoek V, Dalpke A H. Control of local immunity by airway epithelial cells[J]. Mucosal Immunol, 2016, 9(2): 287-98.
[2] Whitsett J A, Alenghat T. Respiratory epithelial cells orchestrate pulmonary innate immunity[J]. Nat Immunol, 2015, 16: 27e35.
[3] 陆兆双, 范晓云, 陈 冰, 等. 多聚左旋精氨酸通过p38/MAPK信号通路诱导NCI-H292细胞分泌IL-6、IL-8[J]. 安徽医科大学学报, 2014, 49(12): 1693-6.
[4] 张玲玲,范晓云,吴莎莎, 等. 多聚左旋精氨酸诱导NCI-H292细胞凋亡及其可能机制的分析[J]. 临床与实验病理学杂志,2016,32(10):1135-9.
[5] Gon Y, Hashimoto S. Role of airway epithelial barrier dysfunction in pathogenesis of asthma[J]. Allergol Int, 2018, 67(1):12-7.
[6] Bucchieri F, Marino Gammazza A, Pitruzzella A, et al. Cigarette smoke causes caspase independent apoptosis of bronchial epithelial cells from asthmatic donors[J]. PLoS One, 2015,10(3): e0120510.
[7] Lin C H, Hong Y C, Kao S H. Aeroallergen Der p 2 induces apoptosis of bronchial epithelial BEAS-2B cellsviaactivation of both intrinsic and extrinsic pathway[J]. Cell Biosci, 2015, 5:71.
[8] Fan X Y, Chen B, Lu Z S, et al. Poly-L-arginine acts synergistically with LPS to promote the release of IL-6 and IL-8viap38/ERK signaling pathways in NCI-H292 cells[J]. Inflammation, 2016, 39(1): 47-53.
[9] Lai B, Pu H, Cao Q, et al. Activation of caspase-3 and c-Jun NH2-terminal kinase signaling pathways involving heroin-induced neuronal apoptosis[J]. Neurosci Lett, 2011, 502(3): 209-13.
[10] 熊方圆, 唐松涛, 苏 欢, 等. 褪黑素对糖尿病大鼠心肌细胞凋亡及MAPK通路的影响[J].安徽医科大学学报, 2017, 52 (5): 634- 8.
[11] Tian B P, Xia L X, Bao Z Q, et al. Bcl-2 inhibitors reduce steroid-insensitive airway inflammation[J]. J Allergy Clin Immunol, 2017, 140(2): 418-30.
[12] Tsai C J, Liu S, Hung C L,et al. BAX-induced apoptosis can be initiated through a conformational selection mechanism[J]. Structure, 2015, 23(1): 139-48.
[13] Rouabhia M, Park H J, Semlali A, et al. E-cigarette vapor induces an apoptotic response in human gingival epithelial cells through the Caspase-3 pathway[J]. J Cell Physiol, 2017, 232(6): 1539-47.
