亮菌多糖对GES-1细胞发生EMT的影响及机制研究
2018-07-04赵莉莉朱耀东
赵莉莉,朱耀东,李 平,张 梅
上皮-间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞转化为具有间质表型细胞的生物学过程,在胚胎发育、伤口愈合、组织再生、器官纤维化和肿瘤进展中起重要作用[1]。研究[2]表明 ,EMT与胃癌的发生发展息息相关,广泛存在于胃癌前病变过程中,与多种信号通路及基因表达失调有关,其主要表现为细胞形态学变化及相关蛋白异常表达,胃黏膜上皮细胞由不规则多边形向梭形转变,细胞之间黏连减少,排列紊乱;其标记上皮细胞的E-钙黏蛋白(E-Cadherin)表达减少,标记间质细胞的N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)表达增多。亮菌多糖(Armillariellatabescenspolysaccharides,ATPS)是亮菌生长代谢过程中的有效产物,是亮菌口服液的有效成分,ATPS有明显的增强机体免疫力、抗肿瘤及保护胃黏膜的作用[3]。亮菌口服液临床广泛用于治疗慢性浅表性、萎缩性胃炎,并取得了较好的疗效,有效的逆转胃癌前病变,控制了疾病的进展。关于亮菌多糖对人胃黏膜细胞(human gastric epithelial cell line, GES-1)发生EMT的影响及相关机制研究,相关研究报道较少。该研究利用白介素-8(interleukin-8,IL-8)诱导GES-1细胞建立EMT模型;不同剂量亮菌多糖作用后细胞形态可部分恢复,侵袭力降低。
1 材料与方法
1.1实验仪器细胞培养箱购自美国Thermo公司;安全生物柜购自北京Aertai公司;DMEM培养基、胰酶购自美国Gibco公司;胎牛血清购自以色列Biological Industries公司;ATPS购自合肥诚志生物制药有限公司(纯度>90%);IL-8及IL-8溶解套装购自美国Peprotech公司,溶解稀释成25 mg/L,分装后-20 ℃保存;兔抗人E-Cadherin、N-cadherin、Vimentin、PDCD4抗体购自美国Cell Signaling Technology生物公司;鼠抗人GAPDH抗体购自上海BBI life sciences公司;二抗购自美国Promega公司;二甲基亚砜(DMSO)购自美国Sigma公司;四甲基偶氮唑盐(MTT)、细胞裂解液购自合肥biosharp公司。
1.2实验方法
1.2.1细胞培养 人胃黏膜上皮细胞GES-1株购自南京科佰生物科技有限公司,在细胞培养室的超净工作台上,将GES-1细胞置于DMEM培养液中(含10%胎牛血清,1%双抗 ),将培养皿置于培养箱中37 ℃、5% CO2培养。当培养皿中细胞生长近80%细胞基本融合时,用浓度为0.25% 胰蛋白酶37 ℃、5% CO2培养箱内消化2~3 min,显微镜下观察到细胞变圆、散开时,1 ∶1加入DMEM培养液终止消化,800 r/min离心3 min,重悬后分装至3小皿继续培养。
1.2.2建立EMT模型 生长至对数期的GES-1细胞,加入含10% FBS的DMEM完全培养基在37 ℃、5% CO2的条件下培养12 h,待细胞完全贴壁,更换培养基为1%FBS的DMEM,分别加入浓度为25、50、100、200、300 μg/L的IL-8作为实验组;对照组更换正常培养基,继续培养24 h。
1.2.3MTT法检测不同浓度亮菌多糖对GES-1细胞增殖的影响 取对数生长的GES-1细胞消化计数后接种于96孔细胞培养板中,8.0×103个每孔,37 ℃、5% CO2温室培养12 h细胞长成单层 ,将ATPS用DMEM稀释成15、30、60、120、240 mg/L分别加入各孔中,每孔0.1 ml,每一稀释度设置5个复孔 ,同时设立空白对照组、DMSO处理组及仅加DMSO组。37 ℃、5% CO2温育24 h后每孔加入MTT(5 g/L)10 μl后继续孵育4 h,小心吸净各孔内培养液,然后每孔内加入150 ml DMSO,震荡10 min,酶标仪测其波长490 nm吸光度,各组均取平均值,计算各组细胞的相对存活率并绘制柱状图。以空白组为零,抑制率(%)=1-(给药组OD值-DMSO组OD值)/(空白组OD值-DMSO组OD值)×100%,实验重复3遍。
1.2.4亮菌多糖对IL-8诱导的GES-1细胞发生EMT的影响 GES-1细胞随机分为5组,每组至少3复孔。分别设空白对照组、模型组、实验组[ATPS(高、中、低剂量)组]。待细胞贴壁后除空白对照组外,其余各组预先更换为1% FBS的DMEM并给予IL-8 200 μg/L孵育1 h后,实验组给予不同浓度(30、60、120 mg/L)的亮菌多糖继续孵育24 h。
1.2.5光学显微镜观察细胞形态变化 取不同浓度IL-8诱导24 h后的GES-1细胞显微镜下拍照,每孔取4个视野;同样的方法对亮菌多糖处理后的各组细胞在光学显微镜下拍照。
1.2.6细胞划痕实验 先用记号笔在6孔板背后用直尺均匀划横线,每孔至少穿过5条线,将对数期生长的GES-1细胞胰蛋白酶消化、10% MDEM重悬,每孔内加入约8×105个细胞,以过夜能铺满孔底为最好,37 ℃、5% CO2的条件下培养待细胞至细胞融合达到90%以上,用100 μl移液枪头在孔板内平行划痕,PBS液洗涤3次后,空白对照组加入1% FBS的DMEM培养基1.5 ml,模型组加入IL-8 200 μg/L含1% FBS的DMEM培养基1.5 ml,实验组加入IL-8 200 μg/L含1%FBS的DMEM培养基1.5 ml培养1 h后加入ATPS 120 mg/L,在倒置显微镜100倍下观察、划痕两侧细胞的迁移情况,放入37 ℃、5% CO2培养箱内培养,分别于0、6、12、18、24 h镜下拍照测量划痕宽度,比较各组间划痕愈合的差异,实验重复3次。
1.2.7Western blot法检测EMT相关蛋白及PDCD4蛋白的表达 将处理后细胞弃上清液,加入细胞裂解液(80~100 μl),充分搔刮孔底后收集样本,沸水煮样10 min,-20 ℃冻存备用。5%浓缩胶,10%分离胶,每孔上样10 μl,90 V恒压电泳20 min,调整电压150 V电泳60 min;恒流350 mA转膜150 min,将蛋白转至NC膜上;用50 mg/L的脱脂奶粉封闭1 h,加入一抗4 ℃ 孵化过夜,E-Cadherin(1:300)、N-cadherin(1 ∶500)、Vimentin(1 ∶500)、PDCD4(1 ∶500)、GAPDH(1 ∶1 000),TBST洗去一抗(共洗5次,每次7 min),加二抗(1 ∶10 000)室温孵化1h,TBST洗去二抗(共洗5次,每次7 min),ECL发光试剂A液:B液1 ∶1混合后均匀滴在条带上,使用ImageQuant LAS 4000系统显影,Image-Pro-Plus软件进行Western blot条带灰度值分析。

2 结果
2.1观察EMT模型细胞形态变化IL-8诱导24 h后,GES-1细胞形态由不规则多边形、易聚集成片向梭形转变,细胞排列疏松紊乱,细胞间粘连度减小,随IL-8浓度越大,细胞形态变化越明显,见图1。
2.2Westernblot法检测IL-8诱导的GES-1细胞EMT相关蛋白表达变化结果显示,其标记上皮细胞的E-Cadherin表达减少,标记间质细胞的N-cadherin、Vimentin表达增多,综合3种蛋白表达量变化情况及结合形态学变化,选择IL-8 200 μg/L诱导建立EMT模型,见图2。
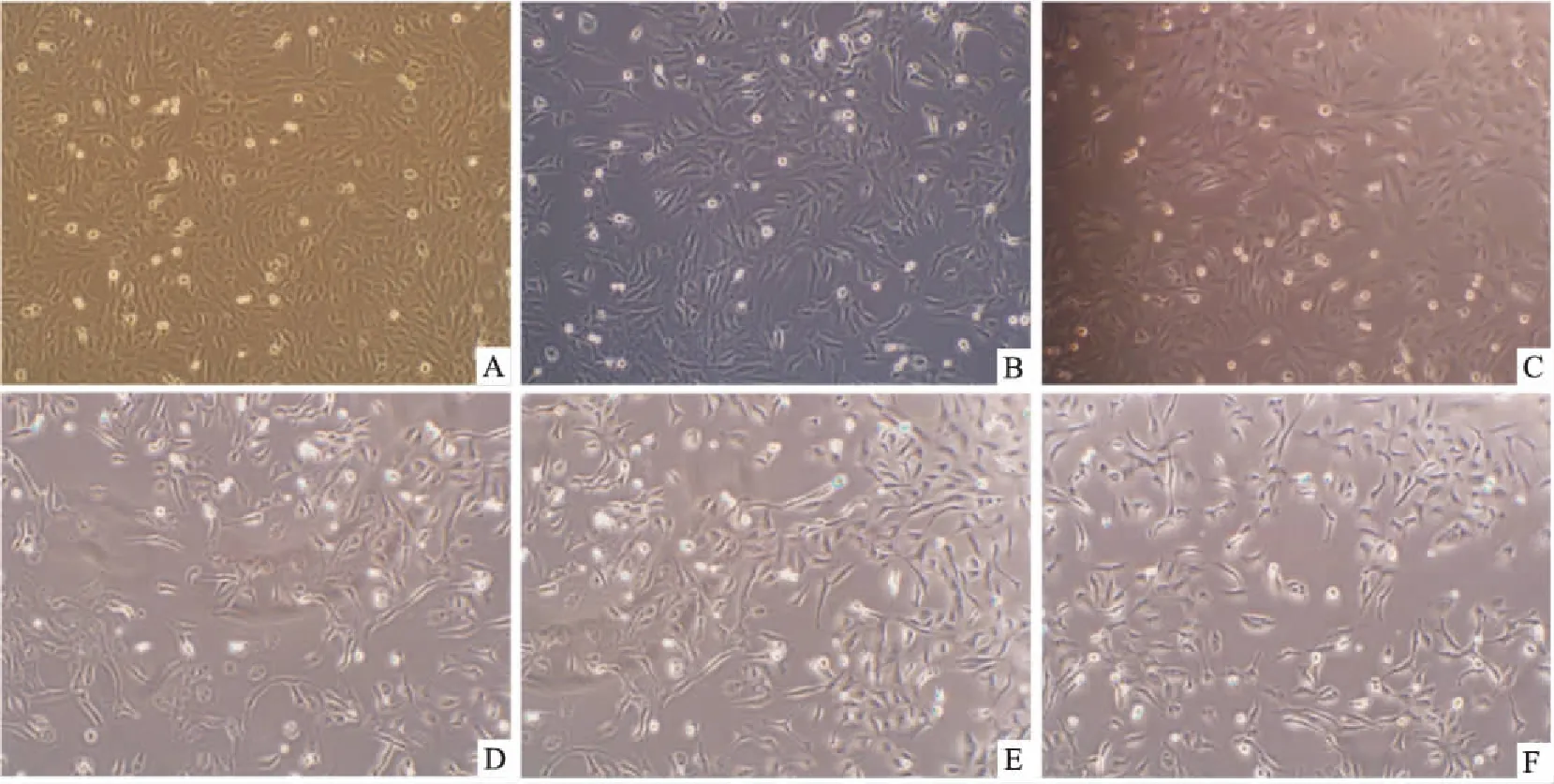
图1 IL-8诱导GES-1发生EMT转变细胞形态的变化 ×100
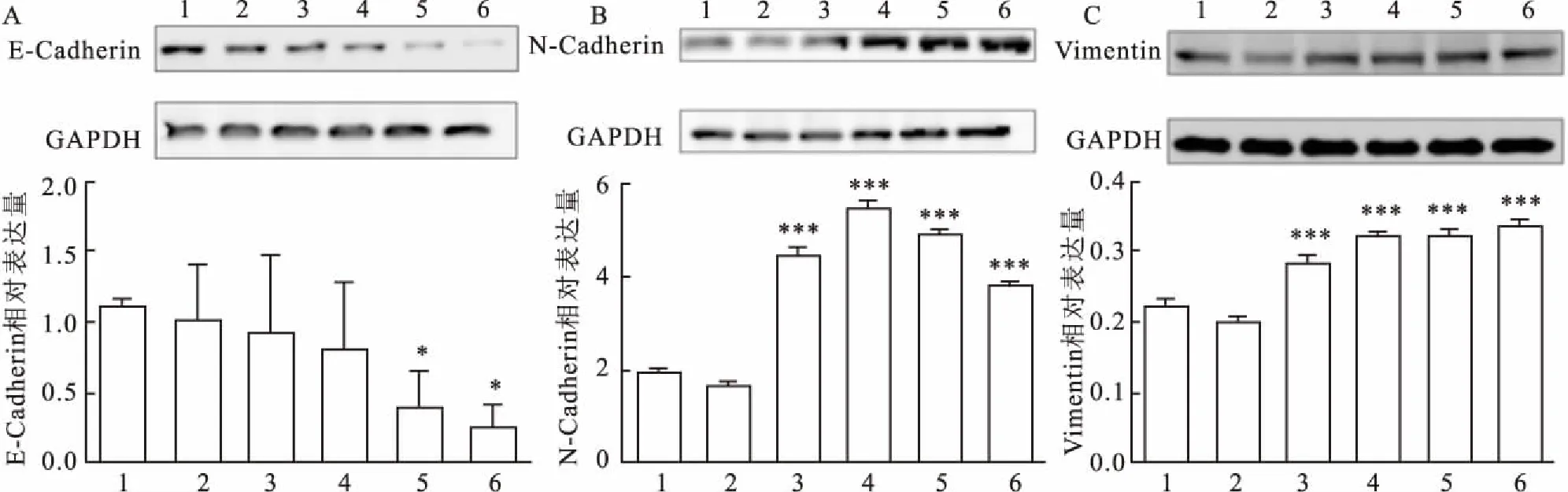
图2 Western blot法检测各组细胞中E-Cadherin、N-Cadherin、Vimentin的表达
1:空白对照组;2:IL-8 25 μg/L;3:IL-8 50 μg/L;4:IL-8 100 μg/L; 5:IL-8 200 μg/L;6:IL-8 300 μg/L ;与空白对照组比较:*P<0.05,***P<0.001
2.3MTT检测ATPS对GES-1细胞存活率的影响不同浓度ATPS处理GES-1细胞24 、48 h后,相同作用时间不同浓度之间用χ2检验,相同浓度不同作用时间组间行t检验。MTT结果提示:同一浓度下,随着药物作用时间增加,对细胞的抑制作用增强,差别有统计学意义;同一时间点,ATPS浓度的增加对GES-1细胞增殖的抑制作用的差异无统计学意义(P>0.05)。见图3。
2.4观察ATPS逆转GES-1细胞EMT后细胞形态的变化和空白对照组相比,模型组GES-1细胞形态明显由多边形向梭形转表,细胞排列疏松紊乱,细胞间粘附力降低,实验组和模型组比较,细胞形态向多边形转变,细胞之间出现片状粘连,生长状态好转,见图4。
2.5ATPS逆转GES-1细胞发生EMT相关蛋白表达变化Western blot结果显示实验组与模型组相比上皮细胞的E-Cadherin表达增加,标记间质细胞的N-cadherin、Vimentin表达减少,见图5。
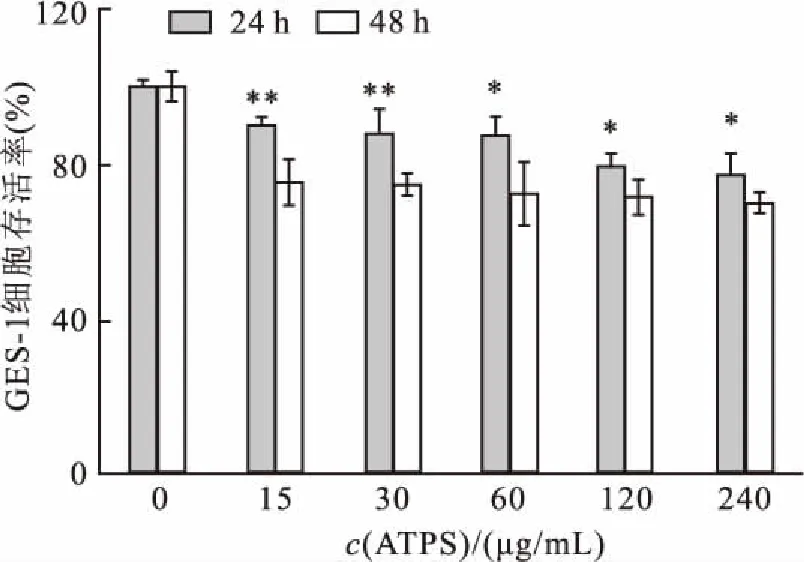
图3 不同浓度ATPS用于GES-1细胞的存活率
与处理48 h组比较:*P<0.05,**P<0.01
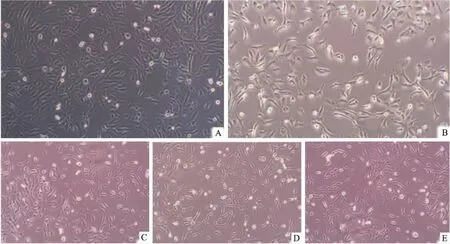
图4 不同浓度ATPS逆转IL-8诱导的GES-1细胞发生EMT的细胞形态变化 ×100
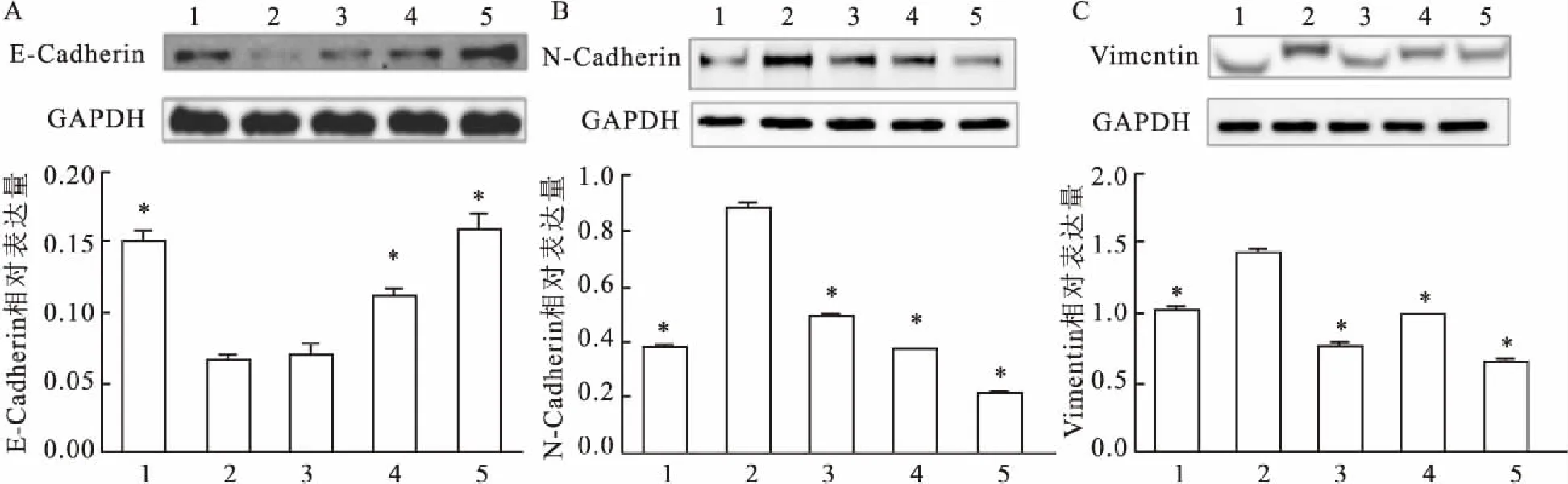
图5 Western blot法检测ATPS作用前后EMT相关蛋白变化
1:空白对照组;2:IL-8 200 μg/L;3:IL-8 200 μg/L +ATPS 30 mg/L;4:IL-8 200 μg/L +ATPS 60 mg/L;5: IL-8 200 μg/L +ATPS 120 mg/L;与IL-8 200 μg/L比较:*P<0.05
2.6ATPS逆转GES-1细胞发生EMT的机制探讨为进一步探讨可能机制,Western blot检测程序性细胞死亡因子PDCD4蛋白表达量,结果显示,模型组PDCD4表达明显减少,加入亮菌多糖后,PDCD4表达量增高,说明亮菌多糖逆转EMT可能与调节PDCD4表达量有关,见图6。
2.7细胞划痕实验结果细胞划痕实验显示IL-8使GES-1细胞侵袭扩散能力增强,而ATPS可以显著抑制GES-1细胞向周围扩散,抑制其侵袭和转移能力,见图7。
3 讨论
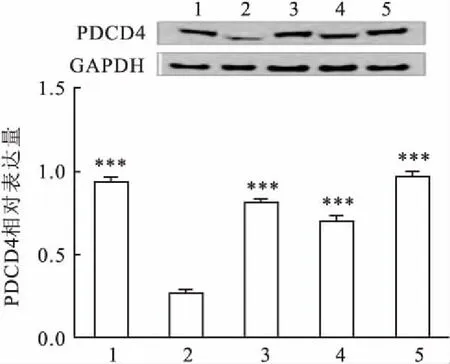
图6 Western blot法检测程序性细胞死亡因子PDCD4蛋白表达量
1:空白对照组;2:IL-8 200 μg/L;3:IL-8 200 μg/L +ATPS 30 mg/L;4:IL-8 200 μg/L +ATPS 60 mg/L;5:IL-8 200 μg/L +ATPS 120 mg/L;与IL-8 200 μg/L比较:***P<0.001

图7 细胞划痕实验不同时间各组细胞向周围扩散的程度
亮菌又叫假蜜环菌,是一种兼食用与药用价值于一体的名贵真菌,从2002年开始亮菌口服液应用于临床,主要用于慢性肝炎、迁延性肝炎、慢性胆管炎和胆囊炎以及慢性、浅表性、萎缩性胃炎及放疗、化疗引起的白细胞减少的辅助治疗,取得显著的疗效。亮菌可降低化疗后大鼠胃肠道组织5-HT的释放,可有效抑制顺铂化疗所诱发的胃节律性运动紊乱[4]。以亮菌发酵产物为主要成分的亮菌口服液临床上长期应用于慢性胃炎的治疗,取得显著的疗效,可以有效逆转慢性萎缩性胃炎,研究[5]表明,亮菌口服液对反流液造成的胃黏膜损失有保护作用,其机制可能与降低了胃黏膜COX-2含量相关,并且亮菌口服液可以通过修复受损胃黏膜的超微结构来起到保护作用[6]。大量临床案例及实验室研究表明慢性萎缩性胃炎属胃癌前病变,亮菌口服液可有效逆转胃癌前病变,降低胃癌的发生。其中亮菌口服液的主要有效成分ATPS起到重要的作用,亮菌多糖是由亮菌发酵产生的分子量145 000的杂多糖,由L-木糖、L-岩藻糖、D -半乳糖、D -葡萄糖和D -甘露糖5种单糖组成。研究[7]表明,亮菌多糖可通过提高小鼠肠黏膜组织中表皮生长因子EGF含量降低前列腺素2含量,从而对顺铂所致小鼠小肠黏膜损伤起到保护作用。亮菌多糖作为一种天然药物对人类的多种疾病疗效明显,多年以来,由于其分离纯化困难,分子结构不明确等各种因素限制了其发展和应用,本课题组与合肥诚志生物制药有限公司合作,提取了纯度较为可观的亮菌多糖,用于亮菌多糖在逆转胃癌前病变的过程作用的研究。
既往研究认为胃癌的发病与家族史、不良生活习惯、H.pylori感染、相关药物使用不当以及人体免疫功能下降等因素密切相关。且胃癌的发生是一个慢性演变的过程,胃黏膜在各种因素的刺激下,从正常胃黏膜-浅表性胃炎-慢性萎缩性胃炎-肠上皮化生-异性增生逐步发展成胃癌,因此如何将胃癌抑制在发展阶段,如何有效逆转胃癌前病变成为亟待解决且意义重大的事情。随着分子生物学的不断发展,研究者开始从分子水平上进一步探寻胃癌前病变的发病及癌变机制。研究表明,在胃癌前病变的形成过程中,DNA甲基化,微卫星不稳定性,端粒酶激活,EMT的发生等占有重要的地位[8],其中EMT与胃癌前病变的形成过程密切相关,在胃癌发生、发展过程中发挥关键性作用[2]。
本研究表明,亮菌多糖可逆转IL-8诱导的GES-1细胞EMT的发生,不仅从形态学上使其恢复上皮细胞的不规则多边形,其EMT相关蛋白E-Cadherin、N-cadherin、Vimentin表达均得到逆转,细胞划痕实验证明,亮菌多糖可有效抑制GES-1细胞的扩散侵袭能力,这可能与上皮细胞因子E-Cadherin表达增多有关,E-Cadherin使细胞间相互粘附聚集,不易向远处扩散,连续观察24 h,实验组较模型组细胞扩散程度明显减低,本研究表明亮菌多糖可通过逆转EMT对胃癌前病变起治疗作用,且可以抑制GES-1细胞的扩散侵袭,阻止癌变进程。PDCD4作为一种新近发现的抑癌基因在多种肿瘤的发生发展中发挥重要的作用,Yu et al[9]在胃癌细胞株GSC-7901和BGC-823中转染入过表达PDCD4的质粒,使PDCD4 mRNA及蛋白均高表达,然后检测EMT特异性标志物TWIST1、Vimentin、E-Cadherin,结果显示间质细胞标志物TWIST1、Vimentin蛋白及相应mRNA均降低,而上皮细胞标志物E-Cadherin明显升高,表明PDCD4可逆转EMT,本研究为了进一步研究亮菌多糖逆转EMT可能机制,Western blot检测PDCD4蛋白的表达变化,结果显示IL-8诱导的模型组较空白对照组明显降低,而亮菌多糖处理后PDCD4基本恢复到处理前水平,说明亮菌多糖逆转EMT可能与使PDCD4高表达有关,PDCD4的表达受各种因素的调节。DNA甲基化可明显抑制PDCD4的表达,Gao et al[10]使用DNA甲基转移酶抑制剂5-氮杂-2-脱氧胞苷阻断神经胶质瘤细胞中的甲基化,PDCD4基因表达明显提高。研究[11]表明,多种微小RNA(miRNA)与PDCD4的表达相关,其中miR-21与PDCD4表达呈明显负相关,Wen et al[12]在食管鳞状细胞癌细胞株(TE-13)中转染反义miR-21使其表达明显减少,结果显示与对照组相比转染染反义miR-21的TE-13细胞中PDCD4表达明显升高,且miR-21、miR-23a和miR-27a可协同抑制PDCD4、抗增殖基因2(BTG2)等抑癌基因的表达来促进胰腺导管腺癌进展,增强其侵袭力,可作为生存期较短的可靠标志[13-14]。miR-183过表达亦可使PDCD4蛋白表达降低,促进细胞增殖和转移,在食管癌细胞中可通过抑制磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(Akt)通路来降低miR-183表达,进而上调PDCD4[15]。本研究表明ATPS逆转EMT可能与调高PDCD4表达有关,但ATPS到底是通过何种机制上调PDCD4表达仍未清楚,下一步拟在基因水平进一步探讨相关机制及可能的信号表达通路。
[1] Hou J,Wang T,Xie Q,et al.N-Myc-interacting protein (NMI) negatively regulates epithelial-mesenchymal transition by inhibiting the acetylation of NF-κB/p65[J].Cancer Lett,2016,376(1):22-33.
[2] Huang L,Wu R L.Epithelial-mesenchymal transition in gastric cancer[J].Am J Transl Res,2015,7(11):2141-58.
[3] 杨丽红,叶选怡,凌庆枝,等.亮菌的临床应用与研究进展[J].北方药学,2013,10(3):66-7.
[4] 杜 静,李 平,孙 鑫,等.亮菌对顺铂化疗所诱发胃肠道反应的防治效果[J].中华肿瘤杂志,2011,33(8):579-82.
[5] 王冬青,丁西平,殷 实.实验性胆汁反流性胃炎大鼠胃黏膜改变及亮菌口服液的干预作用[J].世界华人消化杂志,2014,22(20):2875-80.
[6] 虞文永,丁西平,胡 闻,等.亮菌口服液对反流液致胃黏膜损伤模型大鼠胃黏膜SOD及IL-8的影响和超微结构的变化[J].安徽医科大学学报,2014,49(12):1751-4.
[7] 尤 伟,张 梅,李 平,等.亮菌多糖对顺铂致小鼠肠黏膜损伤的保护作用[J].中国新药杂志,2013,22(22):2683-7.
[8] Wu Y,Fan Y,Jiang Y,et al.Analysis of risk factors associated with precancerous lesion of gastric cancer in patients from eastern China: a comparative study[J].J Cancer Res Ther,2013,9(2):205-9.
[9] Yu H,Zeng J,Liang X,et al.Helicobacterpyloripromotes epithelial-mesenchymal transition in gastric cancer by downregulating programmed cell death protein 4 (PDCD4)[J].PLoS One,2014,9(8):e105306.
[10] Gao F,Wang X,Zhu F,et al.PDCD4 gene silencing in gliomas is associated with 5'CpG island methylation and unfavourable prognosis[J].J Cell Mol Med,2009,13(10):4257-67.
[11] 赵莉莉,张 梅,朱耀东.程序性细胞死亡因子4在肿瘤中的研究进展[J].国际肿瘤学杂志,2017,44(7):512-5.
[12] Wen S W,Zhang Y F,Li Y,et al.Characterization and effects of miR-21 expression in esophageal cancer[J].Genet Mol Res,2015,14(3):8810-8.
[13] Frampton A E,Castellano L,Colombo T,et al.Integrated molecular analysis to investigate the role of microRNAs in pancreatic tumour growth and progression[J].Lancet ,2015,385 Suppl 1:S37.
[14] Frampton A E,Castellano L,Colombo T,et al.MicroRNAs cooperatively inhibit a network of tumor suppressor genes to promote pancreatic tumor growth and progression[J].Gastroenterology,2014,146(1):268-77.e18.
[15] Ren L H,Chen W X,Li S,et al.MicroRNA-183 promotes proliferation and invasion in oesophageal squamous cell carcinoma by targeting programmed cell death 4[J].Br J Cancer,2014,111(10):2003-13.
