厚朴酚对大鼠实验性牙周炎骨吸收抑制作用的研究
2018-07-03李春年
李春年
牙周炎是以细菌为主的多种因素作用下,牙周组织发生的破坏性、感染性的疾病,主要的临床特征为牙齿松动移位,主要原因为牙槽骨的吸收;牙周病随年龄增长发病率不断升高,随着我国人口老龄化的加快和人们对疾病治疗的重视,我们口腔医生将面对越来越多的牙周疾病患者;我们在利用经典的牙周治疗手段给予患者积极治疗的同时,如何利用药物巩固牙周治疗的效果是我们要面对的主要问题。
厚朴是一味传统中药,有化湿导滞、行气平喘、化食消痰、驱风镇痛的功效。厚朴酚(magnolol)是厚朴的主要活性成分,具有抗菌、消炎、镇痛等多种药理作用,目前已知的在口腔中的主要作用为抑制变形链球菌等致龋菌,但在牙周治疗方面的作用少见报道;厚朴酚是否能通过抑制牙周炎致病菌、改变牙周局部的骨保护因子(osteoprotegerin,OPG)、破骨细胞核因子κB受体活化因子配体(ligand of receptor activator of NF-κB,RANKL)水平进而抑制牙槽骨的骨吸收,是本实验的研究目的。
1 材料与方法
1.1 实验动物、药物与试剂
SD雄性大鼠[河北医科大学实验动物中心提供,许可证号:SCXK(冀)2013-1-003(编号:1401042)];厚朴酚(西安开来生物工程公司,批号:K131022);大鼠骨保护因子抗体(OPG,武汉博士德公司);大鼠破骨细胞核因子κB受体活化因子配体(RANKL,武汉博士德公司)。
1.2 实验分组
选取3月龄雄性SD大鼠65只,排除麻醉意外死亡、饲养死亡、建模抽检等因素,最终入选50只随机分为5组,每组10只,正常组(A组)、实验性牙周炎组(B组)、实验性牙周炎局部治疗组(C组)、实验性牙周炎厚朴酚治疗组(D组)、实验性牙周炎局部+厚朴酚治疗组(E组)。
1.3 动物模型建立
B、C、D、E组大鼠10%水合氯醛腹腔麻醉,以0.2 mm的正畸钢丝穿过第一二磨牙间隙,结扎双侧上颌第一磨牙,建立实验性大鼠牙周炎模型。
1.4 动物模型鉴定
牙周结扎后1周,随机抽取大鼠检查钢丝是否牢固,检查牙周状况,可见结扎丝周围软垢堆积,牙龈红肿。牙周结扎后四周,随机抽取大鼠12只,检查牙周状况可见牙龈红肿、探诊易出血、可探及牙周袋,处死大鼠,取上颌骨制作牙周牙髓联合HE染色切片,可以观察到牙周袋形成,结合上皮向根方增殖。
1.5 分组处理
正常组(A组):正常饲养12周,不处理;实验性牙周炎组(B组):牙周结扎4周建立牙周炎模型,牙周炎模型成功后,继续原条件饲养8周;实验性牙周炎局部治疗组(C组):牙周结扎4周建立牙周炎模型,牙周炎模型成功后,麻醉下去除结扎丝,建立牙周炎治疗模型,清洁牙周局部,冲洗、上碘甘油,每周牙周局部治疗,观察8周;实验性牙周炎厚朴酚治疗组(D组):牙周结扎4周建立牙周炎模型,牙周炎模型成功后,按300 mg厚朴酚/kg体重大鼠灌胃8周;实验性牙周炎局部+厚朴酚治疗组(E组):在C组的基础上,同时按300 mg厚朴酚/kg体重大鼠灌胃8周。
1.6 牙周组织切片的制作及观察
大鼠10%水合氯醛腹腔麻醉下,股动脉放血处死,迅速取上颌骨,置于4%甲醇液固定标本48 h,流动水冲洗24 h,于10%EDTA脱钙液中8周,修整组织块,常规包埋,沿第一磨牙近远中方向,厚度5μm连续切片。常规HE染色切片,置于光镜下观察牙周组织变化。
1.7 牙周组织免疫组化检测及OPG、RANKL的测定
将牙周组织切片进行脱蜡,0.05%胰蛋白酶进行抗原修复,按照试剂步骤要求,分别加入过氧化物酶阻断剂、兔抗大鼠抗体、DAB显色,封片进行观察。
OPG、RANKL免疫组化染色为阳性的标准细胞浆染色黄色或棕黄色,根据染色程度分为:无染色为阴性(-),染色为浅棕黄色的为弱阳性(+),染色为中等棕黄色的为阳性(++),染色为深棕黄色的为强阳性(+++)。采用专业图像分析软件麦克奥迪数码图像分析软件进行牙周组织的阳性染色的半定量分析。在400倍镜下选择第一磨牙远中的牙周膜及牙槽骨进行观测,每个部位分层随机抽样选取5个区阳性区,测定吸光度值,根据结果计算该切片的平均吸光度值(A)。
1.8 统计学处理
使用SPSS软件进行统计分处理,各组数据先进行正态性检验,符合正态性分布进行处理,实验数据珋x±s表示,样本t检验分析处理,检验标准α=0.05、P<0.05有统计学意义。
2 结果
2.1 临床检查
A组牙龈无明显变化,牙龈色泽正常,牙周探诊正常;B组牙龈红肿,钢丝周围牙石、软垢堆积,探诊出血,可探及深牙周袋;C组牙龈已不红肿,探诊不出血,牙周袋探诊浅;D组牙龈已不红肿,探诊不出血,牙周袋可探及;E组牙龈已不红肿,探诊不出血,牙周袋探诊已达正常深度(表1)。

表1 牙周袋深度Tab 1 The depth of periodontal pocket
2.2 组织学检查
A组:结合上皮位于釉牙骨质界处,结缔组织无炎症细胞,牙周膜纤维排列规则,牙槽骨无吸收(图1A);B组:结合上皮向根方增殖,形成较深牙周袋,结缔组织内大量炎症细胞浸润,牙周膜纤维排列紊乱,血管扩张,牙槽骨吸收,可见骨吸收陷窝(图1B);C组:结合上皮向根方少量增殖,有较浅牙周袋,结缔组织内少量炎症细胞浸润,牙槽骨内成骨细胞多,破骨细胞少,有新生骨(图1C);D组:结合上皮向根方增殖,牙周袋变浅,结缔组织内少量炎症细胞浸润,牙槽骨内骨吸收停止,成骨细胞多,破骨细胞少(图1D);E组:结合上皮恢复至釉牙骨质界处,结缔组织未见炎症细胞,牙周膜纤维恢复排列规则,牙槽骨见大量新生骨,成骨细胞多(图1E)。

图1 组织病理学观察 (苏木精-伊红染色,×100)Fig 1 Histopathdogical examination (HE staning,×100)
2.3 免疫组化检测
2.3.1 牙周组织中OPG的表达 OPG在牙周组织中,主要表达于牙周膜成纤维细胞、骨细胞、成骨细胞、血管内皮细胞等,阳性染色为黄色或棕黄色颗粒,E组与其他各组比较明显升高(P<0.05),C、D组差别不大(P>0.05),C、D 组较 A、B 组明显升高(P <0.05)(表 2,图 2)。
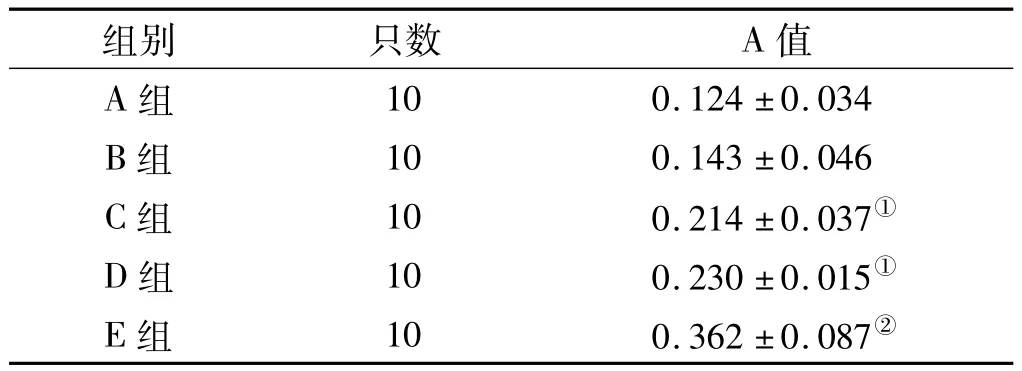
表2 各组牙周组织中的OPG平均吸光度值Tab 2 The average optical density value of OPGin periodontal tissue
2.3.2 牙周组织中RANKL的表达 RANKL在牙周组织中,主要表达于牙周膜成纤维细胞、骨细胞、破骨细胞、血管内皮细胞等,阳性染色为黄色或棕黄色颗粒,E组与B、C、D各组比较明显降低(P<0.05),C、D组差别不大(P>0.05),B组较其他各组明显升高(P <0.05,表 3,图 3)。
3 讨论
厚朴酚是我国传统中药厚朴的主要成分[1-2],属联苯酚类化合物,有抗菌抗炎的作用,对多种细菌都具有抑制作用。查阅文献可以发现,近些年关于厚朴酚在口腔的应用的研究主要集中在对变形链球菌等致龋菌的抑制,进而抑制龋病的发展的角度;关于厚朴酚对牙周炎的治疗作用未见报道。目前已有将厚朴酚加入牙膏中作为添加剂辅助抑制口腔中的致龋菌,能否通过本实验发现厚朴酚对牙周炎的抑制作用,进而在治疗牙周炎方面有新的思路和治疗药物是本研究的出发点。
牙周炎发生牙槽骨发生吸收破坏,随着对骨吸收机制的研究,OPG、RANKL对成骨、破骨时的密切相关细胞因子[3]。OPG 是由成骨细胞基质细胞产生[4],是唯一的破骨细胞负向调节因子[5];主要作用于破骨细胞分化末期,具有抑制破骨细胞前体细胞分化、促进破骨细胞凋亡、进而增加骨的密度的功能[6]。RANKL是骨吸收时的关键细胞因子,在体外能够诱导破骨细胞形成,在体内能够促进破骨细胞成熟[7]。在骨组织中,受到骨吸收因子刺激后,RANKL能够特异性识别破骨细胞前体细胞,刺激其分化成熟,进而促进破骨细胞产生,发挥骨吸收的作用[8]。成骨细胞可以表达OPG,OPG竞争性与RANKL结合,抑制了破骨细胞前体细胞的分化[9],缺乏OPG的实验动物会发生骨质疏松,体内加入OPG可以恢复骨密度[10]。OPG、RANKL在牙周组织中的表达受到多种免疫因素的影响,牙周致病菌牙龈卟啉菌可以通过激活淋巴细胞促进RANKL的表达[11],引起破骨细胞的分化成熟。牙周组织中的RANKL活性增高与炎症细胞T细胞、B细胞、巨噬细胞的刺激密切相关[12],提示减少牙槽骨吸收首先需要抑制RANKL[13],而抑制RANKL需要抑制牙周组织中炎症细胞和牙周致病菌;只有促进OPG的生成,减少RANKL的产生,才能减少牙槽骨的吸收。
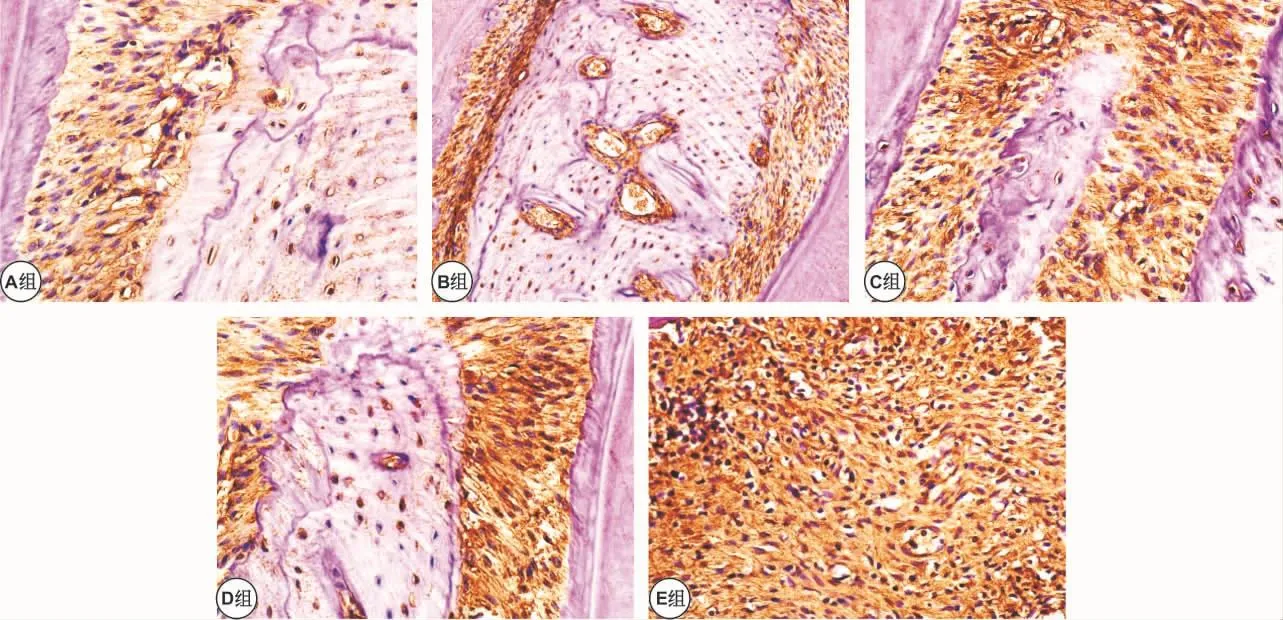
图2 牙周组织中OPG的表达情况 (免疫组化,×400)Fig 2 OPG expression in periodontal tissue (IHC,×400)
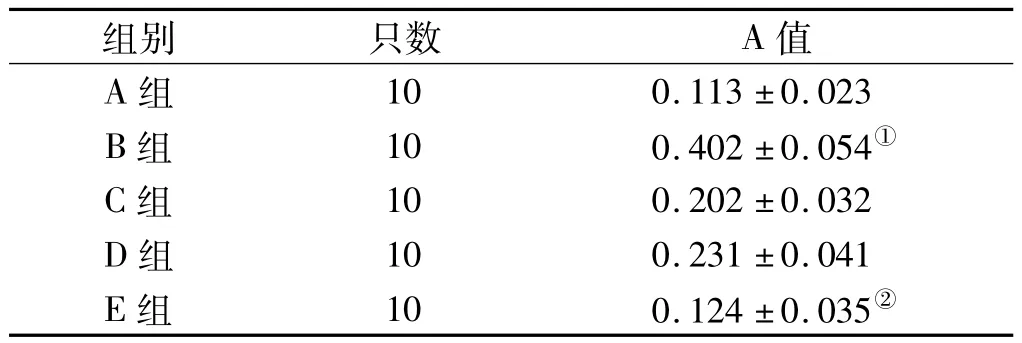
表3 各组牙周组织中的RANKL平均吸光度值Tab 3 The average optical density value of RANKL in periodontal tissue
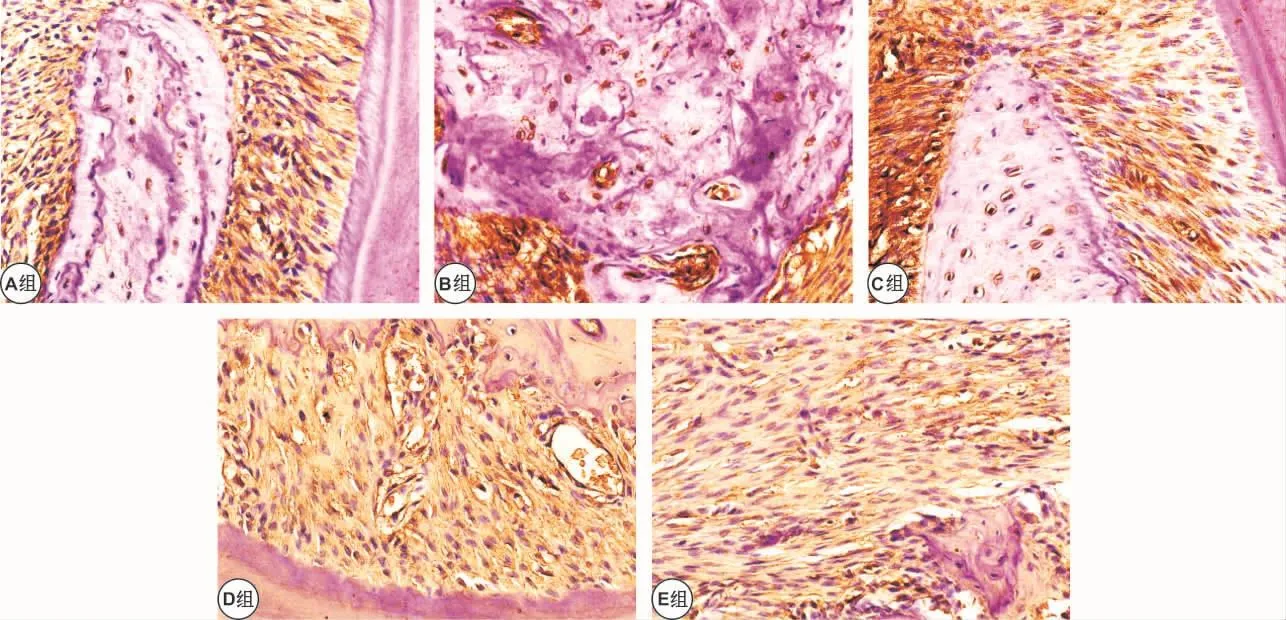
图3 牙周组织中RANKL的表达 (免疫组化,×400)Fig 3 RANKL expression in periodontal tissues (IHC,×400)
作者前期的实验研究也证实中药对实验性牙周炎的治疗能够升高牙周组织中的 OPG、降低RANKL[14],并且中药对牙周组织的保护作用效果也很显著[15]。
在本研究中发现厚朴酚作为抗菌抗炎的单组份中药提取物,作用稳定持久;可以在牙周刺激物存在的情况下,取得与牙周局部治疗相同的效果,明显的抑制牙周组织中的RANKL,升高OPG,促进牙周组织中的骨再生;在牙周局部治疗和厚朴酚共同作用下可以促进牙周完全恢复,可能与厚朴酚抗菌抗炎进而改善牙周局部的OPG、RANKL有很大关系。研究表明,厚朴酚对于牙周主要致病菌牙龈卟啉菌、中间普氏菌、伴放线杆菌菌具有抑制作用,提示对牙周炎具有潜力巨大的治疗作用[16]。
厚朴酚作为传统中药,不仅具有抑菌抗炎作用,而且抗菌谱广泛,不易产生抗药性,价值低廉的优点;在现今牙周病治疗越来越受到重视的情况下,厚朴酚必将以其能够抑制牙周致病菌,并能明显改善牙周骨代谢而受到重视并大量应用于口腔临床。
[1] 刘丽,彭枫.和厚朴酚的抗肿瘤作用研究进展[J].华西医学,2006,21(3):629-630.
[2] Watanabe K,Watanabe H,Goto Y,et al.Pharmacological properties of magnolol and honokiol extracted from Magnolia officinalis:Central depressant effects[J].Planta Med,1983,49(2):103-108.
[3] Boyce BF,Xing L.Osteoclasts,no longer osteoblast slaves[J].Nat Med,2006,12(12):1356-1358.
[4] Lin JM,Callon KE,Lin CQ,et al.Alteration of bone cell function by RANKL and OPG in different in vitro models[J].Eur J Clin Invest,2007,37(5):407 -415.
[5] Tanaka S,Nakamura K,Takahasi N,et al.Role of RANKL in physiological and pathological bone resorption and therapeutics targeting the RANKL-RANK signaling system[J].Immunol Rev,2005,208:30-49.
[6] Breitkreutz I,Raab MS,Vallet S,et al.Targeting MEK1/2 blocks osteoclast differentiation,function and cytokine secretion in multiple myeloma[J].Br J Haematol,2007,139(1):55-63.
[7] Loser K,Mehling A,Loeser S,et al.Epidermal RANKL controls regulatory T-cell numbers via activation of dendritic cells[J].Nat Med,2006,12(12):1372 -1379.
[8] Boyle WJ,Simonet WS,Lacey DL.Osteoclast differentiation and activation[J].Nature,2003,423(6937):337 -342.
[9] Wittrant Y,Theoleyre S,Couillaud S,et al.Relevance of an in vitro osteoclastogenesis system to study receptor activator of NF-kB ligand and osteoprotegerin biological activities[J].Exp Cell Res,2004,293(2):292-301.
[10] Bucay N,Sarosi I,Dunstan CR,et al.osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification[J].Genes Dev,1998,12(9):1260 -1268.
[11] Nishijima Y,Yamaguchi M,Kojima T,et al.Levels of RANKL and OPG in gingival crevicular fluid during orthodontic tooth movement and effect of compression force on releases from periodontal ligament cells in vitro[J].Orthod Craniofac Res,2006,9(2):63-70.
[12] Taubman MA,Valverde P,Han X,et al.Immune Response:The Key to Bone Resorption in Periodontal Disease[J].JPeriodontol,2005,76 Suppl 11S:2033 -2041.
[13] Kawai T,Matsuyama T,Hosokawa Y,et al.B and T lymphocytes are the primary sources of RANKL in the bone resorptive lesion of periodontal disease[J].Am J Pathol,2006,169(3):987-998.
[14] 李春年,李淑娟,杨冬茹,等.左归丸对实验性骨质疏松牙周炎大鼠牙周组织 OPG、RANKL表达的影响[J].实用口腔医学杂志,2011,27(2):270-273.
[15] 葛超,杨冬茹,武明轩,等.槲皮素对实验性牙周炎大鼠牙周组织的保护作用[J].实用口腔医学杂志,2015,31(5):619-622.
[16] Ho KY,Tsai CC,Chen CP,et al.Antimicrobial activity of honokiol and magnolol isolated from Magnolia officinalis[J].Phytother Res,2001,15(2):139 -141.
