等离子体对基托树脂表面白色念珠菌生物膜的杀灭研究
2018-07-03乔春元马小青钱梦珂谢海峰张怀勤
乔春元 马小青 钱梦珂 谢海峰 张怀勤
近年来随着乙肝、丙肝和艾滋病等的发病率增加,交叉感染已成为口腔医学中亟待解决的问题。患者口腔唾液和血液可污染医疗器械和一些不易消毒的物品,如修复体、印模和石膏模型[1],可摘义齿制作、调改、修理和重衬过程中,可造成交叉感染。义齿消毒常采用化学浸泡法,然而有报道化学消毒剂会导致义齿基托表面色泽改变、微孔形成和表面粗糙度增加[2-3],并且对生物膜的灭活不够充分[4]。低温等离子体具有杀菌快速,高效,无化学残留物,仅作用于材料表层对材料本体性能没有影响等特点。前期已采用等离子体技术对印模表面乙肝病毒、石膏模型表面金黄色葡萄球菌进行杀灭研究,均取得良好效果。本研究比较氩气、30%H2O2和50%H2O2等离子体对基托树脂表面白色念珠菌生物膜的杀灭效果。
1 材料与方法
1.1 主要材料与设备
固化型义齿基托树脂(日进中国昆山合资公司);国际标准菌株白色念珠菌(ATCC90028,南京便诊生物科技有限公司);50%过氧化氢(南京康克化工有限公司);30%过氧化氢(国药集团化学试剂有限公司);HPD-2400次大气压辉光放电低温等离子体表面处理机(南京苏曼电子有限公司);全自动菌落分析仪(Interscience,Scan200,法国);扫描电子显微镜(LEO,1530VP,德国)。
1.2 基托试件制备
按厂商说明使用基托树脂制成9mm×9mm×2 mm的PMMA试件68块,表面用600、800、1000目砂纸沿同一方向打磨,实验前试件先蒸馏水清洗,后超声振荡20min,并在紫外光下正反面分别照射20min灭菌备用。
1.3 生物膜培养
将复苏的白色念珠菌接种于沙堡培养基,于37℃恒温培养箱中培养。连续传2代后,取培养物于酵母浸出粉胨葡萄糖培养液(YeastExtractPeptoneDextrose,YPD)中增菌培养20h,将增菌产物离心(5000 r/min,4℃,5min),磷酸盐缓冲液(PBS)清洗2次。PBS重新悬浮,细菌比浊仪测定MCF(麦氏浊度单位)值为0.333,制备每毫升约含1.0×108菌落形成单位(CFU)的菌悬液。试件在PBS液中浸泡2h,放入24孔板,每孔加入2ml菌悬液,37℃培养2h,吸出菌悬液,每孔加入2mlYPD液,置于37℃培养箱内,每24h换液1次,培养48h后取出,用PBS漂洗2次。
1.4 等离子体处理
取64块试件,随机分为16组,每组4块试件(n=4)。氩气等离子体处理组共5组,用氩气等离子体分别处理60、120、180、240、300s;30%H2O2等离子体处理组共5组,用30%H2O2等离子体分别处理20、40、60、80、100s;50%H2O2等离子体处理组共5组,用50%H2O2等离子体分别处理20、40、60、80、100s。辉光放电时电压220V,电极距离55mm,电流1.5~1.8A。氩气等离子体处理时,标本放于处理基台上,用真空泵将气压调至1800~2000Pa后,通入氩气(流量500ml/min)至大气压后,用真空泵再次调压至1800~2000Pa,辉光放电。30%H2O2和50%H2O2等离子体处理时,将标本和1ml30%H2O2(或50%H2O2)溶液放于处理基台上,真空泵调压至1800~2000Pa,辉光放电。
1.5 洗脱计数
处理后的试件用2mlPBS液超声震荡清洗,取200μl菌液系列稀释、涂板,37℃培养48h,全自动菌落分析仪计数菌落形成单位。取每组存活菌量平均值,评估3种等离子体对试件表面生物膜的杀菌效果。参考欧洲标准EN1275-2005,处理后真菌数量减少>4log10CFU(即杀灭率>99.99%)视为有效。杀灭率计算方法为:(对照组存活菌量-实验组存活菌量)/对照组存活菌量×100%。
1.6 扫描电镜分析
剩余4块试件取1块为对照组,其余3块分别用氩气、30%H2O2和50%H2O2等离子体处理300s,戊二醛固定、乙醇梯度脱水、冷冻干燥、喷金,扫描电镜下观察细胞形态。
2 结果
2.1 3种等离子体杀菌效果
30%H2O2等离子体处理 100s(表 1)、50%H2O2等离子体处理80s(表2),对生物膜内白色念珠菌的杀灭(>99.99%)即可达到欧洲标准的要求;而氩气等离子体需处理300s(表3)才能有效杀灭白色念珠菌。
2.2 扫描电镜分析
对照组(图1A)生物膜内的白色念珠菌形态正常,菌体饱满,表面平滑。氩气等离子体处理300 s后(图1B),细胞膜完整性破坏,有孔洞。30%H2O2等离子体处理300 s后(图1C),细胞形态变化明显,胞膜皱缩,表面粗糙。50%H2O2等离子体处理300 s后(图1D),细胞中央凹陷,周边皱褶,孔洞增大,丧失正常形态。
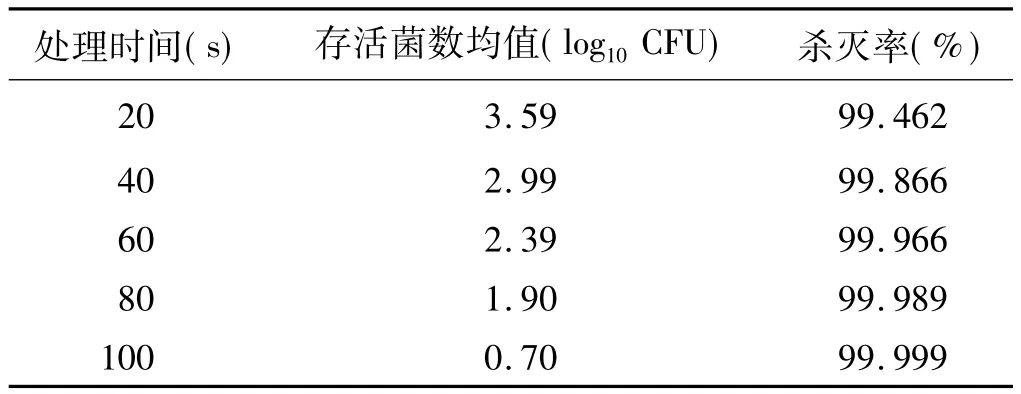
表1 30%H2O2等离子体对白色念珠菌生物膜的杀菌效果(n=4)Tab1 Thefungicidalefficacyof30%H2O2plasmaagainstCandidaalbicansbiofilms (n=4)

表2 50%H2O2等离子体对白色念珠菌生物膜的杀菌效果(n=4)Tab2 Thefungicidalefficacyof50%H2O2plasmaagainstCandidaalbicansbiofilms (n=4)
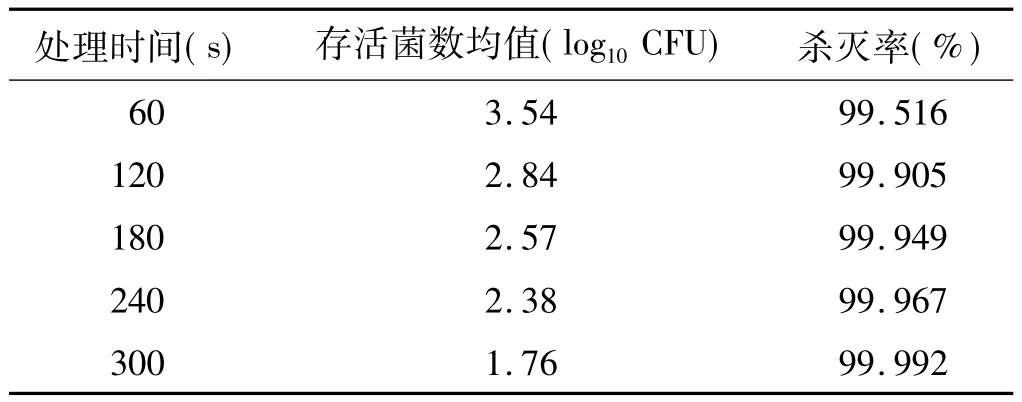
表3 氩气等离子体对白色念珠菌生物膜的杀菌效果 (n=4)Tab 3 The fungicidal efficacy of argon plasma against Candida albicans biofilms(n=4)
3 讨论

A:对照组;B:氩气等离子体处理300 s;C:30%H2O2等离子体处理300 s;D:50%H2O2等离子体处理300 s图1 白色念珠菌生物膜扫描电镜图像 (×20 000)A:Control group;B:After 300 s of argon plasma treatment;C:After 300 s of 30%H2O2 plasma treatment;D:After 300 s of 50%H2O2 plasma treatmentFig 1 The SEM images of Candida albicans biofilms on the resin (×20 000)
可摘义齿使用后表面会形成生物膜,75%佩戴义齿患者的生物膜内会定植白色念珠菌[4],近65%的患者罹患义齿性口炎,患者常诉有烧灼、味觉减退等不适感[5]。义齿性口炎影响患者的生活质量,经抗真菌治疗后仍有很高的复发率[6]。国内外许多学者正在研究白色念珠菌与白斑发生及癌变的关系。有研究报道[7]白色念珠菌可能通过抑制NOD1信号通路减少白斑组织中人β-防御素的表达。多数微生物并非以浮游状态方式生长,而是不同种属的微生物分泌胞外基质促进细菌黏附、聚集[8],共同定植于载体表面,形成高度组织化、系统化的生物膜(菌斑)。生物膜中的微生物对抗菌药物的耐药性可高达其在浮游状态时的1 000 倍以上[5]。Théraud 等[9]比较了 6 种化学方法对白色念珠菌生物膜的杀灭效果,发现只有0.5%氯己定溶液能有效杀灭生物膜内白色念珠菌。但氯己定有致基因突变、过敏反应及神经毒性等副作用[10]。次氯酸盐浸泡后,树脂的挠曲强度降低,承受咬合力时义齿易折裂[11]。本实验采用等离子体对树脂表面白色念珠菌生物膜进行灭活研究,取得了较为满意的结果。氩气等离子体处理300 s,白色念珠菌数量减少>4 log10CFU,杀灭率>99.99%,达到欧洲标准的消毒要求。Matthes等[4]采用氩气等离子体对基托表面的48 h白色念珠菌生物膜处理600 s后,对生物膜内白色念珠菌的杀灭为4.12 log10CFU,与本实验的结果一致。而30%H2O2等离子体处理100 s、50%H2O2等离子体处理80 s,即可达到消毒的标准。在等离子体杀菌过程中,等离子体产生的活性成分起主要作用,如臭氧、原子氧、超氧根、羟基自由基、一氧化氮、过氧化氢等[12]。氩气等离子体较30%H2O2和50%H2O2等离子体中的活性氧成分含量低,故相同处理时间,30%H2O2和50%H2O2等离子体的杀菌效果较氩气等离子体强,Hury等[13]亦有类似报道。与浮游菌相比,同种菌的生物膜需要等离子体处理更长时间才能灭活[14]。随着处理时间的延长,等离子体渗入并损伤具有复杂结构的胞外基质,产生类似酶降解的作用,从而破坏生物膜的三维结构[15]。生物膜丧失屏障作用后,生物膜内的细胞更易于杀灭[15]。等离子体中的活性氧成分蚀刻细胞壁,暴露并破坏细胞膜[12]。Kvam等[16]研究发现等离子体穿通细胞,导致细胞内容物释放,继而在细胞外发生DNA和蛋白质的损伤及细胞溶解。这与本研究SEM结果一致,图像显示等离子体处理后白色念珠菌细胞皱缩,出现孔洞、裂隙,完整性丧失。
本研究结果表明3种等离子体组均能有效杀灭树脂表面生物膜内的白色念珠菌。30%H2O2和50%H2O2等离子体组的杀菌效果优于氩气等离子体组。在以后的研究中将进一步采用等离子体对细菌、病毒等微生物进行实验室及临床杀灭研究。
[1] Klironomos T,Katsimpali A,Polyzois G,et al.The effect of microwave disinfection on denture base polymers,liners and teeth:A basic overview[J].Acta Stomatol Croat,2015,49(3):242-253.
[2] Jnanadev KR,Satish Babu CL,Shilpa Shetty S,et al.Disinfecting the acrylic resin plate using electrolyzed acid water and 2%glutaraldehyde:A comparative microbiological study[J].J Indian Prosthodont Soc,2011,11(1):36-44.
[3] 张燕萍,周培刚,吴凤鸣.义齿清洁剂对热固化型基托树脂物理及机械性能的影响[J].口腔医学,2014,34(12):924-927.
[4] Matthes R,Jablonowski L,Koban I,et al.In vitro treatment of Candida albicans biofilms on denture base material with volume dielectric barrier discharge plasma(VDBD)compared with common chemical antiseptics[J].Clin Oral Investig,2015,19(9):2319-2326.
[5] Pereira CA,Toledo BC,Santos CT,et al.Opportunistic microorganisms in individuals with lesions of denture stomatitis[J].Diagn Microbiol Infect Dis,2013,76(4):419 -424.
[6] Yano J,Yu A,Fidel PL Jr,et al.Transcription factors Efg1 and Bcr1 regulate biofilm formation and virulence during candida albicans-associated denture stomatitis[J].PLoS One,2016,11(7):e0159692.
[7] 钱雅洁,蒋文晖,王翔,等.白色念珠菌白斑中核苷酸结合寡聚化结构域1、核因子κB及人β-防御素的表达[J].中华口腔医学杂志,2014,49(8):464-469.
[8] 刘玉梅,徐静.舒五倍子抗口腔致病菌活性物质筛选及其体外抑菌效果评价[J].实用口腔医学杂志,2017,33(4):437-441.
[9] Théraud M,Bédouin Y,Guiguen C,et al.Efficacy of antiseptics and disinfectants on clinical and environmental yeast isolates in planktonic and biofilm conditions[J].J Med Microbiol,2004,53(Pt 10):1013 -1018.
[10] Maisch T,Shimizu T,Isbary G,et al.Contact-free inactivation of Candida albicans biofilms by cold atmospheric air plasma[J].Appl Environ Microbiol,2012,78(12):4242-4247.
[11] Sato S,Cavalcante MR,Orsi IA,et al.Assessment of flexural strength and color alteration of heat-polymerized acrylic resins after simulated use of denture cleansers[J].Braz Dent J,2005,16(2):124 -128.
[12] O'Connor N,Cahill O,Daniels S,et al.Cold atmospheric pressure plasma and decontamination.Can it contribute to preventing hospital-acquired infections? [J].J Hosp Infect,2014,88(2):59 -65.
[13] Hury S,Vidal DR,Desor F,et al.A parametric study of the destruction efficiency of Bacillus spores in low pressure oxygen-based plasmas[J].Lett Appl Microbiol,1998,26(6):417-421.
[14] Flynn PB,Higginbotham S,Alshraiedeh NH,et al.Bactericidal efficacy of atmospheric pressure non-thermal plasma(APNTP)against the ESKAPE pathogens[J].Int JAntimicrob Agents,2015,46(1):101-107.
[15] Mai-Prochnow A,Murphy AB,McLean KM,et al.Atmospheric pressure plasmas:Infection control and bacterial responses[J].Int JAntimicrob Agents,2014,43(6):508 -517.
[16] Kvam E,Davis B,Mondello F,et al.Nonthermal atmospheric plasma rapidly disinfects multidrug-resistant microbes by inducing cell surface damage[J].Antimicrob Agents Chemother,2012,56(4):2028 -2036.
