60 Coγ射线放射后大鼠腮腺细胞自噬初步观察
2018-07-03蓝铁瓒王代友曹阳杨亦萍卿海云曾祥林
蓝铁瓒 王代友 曹阳 杨亦萍 卿海云 曾祥林
巨自噬(macro-autophagy),简称自噬,是细胞通过双层膜状结构包绕受损细胞器或大分子并将之运送到溶酶体加以降解利用的现象[1]。自噬与某些细胞放射敏感性密切相关[2-3],与细胞凋亡相关。放射后唾液腺细胞大量凋亡[4-5]。对射线较为敏感的唾液腺的自噬情况以及自噬与凋亡关系,目前国内尚无文献报道。本研究观察放射前后大鼠腮腺细胞自噬、凋亡情况,检测分析 Bcl-2、Bax、Beclin1、LC3(microtubule associated protein 1 light chain3,LC3)表达,探讨放射对腮腺细胞自噬的影响及放射后腮腺自噬与凋亡的关系,为研究唾液腺放射损伤的防治提供实验依据和理论基础。
1 材料与方法
1.1 主要仪器及试剂
60Co远距离治疗机(GWXJ80型,中国核动力研究设计院设备制造厂),透射电镜(Hitachi公司,H-7650型,日本)。正置荧光相差显微镜成像分析系统(OLYMPUS公司,日本)。Bax、Beclin1及LC3兔抗鼠多克隆抗体(北京博奥森);Bcl-2兔抗鼠多克隆抗体、通用型SP检测试剂盒及DAB显色试剂盒(北京中杉金桥);粉剂型酸性抗原修复液(福州迈新)。
1.2 动物分组
健康雄性SD大鼠54只(广西医科大学实验动物中心),10周龄,体重210~250 g。大鼠适应性饲养7 d,随机分为9组,6只/组,对照组、6 Gy放射组及12 Gy放射组各3组。
1.3 腮腺放射损伤模型建立
头颈部照射方式参照王代友等[4]方法。10%水合氯醛麻醉后,大鼠仰卧位固定,锁骨之下用铅块遮挡,锁骨以上部位暴露于射线。60Coγ射线放射源固定,射野约3.5 cm×5 cm,源皮距80 cm,放射中心在皮下10 mm,单次传输所需放射剂量,吸收剂量率为0.554 7 Gy/min。
1.4 标本采集备制
放射后12、24和48 h,麻醉后处死不同放射剂量组各一组。随机取3只/组,60 s内,将右侧腮腺切成约1 mm3组织块,迅速放入预冷3%戊二醛溶液中固定,4℃保存3 h,按电镜常规要求处理,制超薄片,染色,观察。剩余腮腺在10%中性福尔马林中室温固定24 h,制备蜡块。
1.5 目标蛋白检测
蜡块连续切片,厚度4μm,烤片,脱蜡,复水,修复液(pH 6.0)高压修复。用免疫组织化学SABC法检测。一抗为Bcl-2、Bax、Beclin1、LC3兔抗鼠多克隆抗体(浓度分别1∶100、1∶100、1∶250、1∶250)。阳性对照标本为正常腮腺,以PBS液代替一抗行空白对照。其它步骤按试剂盒说明书进行。苏木精复染,胞浆胞膜出现棕黄色为目标蛋白阳性信号。正置荧光相差显微镜成像分析系统观察每张切片,在400倍光镜下病理图像分析系统(IPP软件)按机械抽样随机选取5个视野,分析目标蛋白表达,表达强弱以平均吸光度值(A)表示。
1.6 透射电镜观察细胞凋亡、自噬
透射电镜下,每标本随机选取、观察记录25个非坏死细胞中凋亡细胞、自噬阳性细胞与自噬并凋亡细胞数量,计算自噬率与凋亡率。评判标准:胞浆中至少含1个自噬体或自噬溶酶体细胞为自噬阳性细胞;细胞核缩小、变形、染色质边集、核周间隙增宽的细胞为凋亡细胞;1个细胞有自噬和凋亡特征时计为自噬阳性细胞、凋亡细胞。
1.7 统计学处理
数据用珋x±s表达,采用SPSS 16.0软件包进行分析,方差齐性检验后,如方差齐,用单因素方差分析,样本均数两两比较,用LSD-t检验,方差不齐,用非参数检验。P<0.05,差异有统计学意义。
2 结果
2.1 腮腺细胞自噬与凋亡
透射电镜下,对照组和放射组均见到自噬细胞和凋亡细胞。细胞中见到不同时期的自噬体及自噬溶酶体(图1A~C)。部分正常细胞及凋亡细胞存在自噬溶酶体或自噬体(图1D~F)。与相应时间对照组比较,各放射组细胞凋亡率显著升高,差异有统计学意义(P<0.05),各放射组自噬阳性细胞所占比例无明显变化,差异无统计学意义(P>0.05)(图1、表1)。
2.2 免疫组化染色结果
2.2.1 Bcl-2、Bax蛋白表达变化 与相应时间点对照组比较,放射后12、24和48 h,6 Gy放射组或12 Gy放射组Bcl-2蛋白表达均显著下降,差异有统计学意义(P=0.003 和 0.010,0.006 和 0.000,0.002 和0.001,<0.05)。
放射后12 h,与对照组比较,6 Gy放射组Bax蛋白表达差异无统计学意义(P>0.05),而12 Gy放射组Bax蛋白表达显著增加,差异有统计学意义(P=0.003,P <0.05)。放射后24和48 h,6 Gy放射组或12 Gy放射组Bax蛋白表达水平高于对照组,差异有统计学意义(P=0.000 和0.002,0.004 和0.000,<0.05)(表 2,图 2)。
2.2.2 Beclin1、LC3蛋白表达 放射后12、24及48 h,与对照组比较,各放射组的Beclin1及LC3白蛋表达差异均无统计学意义(P>0.05)(表3,图2)。
3 讨论
自噬消化降解细胞内大分子物质以及受损细胞器,在维护细胞内环境动态稳定方面起重要作用[6],在自噬过程中,Beclin l分子及LC3分子起到重要作用。Beclin l是候选肿瘤抑制基因,LC3参与自噬膜的形成,是自噬形成的标志性因子。Bcl-2是凋亡抑制蛋白、Bax蛋白是促凋亡蛋白,水平变化可反应细胞凋亡的变化。目前,用透射电镜观察自噬和凋亡形态特征是检验细胞自噬和凋亡的可靠手段。

A:对照组自噬体(Ap);B:放射组早期自噬溶酶体(AL);C:放射组晚期AL;D:正常腮腺细胞;E:对照组凋亡细胞;F:放射组凋亡细胞(×20 000);AL:自噬溶酶体;ER:内质网;M:线粒体;N:细胞核;A~C:×50 000;D~F:×20 000图1 透射电镜下观察腮腺细胞的自噬与凋亡A:Autophagosome(Ap)in control group;B:Early autolysosome(AL)in radiation group;C:Late AL in radiation group;D:Normal parotid gland cell;E:Apoptosis cell in control group;F:Apoptosis cell in radiation group;AL:Autophagolysosome;ER:Endoplasmic reticulum;M:Metochondria;N:Nucleus;A-C: ×50 000;D-F: ×20 000Fig 1 The autophagy and apoptosis of parotid gland cells observed by transmission electron microscope
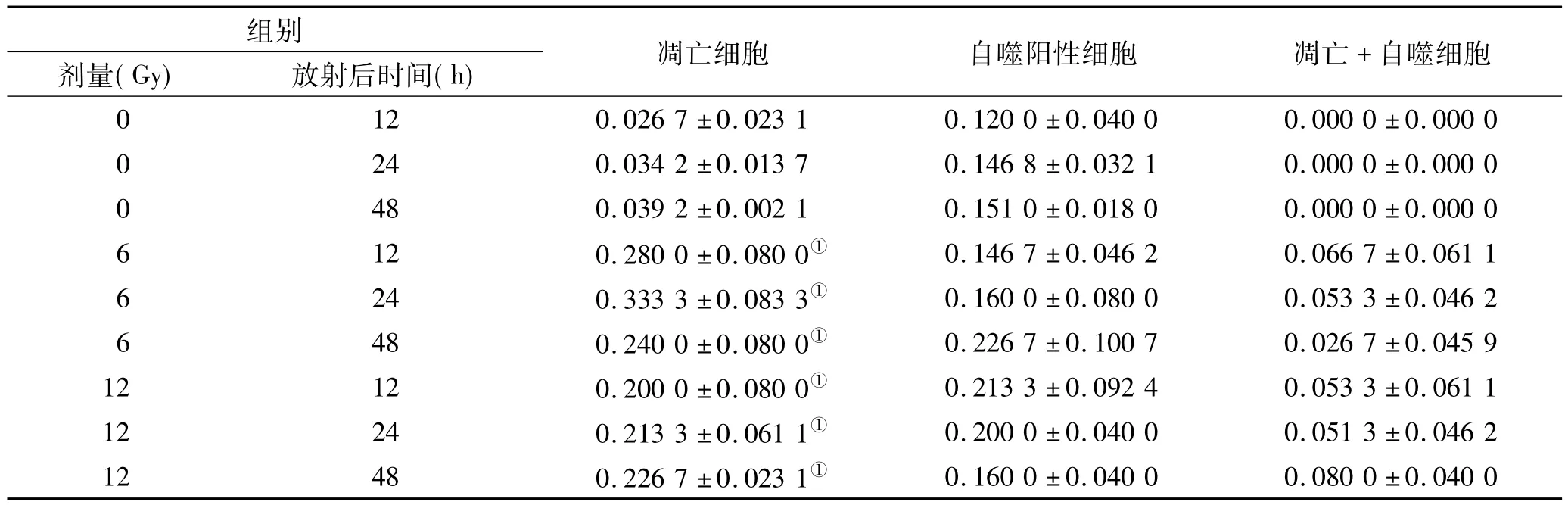
表1 各组腮腺组织中细胞凋亡率及自噬阳性细胞在细胞中所占比例(珋x±s,n=3)Tab 1 The apoptosis rate and percentage of autophagy positive cells in parotid gland tissues of the groups(珋x±s,n=3)
本研究发现,与对照组相比,各放射组腮腺中自噬阳性率、Beclin1、LC3的表达水平均无明显变化,结果与Maria等[7]报道单次5 Gy60Coγ射线放射后4~8 h腮腺自噬水平无明显变化的结果相似,说明放射后12~48 h,单次6 Gy或12 Gy60Coγ射线对腮腺细胞自噬的影响可能是有限的。有研究表明放射后心肌细胞[8]和骨髓间充质干细胞[9]自噬水平均调高,自噬缺陷的腮腺细胞放射敏感性增加[7]。我们推测,腮腺细胞特性可能是放射后自噬水平无明显变化的原因之一,放射后不能显著提高自噬水平可能是腮腺放射敏感机制之一。
Maria等[7]认为放射后腮腺自噬与凋亡可能 相互抑制。本研究结果示放射组细胞凋亡率显著增加,Bcl-2蛋白/Bax蛋白比值变小,差异有统计学意义,进一步证实放射诱导腮腺细胞凋亡,自噬无变化,结果不支持Maria等观点,可能与放射剂量不同有关。放射后腮腺细胞同时存在自噬与凋亡现象,提示两者之间可能存在某种关联;唾液腺细胞是先自噬后凋亡[10],
还是在损伤后先自噬以自救,当损伤超过自噬承受力时,自噬才诱导凋亡[11],这有待进一步研究。
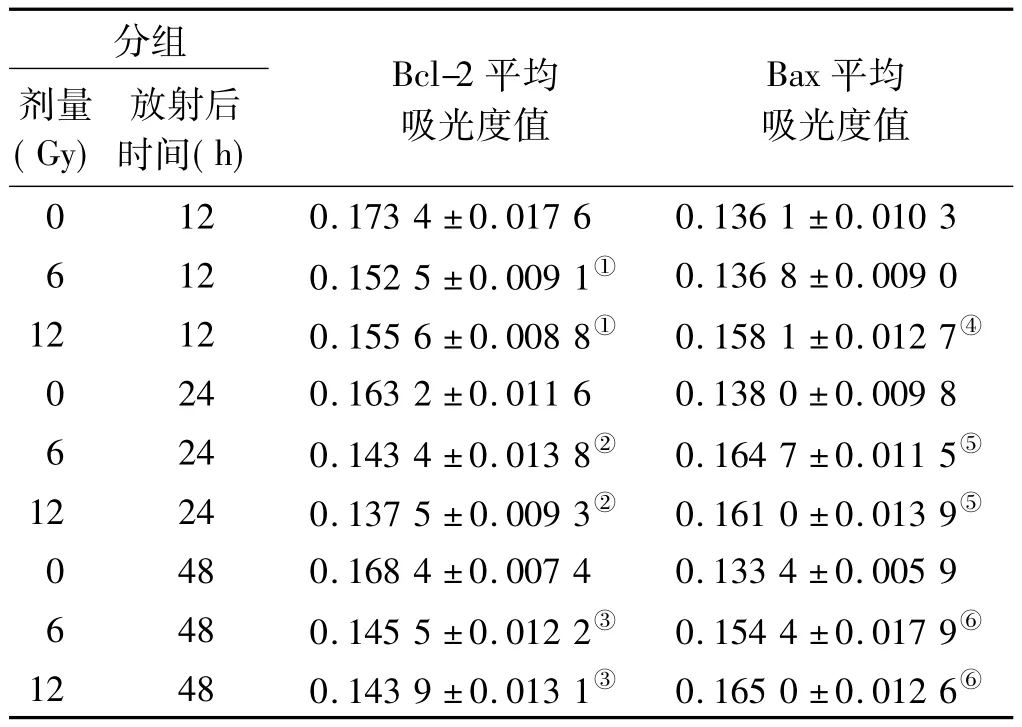
表2 Bcl-2、Bax蛋白在各组腮腺组织的表达(珋x±s,n=6)Tab 2 The expression of Bcl-2 and Bax protein in parotid gland tissues of the groups(珋x±s,n=6)
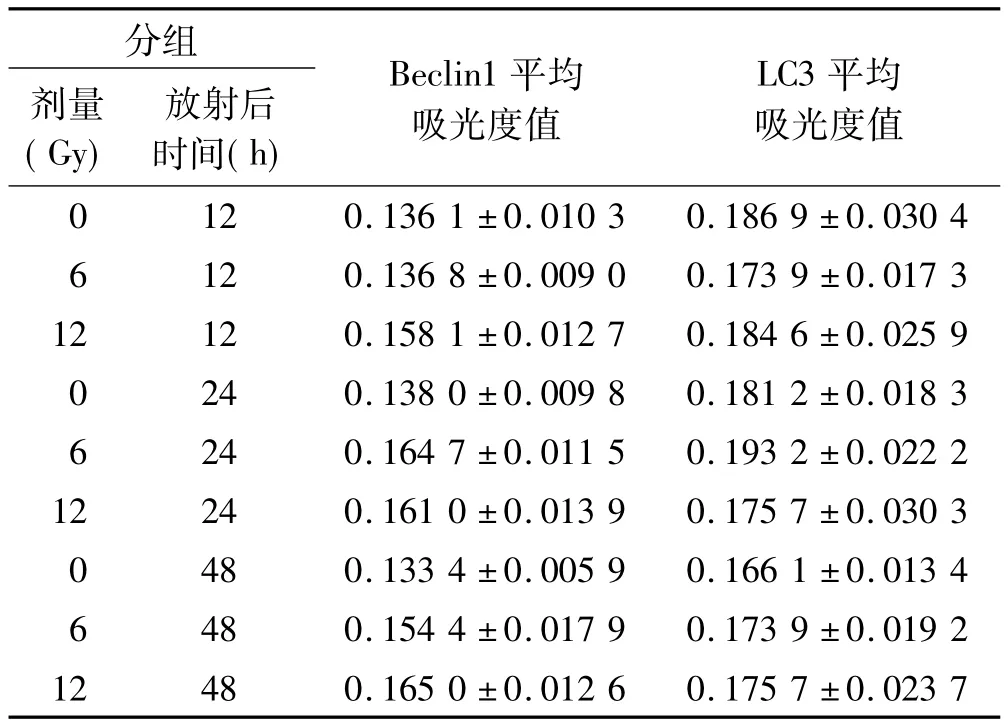
表3 Beclin1及LC3蛋白在各组腮腺组织中的表达(珋x±s,n=6)Tab 3 The expression of Beclin1 and LC3 protein in parotid gland tissues of the groups(珋x±s,n=6)

图2 Bcl-2、Bax、Beclin1、LC3蛋白在腮腺组织中的表达 (免疫组化SABC,×400)Fig 2 The expression of Bcl-2,Bax,Beclin1 and LC3 protein in parotid gland tissues (IHC SABC,×400)
综上述,60Coγ射线能激活腮腺细胞凋亡,但其对腮腺细胞自噬的影响可能是微弱的;放射后腮腺细胞的凋亡可能与自噬相关。
[1] 杨莉,肖凌,陈临溪.自噬与肺部疾病研究进展[J].生物化学与生物物理进展,2012,39(9):861-868.
[2] 卢小迪,朱小东,赵伟,等.自噬活性的降低增加人鼻咽癌CNE-2细胞的放射敏感性[J].中华放射医学与防护杂志,2015,35(6):423-427.
[3] Wang T,X SM,Kong D,et al.Effect of ionizing radiation on acinar morphogenesis of human prostatic epithelial cells under three-dimensional culture conditions[J].Neoplasma,2012,59(3):269-281.
[4] 谢诚,王代友,麦华明,等.60Coγ射线照射后大鼠涎腺中Mre11蛋白的表达与细胞凋亡的初步观察[J].实用口腔医学杂志,2014,30(1):15-18.
[5] Avila JL,Grundmann O,Burd R,et al.Radiation-induced salivary gland dysfunction results from p53-dependent apoptosis[J].Int J Radiat Oncol Biol Phys,2009,73(2):523-529.
[6] Li J,Ni M,Lee B,et al.The unfolded protein response regulator GRP78/BiP is required for endoplasmic reticulum integrity and stress-induced autophagy in mammalian cells[J].Cell Death Differ,2008,15(9):1460 -1471.
[7] Morgan-Bathke M,Hill GA,Harris ZI,et al.Autophagy correlates with maintenance of salivary gland function following radiation[J].Sci Rep,2014,4:5206.
[8] 陆克义,王洁,刘建中,等.自噬在X射线照射所致心肌线粒体损伤中的作用[J].国际放射医学核医学杂志,2013,37(6):333-336.
[9] 陈哲,刘洁,张斌.自噬与骨髓间充质干细胞放射损伤的关系[J].中国组织工程研究,2014,18(28):4474-4478.
[10] Berry DL,Baehrecke EH.Growth arrest and autophagy are required for salivary gland cell degradation in Drosophila[J].Cell,2007,131(6):1137 -1148.
[11] Lockshin RA,Zakeri Z.Apoptosis,autophagy,and more[J].Int J Biochem Cell Biol,2004,36(12):2405 -2419.
