TNF-α调控牙周膜干细胞骨向分化中LncRNA的差异表达
2018-07-03崔诗曼张清彬左志向曹威赖世翔
崔诗曼 张清彬 左志向 曹威 赖世翔
口腔颌骨缺损或吸收常伴有局部炎症反应,其中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是公认的炎症因子,亦是造成组织破坏的主要因素,影响骨组织的再生[1]。
近年来长链非编码RNA(long noncoding RNA,LncRNA)是一类转录本长度超过200 nt的RNA分子,虽不直接参与蛋白质的编码,但可通过表观遗传、转录、转录后等途径调控靶基因的表达[2]。已有研究分析骨髓间充质干细胞、牙周膜干细胞(periodontal ligament stem cells,PDLSCs)骨向分化中LncRNA的表达特征[3-4],证实 LncRNA 与细胞分化机体发育有着密切联系。而TNF-α作用下PDLSCs骨向分化中 LncRNA的表达特征,目前还未见报道。本研究旨在探究TNF-α对PDLSCs骨向分化的作用,并应用高通量测序技术分析其中LncRNA的差异表达情况。
1 资料与方法
1.1 样本来源
由本医院颌面外科门诊提供所需样本,选取18~25岁、即将正畸治疗的患者所拔除的健康第一或第二前磨牙。本研究已获得医院伦理委员会的批准(编号:000120150701)及患者的知情同意。
1.2 主要试剂
DMEM培养基、Ⅰ型胶原酶、青霉素、链霉素(Gibco,美国);胎牛血清(FBS,Hyclone,美国);β-甘油磷酸钠、地塞米松、维生素 C、TNF-α、茜素红(Sigma,美国);PBS溶液、兔抗鼠二抗(上海博士德公司);TRIzol Reagent(Invitrogen,美国);抗人碱性磷酸酶(alkaline phosphatase,ALP)抗体、抗人骨钙蛋白(osteocalcin,OCN)抗体、抗人核心结合蛋白因子2(runt-related transcription factor2,Runx2) 抗体(Abcam,美国);高通量测序由深圳恒创基因科技有限公司测试完成。
1.3 实验方法
1.3.1 细胞培养及分组 将拔除的新鲜牙齿样本迅速置于培养液(90%DMEM、10%FBS、100 μg/ml青霉素、100μg/ml链霉素)内浸泡。于超净台内用PBS冲洗,刀片刮取根中下1/3的牙周膜,剪碎,1 000 r/min离心5 min。弃上清,加入Ⅰ型胶原酶(3 mg/ml)1 ml,吹打混匀,37℃水浴45 min。取出后加入培养液终止消化,1 000 r/min离心5 min,弃上清,1 ml培养液重悬细胞,接种于细胞培养瓶内。置于 CO2(5%)、37℃的细胞孵育箱,2~3 d更换培养液。传至第3代作为实验用细胞。实验组:加入TNF-α(10 ng/ml)[5]的成骨诱导液培养;对照组:单纯成骨诱导液培养,包括DMEM(90%)、FBS(10%)、青霉素(100 μg/ml)、链霉素(100 μg/ml)、β-甘油磷酸钠(10 mmol/L)、地塞米松(100 nmol/L)及维生素 C(50 μg/ml)。培养至不同时间点获取细胞,进行后续检测。
1.3.2 茜素红染色及定量 连续培养21 d,吸除细胞培养液,用PBS洗涤3次,4%多聚甲醛固定20 min,吸去多聚甲醛,PBS洗涤3次,加入茜素红染液,室温静置30 min,吸去茜素红,PBS洗涤2次,显微镜下观察并拍照。吸去PBS,加入氯化十六烷吡啶1 ml,室温静置15 min,于540 nm波长下对溶液的吸光值(A)进行测定。
1.3.3 RT-PCR检测 连续培养7 d,采用酚 -氯仿提取法提取2组细胞总RNA,根据Prime ScriptTMRTPCR Kit”及“SYBR Premix Ex TaqTM试剂盒说明完成RNA的反转录和荧光实时定量PCR测定。检测相关成骨基因ALP、OCN及RUNX2,内参为GAPDH,引物由上海捷锐生物工程公司设计合成(表1)。
1.3.4 Western blot检测 连续培养7 d,提取2组细胞总蛋白,经Bradford蛋白浓度试剂盒及BAC蛋白定量试剂盒对样品进行检测定量,按1∶3的比例加入蛋白上样缓冲液,煮沸5 min,置于-80℃冰箱待用。制备SDS-PAGE胶,依照蛋白分子量大小进行电泳、转膜。5%脱脂奶粉室温封闭2 h后,洗膜后加入一抗,4℃静置过夜。次日洗膜后加入二抗,4℃静置2 h,洗膜后于暗室中将ECL荧光剂滴置转移膜上,最后进行显影定影及曝光。

表1 RT-PCR引物序列Tab 1 Primer sequences for RT-PCR
1.3.5 高通量测序分析 连续培养7 d,选择酚-氯仿提取法提取细胞总RNA,质检合格后样本送检。利用Illumina PE150进行转录组范围内第二代高通量测序。根据 LncRNA的测序结果,经折叠倍率(Fold change,FC)筛选出差异表达显著的LncRNA,参数选择标准为P<0.05,FC≥2或≤-2。
1.4 统计学处理
各实验均设置3个生物学重复,并平行处理3次。数据的分析使用SPSS 17.0,采用单因素方差分析,不同组别间的差异性分析使用t检验,当P<0.05时表示结果具有统计学差异。
2 结果
2.1 细胞的分离培养
PDLSCs培养5~10 d后,显微镜下见细胞沿着组织块4周生长,呈放射状、贴壁生长;培养7~14 d后细胞开始融合;传代之后呈快速增长趋势,3~5 d后融合度大概为90%。细胞鉴定已于前期实验完成[6]。
2.2 TNF-α对PDLSCs骨向分化作用的影响
分别对2组细胞进行茜素红染色,并于倒置显微镜下观察,见细胞基质内有矿化结节形成,呈红褐色、散在分布。与对照组相比,实验组生成的结节面积更小、颜色更浅(图1A、1B)。这与矿化结节的定量检测结果一致(图1C)。在后续RT-PCR和Western blot实验中,实验组相关成骨基因和蛋白的表达均明显低于对照组(图2~3)。说明TNF-α抑制PDLSCs的骨向分化能力。
2.3 TNF-α调控PDLSCs骨向分化中差异表达的Ln-cRNA
测序结果的散点图显示两组样本差异基因的分布情况,红色点为有统计学意义的差异表达的LncRNA(图4)。其中差异表达显著上调的有57条,显著下调的有26条。分别选取差异表达显著上调的2条LncRNA(LINC00473、GK-AS1)和显著下调的2条LncRNA(SGOL1-AS1、ZNF385D-AS1)(表 3),利用RT-PCR技术进行验证,验证结果具有较高的一致性 (图5)。结合miRcode注释分析发现,LINC00473位于人类第6条染色体上,为miR-23a等microRNA的前体。

A:对照组(×40);B:实验组(×40);C:茜素红染色定量图1 茜素红染色及定量A:Control group(×40);B:Test group(×40);C:Quantification analysisFig 1 Alizarin red staining and quantification analysis

图2 相关成骨基因的表达Fig 2 Expression of osteogenesis relatied gene(RT-PCR)
3 讨论
自PDLSCs发现以来,国内外很多研究已在体内或体外证实了其骨向分化能力,能促进骨组织再生[7-8],而干细胞的骨向分化能力很可能受炎症环境影响[9]。TNF-α在牙周炎骨丧失过程中扮演着重要作用,并参与启动炎症反应[10]。在本研究中,我们通过茜素红染色、RT-PCR、Western blot检测,证实了TNF-α对PDLSCs骨向分化能力的抑制作用。
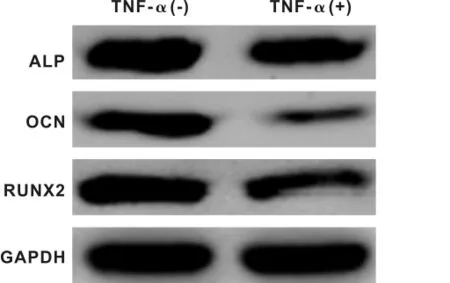
图3 相关成骨蛋白的表达Fig 3 Expression of osteogenesis relatied protein(Western blot)
PDLSCs骨向分化作用受多种因素调控,包括生长因子(TGF-β 等)、转录因子(Runx2、NF-κB 等)、细胞因子 (IL-6、IFN-γ 等)、机制通路 (Wnt/β-catenin、BMP)以及 microRNA 等[11-13]。以上机制的研究已有显著进展,而近期有学者发现,lncRNA与人类的成骨进程密切相关[14]。Jia 等[4]证明 LncRNA-ANCR 是PDLSCs增殖和骨向分化的关键调控因子。
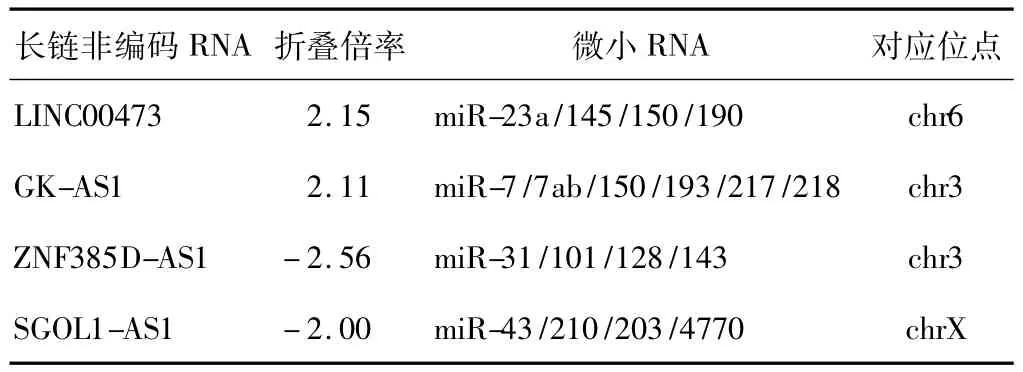
表2 差异表达显著的LncRNATab 2 Differential expression of LncRNA
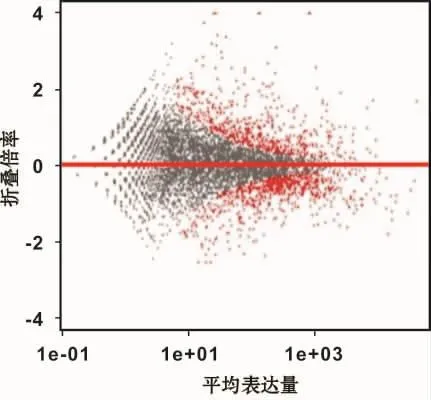
图4 差异表达的LncRNA分布情况Fig 4 Distribution of differentially expressed LncRNA
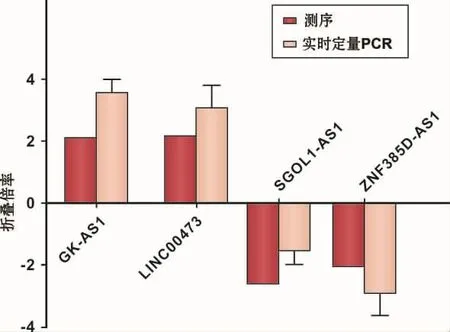
图5 RT-PCR验证测序结果中LncRNA表达趋势Fig 5 Comparison between sequencing data and RT-PCR result for LncRNA
本研究采用高通量测序技术,探索TNF-α调控PDLSCs骨向分化过程中lncRNA的差异表达。结果显示,差异表达显著上调的lncRNA有57条,显著下调的有 26条,说明 lncRNA与 TNF-α作用下的PDLSCs骨向分化具有相关关系。同时通过miRode注释分析发现,差异表达显著上调的lncRNA:LINC00473为miR-23a等microRNA的前体。有研究发现miR-23a可通过抑制 Runx2的翻译来抑制成骨分化[15]。而lncRNA可作为microRNA的前体进一步加工处理成为成熟的microRNA,进而抑制基因的表达[16]。基于以上背景,我们提出假设,LINC00473可能参与抑制PDLSCs的骨向分化,但具体机制尚需进一步验证。本研究为探索TNF-α调控PDLSCs骨向分化的机制研究提供新的靶点和方向,为颌面部骨组织缺损修复提供理论依据。
[1] Cochran DL,Jones A,Heijl L,et al.Periodontal regeneration with a combination of enamel matrix proteins and autogenous bone grafting[J].J Periodontol,2003,74(9):1269-1281.
[2] Wang KC,Chang HY.Molecular mechanisms of long noncoding RNAs[J].Mol Cell,2011,43(6):904 -914.
[3] Dong R,Du J,Wang L,et al.Comparison of long noncoding RNA and mRNA expression profiles in mesenchymal stem cells derived from human periodontal ligament and bone marrow[J].Biomed Res Int,2014,2014:317853.
[4] Jia Q,Jiang W,Ni L,et al.Down-regulated non-coding RNA(lncRNA-ANCR)promotes osteogenic differentiation of periodontal ligament stem cells[J].Arch Oral Biol,2015,60(2):234-241.
[5] Kong X,Liu Y,Ye R,et al.GSK3β is a checkpoint for TNF-α-mediated impaired osteogenic differentiation of mesenchymal stem cells in inflammatory microenvironments[J].Biochim Biophys Acta,2013,1830(11):5119-5129.
[6] Um S,Choi JR,Lee JH,et al.Effect of leptin on differentiation of human dental stem cells[J].Oral Dis,2011,17(7):662-669.
[7] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament.[J].Lancet,2004,364(9429):149 -155.
[8] 张清彬,张兆强,曹威,等.Sirtuin 1促进牙周膜干细胞骨向分化的实验研究[J].口腔医学研究,2014,30(6):531-533.
[9] Pluchino S,Muzio L,Imitola J,et al.Persistent inflammation alters the function of the endogenous brain stem cell compartment[J].Brain,2008,131(Pt 10):2564 - 2578.
[10] Zhang S,Barros SP,Moretti AJ,et al.Epigenetic regulation of TNFA expression in periodontal disease[J].J Periodontol,2013,84(11):1606 -1616.
[11] Hakki SS,Foster BL,Nagatomo KJ,et al.Bone morphogenetic protein-7 enhances cementoblast function in vitro[J].JPeriodontol,2010,81(11):1663 -1674.
[12] 陈小燕,丁寅,金岩,等.TNF-α通过NF-κB信号通路对人牙周膜干细胞成骨分化调控作用的研究[J].口腔生物医学,2015,6(3):124-128.
[13] 杨倩娟,刘文佳,陆群,等.miR-20a对人炎症牙周膜干细胞成骨分化能力的影响[J].实用口腔医学杂志,2016,32(2):186-189.
[14] Bergmann JH,Li J,Eckersley-Maslin MA,et al.Regulation of the ESC transcriptome by nuclear long noncoding RNAs[J].Genome Res,2015,25(9):1336 -1346.
[15] Zhang Y,Xie RL,Croce CM,et al.A program of microRNAs controls osteogenic lineage progression by targeting transcription factor Runx2[J].Proc Natl Acad Sci USA,2011,108(24):9863-9868.
[16] Kim VN.MicroRNA biogenesis:Coordinated cropping and dicing[J].Nat Rev Mol Cell Biol,2005,6(5):376 -385.
