含对硝基苯丙氨酸HER2疫苗的免疫原性研究
2018-07-02姚文兵高向东
何 羽,田 浤,戴 鑫,姚文兵,高向东
(中国药科大学生命科学与技术学院,江苏省生物药物成药性研究重点实验室,南京 210009)
人表皮生长因子受体2(HER2)是一个185 kD的跨膜受体,具有酪氨酸激酶活性。HER2受体通过与其他受体结合,激活具有酪氨酸激酶功能的胞内区,诱导信号通路活化,促进细胞增殖[1]。目前已在多种肿瘤中发现了HER2受体的过表达,其中约有20%~30%的乳腺癌患者是HER2高表达[2]。HER2高表达的肿瘤患者具有生存时间短、预后较差、容易复发转移等特点,因此HER2是一个理想的抗肿瘤靶点。
目前,以HER2为靶点的相关药物主要包括单克隆抗体曲妥珠单抗和小分子抑制剂拉帕替尼[3-4]。但是这两类药物均存在一定的耐药性以及细胞毒性[5-7]。与被动免疫应答相比,主动免疫应答可以产生多克隆抗体,解决单克隆抗体的耐药性问题,并且可以产生免疫记忆效应,防止肿瘤细胞的转移与复发[8]。因此,HER2肿瘤疫苗是一种有潜力的治疗药物。目前已有多种以HER2为靶点的DNA、多肽、蛋白疫苗进入临床研究,然而大部分HER2肿瘤疫苗终止于临床Ⅱ期研究,原因是HER2是自身蛋白,免疫原性低,难以诱导机体产生有效的免疫应答[9-10]。因此,如何提高HER2肿瘤抗原的免疫原性,打破机体免疫耐受是HER2肿瘤疫苗设计开发的关键。
近年来研究发现,利用遗传密码扩充技术,在蛋白质上连接具有免疫原性的非天然氨基酸可以有效打破自身蛋白的免疫耐受,产生有效的免疫应答[11]。研究表明,将对硝基苯丙氨酸(pNO2Phe)引入到B淋巴细胞刺激因子(BAFF)和小鼠补体因子C5a中,能诱导机体产生与内源性BAFF和C5a蛋白发生交叉反应的IgG抗体[12-14]。
本研究采用HER2胞外23~146片段作为原型分子Wt HER2,利用遗传密码扩充技术在其5、26、79位上定点引入pNO2Phe获得改构体(pNO2Phe5HER2、pNO2Phe26HER2、pNO2Phe79HER2),通过检测抗体滴度筛选出免疫原性最高的pNO2Phe79HER2作为疫苗候选分子,对pNO2Phe79HER2疫苗诱导产生的抗体进行分析,证明了pNO2Phe79HER2诱导产生的抗体能够识别完整HER2的胞外区序列,并可以通过抗体依赖的细胞介导的细胞毒性作用(ADCC)裂解HER2+B16F10肿瘤细胞,提示pNO2Phe79HER2可以作为靶向HER2的肿瘤疫苗候选分子。
1 材 料
1.1 菌种和质粒
E.coliBL21(DE3)、pET28a(+) Vector均为中国药科大学江苏省生物药物成药性研究重点实验室保存。
1.2 试 剂
Prime STAR DNA聚合酶、T4 DNA连接酶、限制性内切酶NcoI、Hind III、BspH I(大连TaKaRa公司);pNO2Phe(上海吉尔生化有限公司);HRP标记山羊抗小鼠IgG(北京中山金桥生物科技有限公司);3,3′,5,5′-四甲基联苯胺(TMB,北京索莱宝科技有限公司);FITC标记山羊抗小鼠IgG(美国Sigma公司);小鼠脾脏淋巴细胞分离液(天津灏洋生物制品科技有限责任公司);BCA试剂盒、乳酸脱氢酶细胞毒性检测试剂盒(上海碧云天生物技术有限公司)。
1.3 动 物
清洁级C57BL/6雌性小鼠(6~8周龄)购自扬州大学比较医学中心,合格证号:SCXK(苏)2017-0007。所有动物实验均符合动物伦理委员会标准。
1.4 细胞株
人乳腺癌细胞株SKBR-3(上海斯信生物科技有限公司);HER2高表达的小鼠黑色素瘤细胞株HER2+B16F10(中国药科大学江苏省生物药物成药性研究重点实验室保存)。
2 方 法
2.1 Wt HER2基因的克隆
根据HER2( GenBank 登录号:M11730.1)序列,选择胞外23~146序列片段,运用DNAWORK在线软件,参考大肠埃希菌的密码子偏爱性,设计10条引物(见表1)。
用Prime STAR DNA聚合酶进行overlapping PCR,进行两轮PCR扩增。第一轮PCR以P2~P9为引物,PCR反应条件为:94 ℃,5 min;94 ℃,30 s,58 ℃,30 s,72 ℃,45 s,30个循环;72 ℃延伸8 min,回收并纯化PCR产物Ⅰ。第二轮PCR以P1、P10为引物,以PCR产物Ⅰ为模板,PCR反应条件为:94 ℃,5 min;94 ℃,30 s,58 ℃,30 s,72 ℃,45 s,30个循环;72 ℃延伸8 min,回收并纯化PCR产物Ⅱ。
2.2 突变体HER2基因的克隆
在Wt HER2抗原片段DNA序列的基础上,将第5位Thr密码子ACC、第26位His密码子CAT和第79位Ile密码子ATT分别置换为琥珀密码子TAG,利用DNAWORK在线软件对突变体HER2进行引物设计(见表2)。
Table1 Primer sequences of Wt HER2 designed by DNAWORK software

PrimerSequences(5'➝3')P1ATCATGACCCAGGTGTGCACCGGCP2AGATGGGTTTCCGGTGACGCCGGCAGACG-TAACTTCAT-ATCGGTGCCGGTGCACACCTP3TCACCGGAAACCCATCTGGATATGCT-GCGTCATCTGTA-TCAGGGCTGCCAAGTGGTGCP4AAGCTCGCATTGGTCGGCAGATACGT-CAGTTCCAGATT-GCCCTGCACCACTTGGCAGCP5CGACCAATGCGAGCTTGAGCTTTTTGCAG-GATATTCAG-GAAGTGCAAGGCTATGTGCTP6AGCGCTGTAACGGCACCTGACGCACTT-GATTGTGTGCA-ATCAGCACATAGCCTTGCACP7TGCCGTTACAGCGCTTGCGTATTGTGCGT-GGCACCCAG-CTGTTTGAAGATAACTATGCP8ATTATTCAGCGGATCGCCATTATCCAG-CACCGCCAGCG-CATAGTTATCTTCAAACAGCP9GGCGATCCGCTGAATAATACCACCCCTGT-GACCGGCG-CTAGTCCAGGCGGCCTGCGTGP10AAGCTTAGTGGTGGTGGTGGTGGTGGGT-CAGGCTACG-CAGTTGCAGTTCACGCAGGCCGCC
Table2 Primer sequences of mutated HER2 designed by DNAWORK software

PrimerSequences(5'➝3')P1'ATCATGACCCAGGTGTGCTAGGGCP3'TCACCGGAAACCCATCTGGATATGCTGCGTTAGCTGTA-TCAGGGCTGCCAAGTGGTGCP7'TGCCGTTACAGCGCTTGCGTTAGGTGCGTGGCAC-CCAG-CTGTTTGAAGATAACTATGC
对突变体HER2基因进行克隆,PCR扩增条件同“2.1”项。所得到的DNA序列即为突变体pNO2Phe5HER2、pNO2Phe26HER2和pNO2Phe79HER2的DNA序列。
2.3 Wt HER2表达菌株的构建
选择限制性内切酶BspH I和Hind III对PCR产物Ⅱ进行双酶切,选择限制性内切酶NcoI和Hind III对表达载体pET28a进行双酶切,胶回收酶切产物,T4 DNA连接酶16 ℃过夜连接。连接产物转化至E.coliBL21(DE3)大肠埃希菌感受态细胞,并涂布在含卡那霉素(Kan)抗性的LB平板培养基上,37 ℃培养箱内过夜培养。次日挑取阳性单克隆,接种在含Kan抗性的液体LB培养基中,37 ℃,220 r/min过夜培养。测序。
2.4 HER2突变体表达菌株的构建
同“2.3”项对突变体进行构建。将测序正确的质粒pET28a-5TAG-HER2,pET28a-26TAG-HER2和pET28a-79TAG-HER2质粒分别与识别pNO2Phe的tRNA和氨酰tRNA合成酶的质粒pAC-4tRNA-pNO2PheRS共转化E.coliBL21(DE3)大肠埃希菌感受态细胞,并涂布在含Kan和氯霉素(Cm)抗性的LB平板培养基上,37 ℃培养箱内过夜培养。次日挑取阳性单克隆,接种在含Kan和Cm抗性的液体LB培养基中,37 ℃,220 r/min过夜培养。测序。
2.5 Wt HER2的表达纯化
将测序正确的Wt HER2菌200 μL接种于含Kan抗性的LB培养基20 mL中,37 ℃过夜培养。按照1∶100的体积比将过夜菌加入到含Kan抗性的LB培养基中,37 ℃,220 r/min进行培养3 h后(A600=0.6),加入终浓度为1 mmol/L的IPTG,37 ℃,220 r/min培养5 h后,8 000 r/min离心5 min,收集菌体。超声破碎菌体,离心取沉淀,对包涵体进行清洗以去除杂蛋白和核酸等杂质。用8 mol/L尿素对包涵体进行变性,4 ℃过夜搅拌,变性液过Ni亲和色谱柱,500 mmol/L的咪唑缓冲液洗脱目的蛋白,然后按体积比1∶4加入pH 9.0的复性缓冲液,用pH 8.0 Tris-HCl缓冲液透析,超滤浓缩,BCA法测蛋白浓度。
2.6 突变体HER2的表达纯化
将pNO2Phe5HER2、pNO2Phe26HER2和pNO2Phe79HER2菌200 μL分别接种于含Kan和Cm抗性的LB培养基20 mL中,37 ℃过夜培养。按照1∶100的体积比将过夜菌加入到含Kan和Cm抗性的液体M9培养基中,37 ℃,220 r/min进行培养7.5 h后,加入终浓度为0.1 mol/L的对硝基苯丙氨酸,培养0.5 h后,加入终浓度为1 mmol/L的IPTG,37 ℃,220 r/min培养18 h后,8 000 r/min离心5 min,收集菌体。同“2.5”项对突变型HER2进行纯化。BCA法测蛋白浓度。
2.7 ELISA法检测小鼠血清中抗Wt HER2抗体滴度
将6~8周雌性C57BL/6小鼠分成PBS、Wt HER2、pNO2Phe5HER2、pNO2Phe26HER2、pNO2Phe79HER2组。皮下免疫小鼠,每次每只给药20 μg,每周免疫1次,共免疫2周,最后一次免疫1周后,眼眶取血分离血清。ELISA法检测小鼠抗血清中针对Wt HER2的抗血清滴度。在酶标条中每孔加入终浓度为5 μg/mL的HER2蛋白100 μL,37 ℃孵育2 h;PBST清洗5次;然后每孔加入 5% BSA封闭液200 μL,4 ℃孵育过夜;PBST清洗5次;每孔加入稀释后的小鼠血清100 μL;37 ℃孵育2 h;PBST清洗6次;每孔加入稀释后的HRP标记山羊抗小鼠IgG 100 μL,37 ℃孵育45 min;PBST清洗6次;每孔加入TMB底物反应液100 μL,37 ℃避光孵育15 min;每孔加入2 mol/L的H2SO450 μL终止反应;检测A450处孔内样品的吸收度。
2.8 流式细胞法检测小鼠抗血清识别SKBR-3能力
将6~8周雌性C57BL/6小鼠分成PBS、Wt HER2、pNO2Phe79HER2组,免疫过程及取血同“2.7”项。取稀释后的血清200 μL与1×106个SKBR-3细胞混合,4 ℃孵育2 h。设置空白对照组:不含抗血清的PBS与SKBR-3细胞孵育。PBS清洗3次。将稀释后的FITC标记山羊抗小鼠IgG与清洗后的SKBR-3细胞进行孵育,4 ℃孵育1 h。PBS清洗3次。用PBS缓冲液200 μL对细胞进行重悬,运用流式细胞仪检测细胞表面的平均荧光强度。
2.9 乳酸脱氢酶释放法检测小鼠抗血清介导的ADCC效应
小鼠分组、免疫同“2.8”项。最后一次免疫1周后,处死小鼠,利用小鼠脾脏淋巴细胞分离液分离淋巴细胞作为效应细胞,HER2+B16F10作为靶细胞。
固定靶细胞每孔5×103个,按照不同的效应细胞与靶细胞比(E∶T=50∶1、25∶1、12.5∶1)加入淋巴细胞,并在每孔加入小鼠血清4 μL。并设置空白组:淋巴细胞+小鼠抗血清,对照组:淋巴细胞+HER2+B16F10细胞。所有样品孔内都是200 μL体系。将样品置于37 ℃,5% CO2培养箱内培养4 h后。按照乳酸脱氢酶细胞毒性检测试剂盒说明书对样品进行检测。通过检测乳酸脱氢酶的释放,比较不同浓度的效应细胞与靶细胞比例下靶细胞裂解程度。
将靶细胞固定每孔5×103个,固定效应细胞与靶细胞比(E∶T=50∶1),加入效应细胞,小鼠血清抗体稀释50、200、800倍。并设置空白组:淋巴细胞+小鼠抗血清,对照组:淋巴细胞+HER2+B16F10细胞。所有样品孔内都是200 μL体系。将样品置于37 ℃,5% CO2培养箱内培养4 h后。按照乳酸脱氢酶细胞毒性检测试剂盒说明书对样品进行检测。检测乳酸脱氢酶的释放,比较不同抗体稀释度下靶细胞裂解程度。
2.10 统计学分析
采用GraphPad Prism 6软件进行统计学分析。采用Student′st-test进行数据显著性比较,P<0.05为显著性差异,具有统计学意义。
3 结 果
3.1 Wt HER2及突变体的构建
根据GenBank(登录号:M11730.1)获得目的基因片段Wt HER2,同时在第5、26、79位分别突变成TAG获得pET28a-5TAG-HER2,pET28a-26TAG-HER2和pET28a-79TAG-HER2,利用在线网站DNAWORK设计10条长引物,两轮overlapping PCR后结果如图1所示。在403 bp出现与理论大小相当的目的基因。

Figure1 Agarose electrophoresis analysis of overlapping PCR products
M:Marker;1:Wt HER2;2:pNO2Phe5HER2;3:pNO2Phe26HER2;4:pNO2Phe79HER2
3.2 Wt HER2及突变体的表达
对Wt HER2菌株进行表达,取IPTG诱导前后全菌进行电泳,如图2-A所示。相比于诱导前的菌体,IPTG诱导后在14 .7 kD附近出现了条带,与目的蛋白相对分子质量大小相符。对突变体HER2菌株进行表达,SDS-PAGE鉴定目的蛋白的表达,结果如图2-B~D所示。未加IPTG而加pNO2Phe时在14.7 kD处没有目的蛋白的表达,加IPTG而未加pNO2Phe时在14.7 kD处也没有目的蛋白的表达,而同时加入IPTG和pNO2Phe时在14.7 kD处有明显目的蛋白的表达,证明非天然氨基酸成功定点引入到突变位点。
3.3 Wt HER2及突变体的纯化
对Wt HER2及突变体进行纯化,将最终目的蛋白进行SDS-PAGE鉴定,结果如图3。通过Gel-pro analyzer软件分析,本研究得到了电泳纯大于95%的Wt HER2及突变体蛋白,并通过MOLDI-TOF检测pNO2Phe所在肽段的相对分子质量(图略),结果如表3所示。检测的结果与理论相对分子质量结果一致,证明pNO2Phe的成功定点引入到Wt HER2。
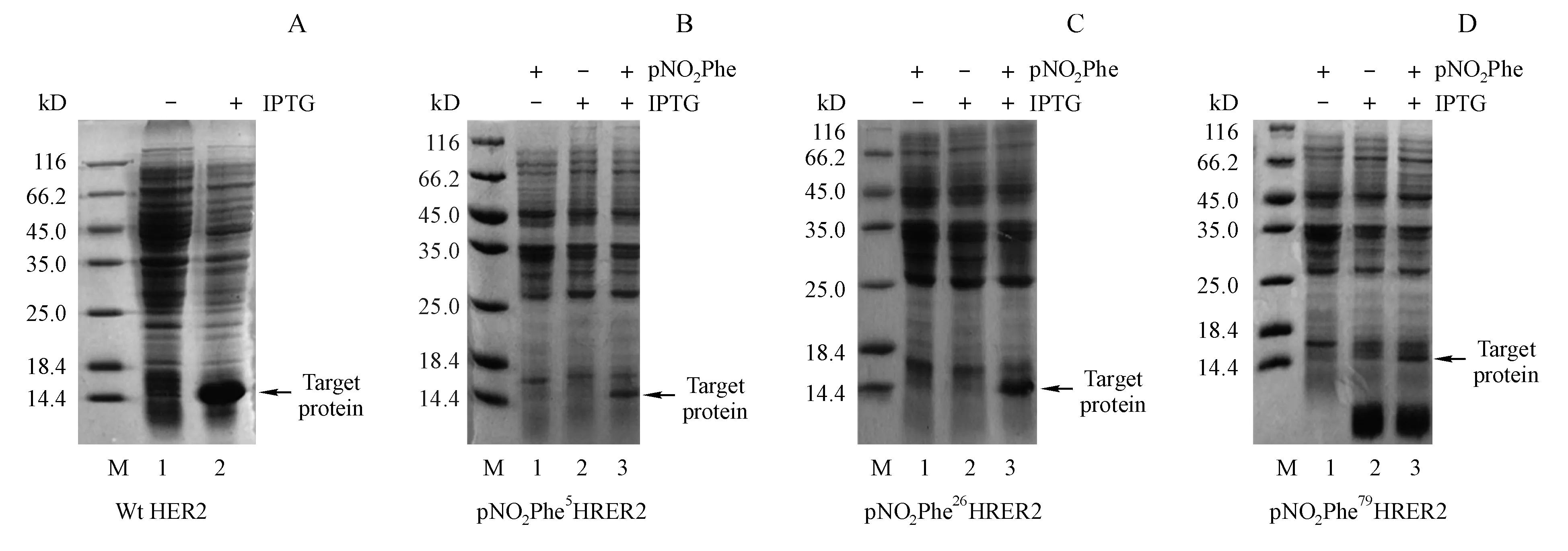
Figure2 SDS-PAGE analysis of the expression Wt HER2 and mutated HER2
A:Wt HER2.M:Marker,1:Before IPTG induction,2:After IPTG induction;B-D:mutated HER2.M:Marker,1:Before IPTG induction and after pNO2Phe addition,2:After IPTG induction and before pNO2Phe addition,3:After IPTG induction and pNO2Phe addition
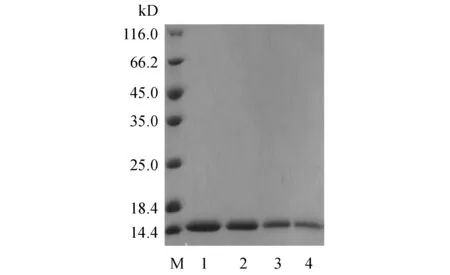
Figure3 SDS-PAGE analysis of the purified Wt HER2 and mutated HER2
M:Marker;1:Wt HER2;2:pNO2Phe5HER2;3:pNO2Phe26HER2;4:pNO2Phe79HER2
3.4 Wt HER2突变体的免疫原性
将PBS、Wt HER2、pNO2Phe5HER2、pNO2Phe26HER2、pNO2Phe79HER2免疫小鼠,第3周免疫效果如图4所示。小鼠体内产生了能够识别Wt HER2的抗体。与Wt HER2免疫组相比,pNO2Phe79HER2组产生了最高的抗Wt HER2片段的抗体滴度,且在血清稀释100倍和1 000倍的情况下,pNO2Phe79HER2组与Wt HER2组都存在显著性差异(P<0.001)。但pNO2Phe5HER2组和pNO2Phe26HER2组与Wt HER2组相比差异不显著。上述结果提示,在C57BL/6小鼠体内,pNO2Phe79HER2具有较强的免疫原性,后续选择pNO2Phe79HER2做进一步研究。
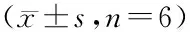
***P<0.001vsWt HER2 group
Table3 MALDI-TOF analysis of the peptides containing mutation sites from the mutated proteins digested by trypsin

ProteinPeptideMr (observed)Mr (calculated)pNO2Phe5HER2TQVCpNO2PheGTDMK1 174.611 174.46pNO2Phe26HER2MLRpNO2PheLYQGCQVVQGNLE2 042.952 042.92pNO2Phe79HER2pNO2PheVR466.26466.19
3.5 pNO2Phe79HER2免疫小鼠的抗体特异性
为了探究pNO2Phe79HER2免疫小鼠产生的抗体是否能够与HER2过表达的肿瘤细胞结合,本研究通过流式细胞术检测pNO2Phe79HER2免疫抗血清能否识别HER2高表达的SKBR-3细胞,结果如图5所示。pNO2Phe79HER2组细胞表面的平均荧光强度与Wt HER2抗原片段组相比存在显著性差异(P<0.001),证明pNO2Phe79HER2突变体免疫小鼠产生的抗血清能有效识别细胞膜上完整HER2受体。
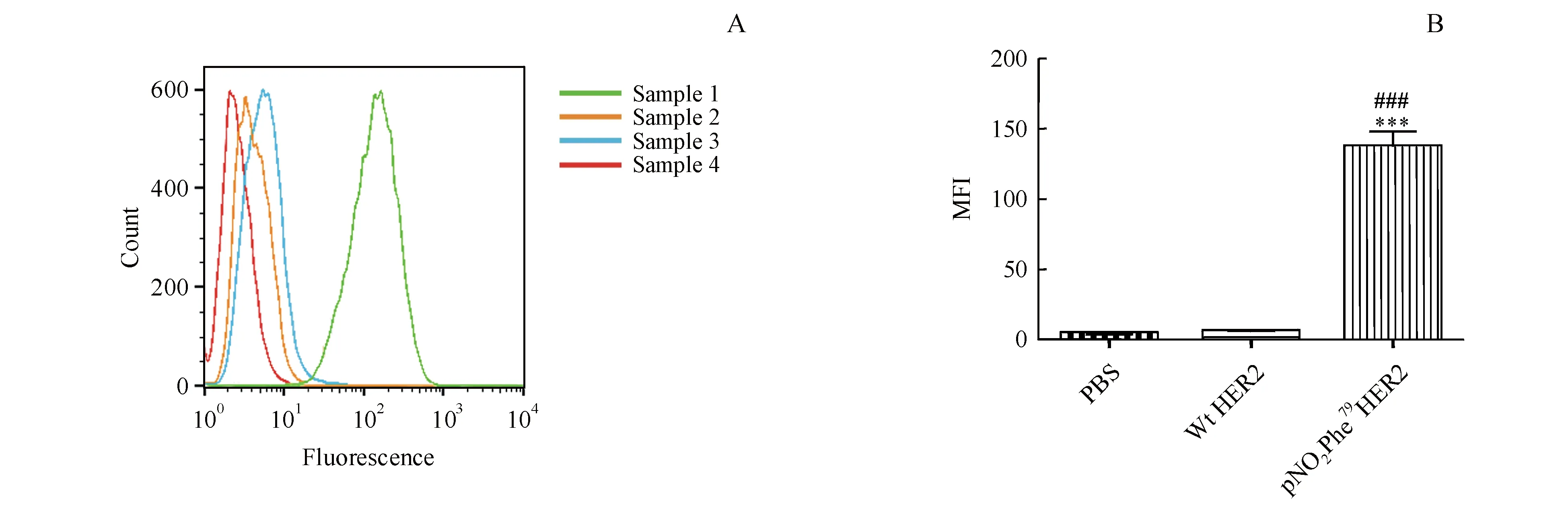
A:Visual comparison of flow cytometry results.Sample 1:Antisera from mice immunized with pNO2Phe79HER2,Sample 2:Antisera from mice immunized with PBS,Sample 3:Antisera from mice immunized with Wt HER2,Sample 4:PBS;B:Statistics of mean fluorescence intensity (MFI)
***P<0.001vsPBS group;###P<0.001vsWt HER2 group
3.6 pNO2Phe79HER2免疫小鼠的药效分析
为了检测pNO2Phe79HER2肿瘤疫苗免疫小鼠血清能否通过ADCC效应裂解HER2阳性肿瘤细胞,本研究以实验室前期构建的HER2高表达细胞株HER2+B16F10为靶细胞,以小鼠淋巴细胞为效应细胞,通过检测乳酸脱氢酶的释放判断靶细胞的裂解程度。结果如图6所示,当固定血清稀释浓度为50∶1时,随着效应细胞与靶细胞比例的降低,裂解肿瘤细胞能力下降。但与未加血清相比,pNO2Phe79HER2免疫的小鼠血清能够显著增加肿瘤细胞的裂解能力。当固定E∶T=50∶1,随着血清稀释浓度的降低,裂解肿瘤细胞能力下降,但与Wt HER2组相比,pNO2Phe79HER2组能够产生具有显著性差异的靶细胞裂解率。
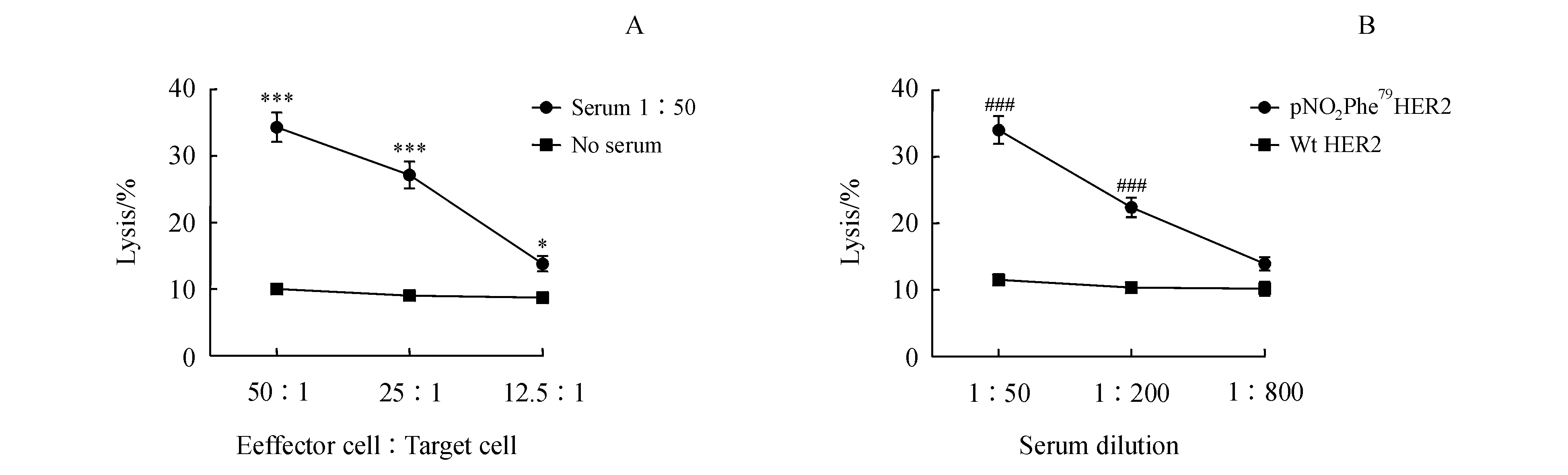
***P<0.001vsNo serum group;###P<0.001vsWt HER2 group
4 讨 论
对硝基苯丙氨酸是一种免疫原性氨基酸,能有效打破自身蛋白免疫耐受,诱导机体产生高滴度抗体。但有研究显示免疫原性氨基酸的引入受到位点限制[15]。因此,本实验选择了暴露在蛋白表面且不影响蛋白结构的3个氨基酸作为突变位点。突变位点选择的依据:(1)突变位点应尽量暴露在抗原分子表面,这样有利于非天然氨基酸的充分暴露,且不影响蛋白空间构象;(2)具有明显毒性的抗原分子,所选突变位点应为其活性相关位点,突变后使其失活并仅具有免疫原性,这样可避免疫苗在免疫过程中对机体造成伤害。通过遗传密码扩充技术在HER2胞外区第5、26、79位定点引入非天然氨基酸,通过对包涵体蛋白的纯化,本研究成功获得了纯度大于95%的Wt HER2抗原片段及其突变体。利用MOLDI-TOF检测突变体胰酶酶解后pNO2Phe所在的肽段相对分子质量,证明了本研究将pNO2Phe成功定点引入至突变位点。接着本研究通过检测C57BL/6小鼠体内产生的抗体滴度判断Wt HER2及突变体的免疫原性,结果表明pNO2Phe79HER2能针对Wt HER2产生最高滴度的抗体。因此本研究选择产生抗体滴度最高的pNO2Phe79HER2做进一步研究。有研究报道显示,将HER2胞外区1~146位氨基酸片段用胆固醇普鲁兰多糖包裹形成CHP-HER2疫苗,然而形成的CHP-HER2蛋白疫苗虽然能有效刺激机体产生针对HER2胞外1~146位氨基酸片段抗体,但是产生的抗体不能有效识别肿瘤细胞膜上的HER2受体[16]。本实验选用23~146位氨基酸残基作为原型抗原(1~22位氨基酸残基为信号肽)。结果显示,与CHP-HER2相比,pNO2Phe79HER2免疫小鼠产生的抗血清能够与肿瘤细胞膜上具有天然构象的HER2受体结合。在抗血清介导的ADCC效应实验中,当固定E∶T为50∶1时,HER2+B16F10细胞裂解比例随着小鼠血清浓度的稀释而下降,与之前的文献报道结果一致[17]。当固定血清稀释度为50∶1时,HER2+B16F10细胞裂解比例随着淋巴细胞减少而下降。
综上所述,本文通过遗传密码扩充技术获得的pNO2Phe79HER2可以有效打破免疫耐受,产生能够识别SKBR-3细胞膜上天然构象的HER2受体,并通过ADCC效应裂解HER2高表达的细胞。因此,定点引入了pNO2Phe的pNO2Phe79HER2可以作为治疗HER2过表达肿瘤的候选分子。
参 考 文 献
[1] Liu Y,el-Ashry D,Chen D,etal.MCF-7 breast cancer cells ove-rexpressing transfected cerbB-2 have aninvitrogrowth advantage in estrogen-depleted conditions and reduced estrogen-dependence and tamoxifen-sensitivityinvivo[J].BreastCancerResTreat,1995,34(2):97-117.
[2] Tsang R,Finn R.Beyond trastuzumab:novel therapeutic strategies in HER2-positive metastatic breast cancer [J].BrJCancer,2012,106(1):6-13.
[3] De Santes K,Slamon D,Anderson SK,etal.Radiolabeled antibody targeting of the HER-2/neu oncoprotein [J].CancerRes,1992,52(7):1916-1923.
[4] Spector NL,Xia W,Burris H,etal.Study of the biologic effects of lapatinib,a reversible inhibitor of ErbB1 and ErbB2 tyrosine kinases,on tumor growth and survival pathways in patients with advanced malignancies [J].JClinOncol,2005,23(11):2502-2512.
[5] Earl HM,Vallier AL,Dunn J,etal.Trastuzumab-associated cardiac events in the Persephone trial [J].BrJCancer,2016,115(12):1462-1470.
[6] Eryilmaz A,Demirci B,Gunel C,etal.Evaluation of lapatinib and trastuzumab for ototoxic effects [J].JIntAdvOtol,2015,11(3):207-211.
[7] Spector NL,Xia W,Burris H,etal.Study of the biologic effects of lapatinib,a reversible inhibitor of ErbB1 and ErbB2 tyrosine kinases,on tumor growth and survival pathways in patients with advanced malignancies [J].JClinOncol,2005,23(11):2502-2512.
[8] Costa RLB,Soliman H,Czerniecki BJ.The clinical development of vaccines for HER2+ breast cancer:current landscape and future perspectives [J].CancerTreatRev,2017,61:107-115.
[9] Tabi Z,Man S.Challenges for cancer vaccine development [J].AdvDrugDelivRev,2006,58(8):902-915.
[10] Dalgleish AG.Therapeutic cancer vaccines:why so few randomised phase III studies reflect the initial optimism of phase II studies [J].Vaccine,2011,29(47):8501-8505.
[11] Grunewald J,Hunt GS,Dong L,etal.Mechanistic studies of the immunochemical termination of self-tolerance with unnatural amino acids [J].ProcNatlAcadSciUSA,2009,106(11):4337-4342.
[12] Dai HT,Tian H,Huang J,etal.Protective effects ofp-nitrophenylalanine-containing BAFF vaccine on lupus nephritis model mice [J].JChinaPharmUniv(中国药科大学学报),2017,48(4):483-489.
[13] Kessel C,Nandakumar KS,Peters FB,etal.A single functional group substitution in C5a breaks B cell and T cell tolerance and protects against experimental arthritis [J].ArthritisRheumatol,2014,66(3):610-621.
[14] Cai D,Tian H,Yao WB.Molecular dynamics simulation and analysis of BAFF which is incorporated withp-nitro-L-phenylalanine[J].JChinaPharmUniv(中国药科大学学报),2017,48(2):227-232.
[15] Gauba V,Grunewald J,Gorney V,etal.Loss of CD4 T-cell-dependent tolerance to proteins with modified amino acids [J].ProcNatlAcadSciUSA,2011,108(31):12821-12826.
[16] Kageyama S,Kitano S,Hirayama M,etal.Humoral immune responses in patients vaccinated with 1-146 HER2 protein complexed with cholesteryl pullulan nanogel [J].CancerSci,2008,99(3):601-607.
[17] Hardy LL,Wick DA,Webb JR.Conversion of tyrosine to the inflammation-associated analog 3′-nitrotyrosine at either TCR- or MHC-contact positions can profoundly affect recognition of the MHC class I-restricted epitope of lymphocytic choriomeningitis virus glycoprotein 33 by CD8 T cells [J].JImmunol,2008,180(9):5956-5962.
