青钱柳三萜化合物对游离脂肪酸诱导的脂肪变性的干预作用
2018-07-02赵梦鸽杨慧敏蒋翠花殷志琦
赵梦鸽,杨慧敏,蒋翠花,张 健*,殷志琦
(1中国药科大学天然药物化学教研室&天然药物活性组分与药效国家重点实验室,南京 210009;2江苏省中医药研究院转化医学实验室,南京 210028)
非酒精性脂肪肝(NAFLD)是指在除酒精和其他明确的损肝因素(如毒素或药物)所致的以肝实质细胞脂肪变性为主要表现的临床病理综合征,包括单纯性脂肪肝以及由其演变的脂肪肝炎、脂肪肝纤维化和肝硬化[1]。近年来,随着人们生活水平的提高和饮食方式的改变,NAFLD发病率逐渐升高[2]。NAFLD的发生与氧化应激密切相关,核因子相关因子2(Nrf2)-抗氧化反应元件(ARE)通路是目前研究发现的重要内源性抗氧化应激信号通路,Nrf2激活后能调控下游第Ⅱ相解毒酶的表达,发挥抗氧化作用,从而保护肝脏[3-4],因此改善氧化应激的药物可能具有治疗NAFLD的作用[5]。
青钱柳[Cyclocaryapaliurus(Batal)Ijinskaja]又名摇钱树、麻柳,为胡桃科青钱柳属植物,是我国特有珍稀树种资源[6]。现代药理研究表明,青钱柳能够改善胰岛素抵抗,具有降血糖和降血脂等作用[6-8]。本课题组前期实验发现富含三萜化合物的青钱柳氯仿提取物具有抗氧化作用,能够改善NAFLD[9-10]。青钱柳叶含有大量的三萜成分如阿江榄仁酸、齐墩果酸、熊果酸、青钱柳酸A和青钱柳酸B等[11-12],而青钱柳三萜化合物(图1)是否为治疗NAFLD的有效成分,目前尚不清楚。本文拟通过混合脂肪酸(FFAs)诱导的HepG2细胞模型研究青钱柳三萜化合物对NAFLD的作用,并探讨其可能的机制。
1 材 料
1.1 药品与试剂
供筛选的11个青钱柳三萜化合物分别为:2α,3β,19α,23-四羟基-12-烯-28-乌苏酸(1)、1α,2α,3α,23-四羟基-12-烯-28-乌苏酸(2)、3β,23-二羟基-12-烯-28-乌苏酸(3)、2α,3α,23-三羟基-12,20(30)-二烯-28-乌苏酸(4,TUA)、2α,3α,23-三羟基-12-烯-28-乌苏酸(5)、青钱柳酸B(6)、2α,3β,23-三羟基-11,13(18)-二烯-28-齐墩果酸(7)、阿江榄仁酸(8)、cyclocarioside J(9)、cylocarioside H (10)、青钱柳苷C(11) (HPLC面积归一化法测定纯度大于98%,中国药科大学天然药化教研室自制);胎牛血清(美国ScienCell公司,批号:20825);DMEM、胰蛋白酶、噻唑蓝(MTT)(江苏凯基生物技术股份有限公司);牛血清白蛋白(BSA)、油酸和棕榈酸(美国Sigma Aldrich公司);三酰甘油(TG)检测试剂盒、油红O染液、超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒、BCA蛋白定量试剂盒(南京建成生物工程研究所);细胞核蛋白与细胞质蛋白抽提试剂盒、PMSF、ROS检测试剂盒(碧云天生物技术有限公司);鸦胆子苦醇(brusatol,成都植标化纯生物技术有限公司);兔抗Nrf2(nuclear factor erythroid 2-related factor 2)多克隆抗体、兔抗HO-1(heme oxygenase-1)多克隆抗体、兔抗NQO-1[NAD(P)H quinone oxidoreductase]多克隆抗体(美国Abcam公司);其他试剂均为国产分析纯。
1.2 仪 器
全波长多功能酶标仪(美国赛默飞世尔科技有限公司);超速控温离心机(美国Beckman Coulter公司);荧光倒置显微镜(德国Carl Zeiss公司);A101439电泳仪(美国Bio Rad公司)。
1.3 细胞株
人肝癌细胞株HepG2,购自ATCC细胞库。HepG2细胞用含10% FBS的高糖DMEM培养液,在37 ℃、体积分数5% CO2的饱和湿度条件下培养,每隔3天用0.25%的胰蛋白酶消化细胞,按1∶2比例进行传代,取对数生长期的细胞用于实验。

Figure1 Structures of the triterpenoids fromCyclocaryapaliurus
2 方 法
2.1 脂肪变性模型建立及药物的配制
称取一定量的油酸和棕榈酸(物质的量比为2∶1)混合后置于0.1 mol/L NaOH溶液中,70 ℃水浴直至完全溶解,配成100 mmol/L混合脂肪酸溶液。然后用10% BSA溶液稀释,配成浓度为5 mmol/L 的混合脂肪酸储备液,0.22 μm滤膜过滤待用。混合脂肪酸使用终浓度为1 mmol/L,与细胞共孵育24 h后,建立脂肪变性细胞模型。
取一定量的青钱柳三萜化合物1~11,先用DMSO溶解至一定浓度,使DMSO浓度不超过药物最终使用浓度的千分之一,然后用DMEM稀释至相应浓度。
2.2 青钱柳三萜化合物活性成分筛选
2.2.1 青钱柳三萜化合物细胞毒性筛选 取生长状态良好的HepG2细胞进行消化传代,以每孔1×104个细胞接种于96孔板中,待细胞贴壁后吸去培养基,加入不含血清的DMEM饥饿8 h后,分别给予10 μmol/L青钱柳三萜化合物1~11,空白组(Blank)加入不含血清的DMEM培养基,孵育24 h后吸去培养基,每孔加入5 mg/mL MTT 20 μL,孵育4 h,吸去上清液,加入DMSO 150 μL,酶标仪测定490 nm处的吸收度,计算细胞活力,实验平行3次。筛选无明显细胞毒性的化合物进行进一步活性筛选。
2.2.2 青钱柳三萜化合物对细胞内TG和SOD活力的影响 将HepG2细胞接种于24孔板,分别设置空白组(Blank)、模型组(Model)和青钱柳三萜化合物给药组(10 μmol/L)。空白组每孔加入含10% BSA的DMEM培养基,模型组每孔加入1 mmol/L FFAs的DMEM培养基,给药组每孔分别加入含1 mmol/L的FFAs和10 μmol/L青钱柳三萜化合物的DMEM培养基,孵育24 h后,试剂盒测定细胞胞浆中TG的含量和SOD的活性,细胞内总蛋白含量用BCA蛋白定量试剂盒测定,实验平行3次。筛选降脂和抗氧化活性较好的化合物进行后继机制探讨。
2.3 MTT法测定青钱柳三萜化合物对HepG2细胞活力的影响
MTT法测定1、5、10 μmol/L青钱柳三萜化合物对HepG2细胞存活率的影响,实验方法同“2.2.1”项。
2.4 油红O染色观察HepG2细胞内的脂滴积累
HepG2细胞接种于24孔板,分别设置空白组(Blank)、模型组(Model)和青钱柳三萜化合物给药组(1、5、10 μmol/L)和青钱柳三萜化合物+抑制剂组(10 μmol/L+40 nmol/L)。空白组每孔加入含10% BSA的DMEM培养基,模型组每孔加入含1 mmol/L FFAs的DMEM培养基,青钱柳三萜化合物给药组每孔分别含1 mmol/L FFAs和各浓度青钱柳三萜化合物的DMEM培养基,青钱柳三萜化合物 +抑制剂组加入含1 mmol/L混合脂肪酸和10 μmol/L青钱柳三萜化合物以及40 nmol/L鸦胆子苦醇的DMEM培养基,孵育24 h后,去除培养液,PBS洗涤2遍,4%多聚甲醛固定15 min,弃去多聚甲醛,PBS润洗3遍,加入油红O工作液染色,染色15 min,弃去油红O染液,PBS洗3遍,在显微镜下观察染色效果并拍照,然后用异丙醇洗脱细胞中的油红O染液并收集,在510 nm处用酶标仪测定其吸收度,实验平行3次。
2.5 HepG2细胞内TG含量、MDA含量和SOD活性的测定
将对数期的细胞消化后接种于24孔板中,分组给药方法同“2.4”项,孵育24 h后,试剂盒测定细胞中TG、MDA的含量SOD的活性,细胞内总蛋白含量用BCA蛋白定量试剂盒测定,实验平行3次。
2.6 细胞内ROS含量检测
接种单层细胞培养于96孔板中,分组给药方法同“2.4”项,培养24 h后,弃去培养基,PBS洗2遍,加入DCFH-DA荧光探针,于37 ℃培养箱中孵育20 min,PBS清洗3次以充分去除未进入细胞内的DCFH-DA探针,然后用全波长多功能酶标仪检测细胞荧光强度,激发波长488 nm,发射波长525 nm,实验平行3次。
2.7 Western blot分析
HepG2细胞以每孔1×106个细胞接种于6孔板中,分组给药方法同“2.4”项,培养24 h后,弃去培养基,PBS洗2遍,用试剂盒提取细胞核蛋白与细胞质蛋白,BCA法测定蛋白浓度后,将蛋白质样品稀释至相同且合适的浓度进行SDS-PAGE(电泳时间:85 V、20 min;120 V、80 min),然后转移至PVDF膜上在5%脱脂奶粉封闭液中室温封闭1 h,加入一抗(1∶1 000) 4 ℃过夜,之后加入二抗(1∶2 000)室温孵育2 h,采用电化学发光检测法(ECL法)显色检测抗氧化相关蛋白Nrf2、HO-1和NQO-1的表达情况。对感光胶片条带进行灰度分析,以目的条带与内参照条带β-actin的比值或核内参Lamin B1的比值代表目的蛋白的相对表达量。
2.8 数据分析
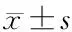
3 结 果
3.1 青钱柳三萜化合物活性成分筛选
3.1.1 青钱柳三萜化合物对细胞活力的影响 MTT实验结果显示,与空白组相比,青钱柳三萜化合物3、10和11的细胞活力均低于80%,具有明显的细胞毒性(P<0.01);化合物1、2、4、5、6、7、8和9的细胞活力均在90%,无明显的细胞毒性,故选择这些化合物进行活性筛选(图 2-A)。
3.1.2 青钱柳三萜化合物降脂作用考察 如图2-B所示,模型组与空白组相比细胞内TG含量明显升高,具有显著性差异(P<0.01),表明1 mmol/L混合脂肪酸诱导HepG2细胞脂肪堆积模型建立成功。与模型组相比,化合物2、4、5、6和9均能显著减少细胞内TG含量,其中化合物4(TUA)降TG效果最佳。
3.1.3 青钱柳三萜化合物抗氧化活性考察 HepG2细胞经混合脂肪酸刺激后,与空白组相比,HepG2细胞内抗氧化酶SOD活性显著下降(P<0.01)。与模型组相比,化合物2、4、5、6和9能够显著增加HepG2细胞SOD活性且化合物4(TUA)的抗氧化活性最好(图2-C)。
综上所述,化合物4(TUA)具有较好的降脂和抗氧化活性,故进一步考察其对NAFLD的干预作用和可能机制。


A:Cell viability measured by MTT assay;B:Intracellular tiglyceride (TG) content determined by the assay kits;C:Superoxid dismutase (SOD) activity determined by the assay kits
##P<0.01vsblank group;*P<0.05,**P<0.01vsmodel group
3.2 TUA对细胞活力的影响
通过MTT检测不同浓度的TUA对HepG2细胞存活率的影响,筛选出对细胞毒性较小的样品浓度作为实验的加药浓度。如图3所示,1和5 μmol/L的TUA加入HepG2细胞24 h后,细胞存活率均在90%以上,结合图2-A实验结果,说明10 μmol/L及以下浓度的TUA无明显的细胞毒性,因此后续实验的给药浓度设定在1~10 μmol/L之间。
3.3 TUA对HepG2细胞中脂质蓄积的改善作用
3.3.1 TUA对HepG2细胞脂质沉积的作用 油红O染色结果显示,空白组中HepG2细胞边缘清晰,未见红色油滴沉积;与空白组相比,模型组中HepG2细胞内可见明显的红色脂滴环绕于胞核周围,脂肪堆积明显(P<0.01),而药物组与模型组相比随着TUA给药剂量的增加,HepG2细胞红色脂滴的数量逐渐减少,且脂滴变小,颜色变浅。当TUA浓度为10 μmol/L时,HepG2细胞脂质沉积和脂滴的数量显著下降(P<0.05)。当同时加入TUA(10 μmol/L)和Nrf2抑制剂鸦胆子苦醇后,HepG2细胞脂质沉积和脂滴的数量与TUA(10 μmol/L)组相比显著增加,表明TUA可以改善脂质堆积(图4-A、4-B)。


3.3.2 TUA对HepG2细胞TG的作用 如图4-C所示,模型组与空白组相比TG含量明显升高,具有显著性差异(P<0.01)。在1~10 μmol/L浓度范围内随TUA给药浓度的增加,与空白组相比,HepG2细胞内TG的含量逐渐降低,表现明显的浓度依赖性。当TUA浓度为10 μmol/L时,细胞内TG的含量显著下降(P<0.05),TG的清除率达19.4%。与TUA(10 μmol/L)组相比,而TUA(10 μmol/L)+鸦胆子苦醇组细胞内TG的含量显著增加,表明TUA的降脂作用可能与Nrf2信号通路有关。综上可知,TUA具有良好的体外降脂活性,可能对脂肪肝具有一定的防治作用。
3.4 TUA对HepG2细胞氧化应激的影响
3.4.1 TUA对ROS含量的影响 DCFH-DA荧光探针与各组细胞共孵育后,模型组细胞内ROS与空白组相比显著增加(P<0.01),当给予10 μmol/L TUA后,细胞内ROS与模型组相比显著降低(P<0.05),而TUA(10 μmol/L)+鸦胆子苦醇组与TUA(10 μmol/L)组相比,细胞内ROS显著增加(图5-A)。
3.4.2 TUA对抗氧化酶SOD活性及脂质过氧化物MDA的影响 HepG2细胞经混合脂肪酸刺激后,与空白组相比,抗氧化酶SOD活力显著下降(P<0.01)而脂质过氧化物MDA的含量却明显增加(P<0.01)(图5-B、5-C)。不同剂量的TUA干预后,与模型组相比,细胞内SOD活力明显升高(P<0.01),脂质过氧化物MDA的含量逐渐下降,当给药浓度为10 μmol/L时,细胞内MDA的含量显著下降(P<0.05)。当加入Nrf2抑制剂鸦胆子苦醇后,与TUA(10 μmol/L)组相比,细胞内SOD活力明显降低而细胞内MDA的含量显著增加。


Figure4 Effect of TUA (10 μmol/L) on lipid accumulation in FFAs-induced hepatic steatosis cells

##P<0.01vsblank group;*P<0.05vsmodel group


ROS:reactive oxygen species;MDA:malondialdehyde
##P<0.01vsblank group;*P<0.05;**P<0.01vsmodel group;&&P<0.01vsTUA group
3.5 TUA对HepG2细胞抗氧化相关蛋白的影响
如图6-A~6-D所示,与模型组相比,TUA能够提高混合脂肪诱导的HepG2细胞内Nrf2和Nrf2所调控的抗氧化酶HO-1和NQO-1的蛋白表达量;当TUA达到10 μmol/L时,Nrf2、HO-1和NQO1的蛋白表达量显著增加(P<0.01);加入Nrf2的抑制剂鸦胆子苦醇后,同TUA(10 μmol/L)组相比,Nrf2、HO-1和NQO1的蛋白表达量均显著降低。如图6-E和6-F显示,与空白组相比,10 μmol/L的TUA能够显著增加Nrf2从细胞质转入细胞核(P<0.01),当加入鸦胆子苦醇后,Nrf2从细胞质转入细胞核的量显著降低(P<0.01),且细胞质和细胞核中的Nrf2表达量均降低。上述实验结果表明,TUA可能具有激活Nrf2的作用,增加Nrf2的入核,从而提高其介导的抗氧化酶的表达,发挥抗氧化的作用。


A-D:Protein levels of Nrf2,HO-1 and NQO-1 were measured by Western blot in HepG2 cells treated with indicated concentrations of TUA with or without FFAs in the absence or presence of Nrf2 inhibitor brusatol;E,F:Cytosolic and nuclear levels of Nrf2 were analyzed in HepG2 cells treated with indicated concentrations of TUA in the absence or presence of Nrf2 inhibitor brusatol
##P<0.01vsblank group;**P<0.01vsmodel group;&&P<0.01vsTUA group
4 讨 论
本研究采用FFAs刺激HepG2细胞,建立肝细胞脂肪变性模型,评价了11个青钱柳三萜化合物的生物活性,实验结果显示化合物4(TUA)具有良好降脂和抗氧化活性,其机制可能是通过激活Nrf2-ARE通路,提高Nrf2介导的抗氧化酶表达,从而改善肝脏脂肪变性。
本实验用1.0 mmol/L油酸和棕榈酸(物质的量比为2∶1)的游离脂肪酸作用于HepG2细胞24 h后,HepG2细胞中脂滴积累明显,ROS和MDA含量增加而SOD的活力下降,这与文献[13-14]等结果一致,表明肝细胞脂肪变性模型建立成功。
本研究共筛选了11个青钱柳三萜化合物的降脂和抗氧化活性。化合物1~5为乌苏烷型三萜苷元,化合物4(TUA)的降脂和抗氧化效果最佳,化合物2和5也有降脂和抗氧化活性,且化合物2的活性略优于化合物5,说明乌苏烷型三萜苷元药效较好,30位环外双键、A环3位α羟基和羟基个数对活性有影响。化合物6~8为齐墩果烷型三萜苷元,化合物6具有降脂和抗氧化作用,但其作用低于化合物4,说明齐墩果烷型降脂和抗氧化活性不如乌苏烷型,齐墩果烷型中3位氧化成羰基对其活性有利。化合物9~11为达玛烷型三萜皂苷,化合物9也具有一定降脂和抗氧化效果,说明达玛烷型三萜皂苷A环开环的化合物降脂和抗氧化活性优于A环闭环的化合物。
本实验发现TUA可显著减少HepG2细胞中脂质积累,降低ROS和MDA的含量并且增加SOD的活性,而鸦胆子苦醇可阻断这些作用,说明表明TUA可能是通过激活Nrf2保护肝脏,使其免受氧化应激损伤。
已有研究表明HO-1和NQO-1在调控肝脏ROS水平方面发挥着重要的作用,且HO-1和NQO-1主要受Nrf2-ARE通路调控[15]。正常生理状况下,Nrf2在细胞质中与胞浆蛋白伴侣分子Keap1结合处于被抑制状态,当发生氧化应激时,亲电子试剂或促氧化剂直接作用于Keap1的半胱氨酸残基,使Nrf2与其解偶联进入细胞核,与ARE结合,从而调控HO-1和NQO-1表达[16]。本实验中发现TUA能够显著增加混合脂肪酸诱导HepG2细胞中Nrf2、HO-1和NQO-1的蛋白表达,但当给予Nrf2的抑制剂鸦胆子苦醇干预后,Nrf2、HO-1和NQO-1的蛋白表达量降低。此外,TUA能够增加细胞核中的Nrf2表达而减少细胞质中的Nrf2的表达,增加Nrf2的入核,但当加入Nrf2的抑制剂鸦胆子苦醇后,Nrf2的入核减少,且细胞质中的Nrf2表达量也减少,这可能与鸦胆子苦醇抑制Nrf2的作用机制有关。以上结果表明,TUA可能是通过激活Nrf2,增加Nrf2入核,从而活化Nrf2-ARE通路抵抗氧化应激,缓解NAFLD的发生。
参 考 文 献
[1] Hardy T,Oakley F,Anstee QM,etal.Nonalcoholic fatty liver disease:pathogenesis and disease spectrum[J].AnnuRevPathol,2016,11:451-496.
[2] Gariani K,Philippe J,Jornayvaz FR.Non-alcoholic fatty liver disease and insulin resistance:from bench to bedside[J].DiabetesMetab,2013,39(1):16-26.
[3] Spahis S,Delvin E,Borys JM,etal.Oxidative stress as a critical factor in nonalcoholic fatty liver disease pathogenesis[J].AntioxidRedoxSign,2017,26(10):519-541.
[4] Ma Q.Role of Nrf2 in oxidative stress and toxicity[J].AnnuRevPharmacol,2013,53:401-426.
[5] Li WW,Ma FF,Zhang LY,etal.S-Propargyl-cysteine exerts a novel protective effect on methionine and choline deficient diet-induced fatty liver via Akt/Nrf2/HO-1 pathway[J].OxidMediCellLongev,2016,2016:4690857.
[6] Wang QQ,Jiang CH,Fang SZ,etal.Antihyperglycemic,antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts ofCyclocaryapaliurusleaves in type 2 diabetic rats[J].JEthnopharmacol,2013,150(3):1119-1127.
[7] Wu ZF,Gao TH,Zhong RL,etal.Antihyperlipidaemic effect of triterpenic acid-enriched fraction fromCyclocaryapaliurusleaves in hyperlipidaemic rats[J].PharmBiol,2017,55(1):712-721.
[8] Jiang CH,Yao N,Wang QQ,etal.Cyclocaryapaliurusextract modulates adipokine expression and improves insulin sensitivity by inhibition of inflammation in mice[J].JEthnopharmacol,2014,153(2):344-351.
[9] Lin Z,Wu ZF,Jiang CH,etal.The chloroform extract ofCyclocaryapaliurusattenuates high-fat diet induced non-alcoholic hepatic steatosis in Sprague Dawley rats[J].Phytomedicine,2016,23(12):1475-1483.
[10] Wang YT,Zhao MG,Sheng XP.etal.Effect of triterpenic acid-enriched fraction fromCyclocaryapaliuruson high glucose-induced pancreatic α cells insulin resistance[J].JChinaPharmUniv(中国药科大学学报),2018,49(2):215-221.
[11] Xie MY,Xie JH.Review about the research onCyclocaryapaliurus(Batal.) Iljinskaja[J].JFoodSciBiotechnol(食品与生物技术学报),2008,27(1):113-121.
[12] Li XL.Study on chemical constituents ofCyclocaryapaliurus[D].Changchun:Changchun University of Chinese Medicine,2012.
[13] Guo XX,Sha XH,Liu J,etal.Chinese Purple Yam (DioscoreaalataL.) extracts inhibit diabetes-related enzymes and protect HepG2 cells against oxidative stress and insulin resistance induced by FFA[J].FoodSciTechnolRes,2015,21(5):677-683.
[14] Yin JJ,Luo YQ,Deng HL,etal.HuganQingzhimedication ameliorates hepatic steatosis by activating AMPK and PPARα pathways in L02 cells and HepG2 cells[J].JEthnopharmacol,2014,154(1):229-239.

[16] Lee JM,Johnson JA.An important role of Nrf2-ARE pathway in the cellular defense mechanism[J].BMBRep,2004,37(2):139-143.
