多种细胞自噬调节剂对自噬标记物LC3II及p62表达的影响
2018-07-02魏砚明任晋宏栾智华王永辉
魏砚明,任晋宏,栾智华,王永辉
(山西中医药大学 1制药与食品工程学院;2实验中心,晋中 030619)
细胞自噬是细胞内重要的蛋白质降解途径,参与多种生理功能,已经证实细胞自噬活性失调与多种人类疾病密切相关[1-2]。判断细胞自噬活性的最常用方法是利用Western杂交检测内源性微管结合蛋白1轻链3I(LC3I)向微管结合蛋白1轻链3II(LC3II)的转化[3-4]。LC3是最早发现的自噬标记物,其前体经加工后将羧基末端切除产生LC3I,随后LC3I通过类泛素样修饰的方式与自噬小体膜上的磷脂共价结合,形成LC3II[5]。LC3II的量与自噬小体数量紧密相关,是反映细胞自噬活性的关键指标。细胞自噬受体蛋白p62作为泛素化底物和定位于自噬小体膜上LC3之间的连接因子可以被包裹进自噬小体降解。p62蛋白表达水平的高低与自噬活性成反比,是检测自噬活性的一个辅助指标[6]。
细胞自噬调节剂可以上调或下调自噬活性,被广泛应用于细胞自噬过程的解析[7-8]。由于不同的细胞自噬调节剂的作用靶点不同,其可能对LC3II和p62表达的影响存在差异;同时鉴于LC3II自身可以被自噬降解[9],而在某些条件下,p62蛋白水平的变化与细胞自噬并无关联[10],这就使在解释两者的Western杂交结果时存在不确定性,可能导致对实验结果的解析产生矛盾的、甚至错误的结论,曲解细胞自噬活性的变化及生物学意义。因此,有必要比较不同的自噬调节剂对LC3II和p62表达的影响。考虑到细胞自噬调节剂种类繁多,作用靶点各不相同,本研究通过多种常用的自噬调节剂调控细胞自噬过程不同阶段,例如利用雷帕霉素或海藻糖分别以mTOR依赖或非依赖方式诱导细胞自噬发生[11-12];利用3-甲基腺嘌呤阻断自噬小体的形成[13];利用巴弗洛霉素A1干扰自噬小体与溶酶体的融合[14];利用E64d和pepstatin A抑制溶酶体中组织蛋白酶活性[9],以自噬标记物LC3II和p62作为细胞自噬活性指标,观察不同浓度或不同作用时间的细胞自噬调节剂对其表达的影响。实验结果有望为这些细胞自噬调节剂的应用及细胞自噬检测结果的正确解析提供参考。
1 材 料
1.1 药物与试剂
DMEM培养基(美国Gibco公司);胰蛋白酶、胎牛血清、雷帕霉素(rapamycin)、海藻糖(trehalose)、3-甲基腺嘌呤(3-MA)、巴弗洛霉素A1(bafilomycin A1)、E64d、pepstatin A及鼠抗p62抗体(索莱宝科技有限公司);RIPA细胞裂解液、苯甲基磺酰氟(PMSF)、兔抗LC3抗体、羊抗actin抗体、蛋白酶抑制剂及化学发光试剂盒(碧云天生物技术公司);CCK8试剂盒(日本同仁化学研究所)。
1.2 仪 器
酶联免疫检测仪(美国伯腾公司);冷冻离心机(美国Sigma公司);电泳仪(美国伯乐公司)。
1.3 细胞株
HEK293细胞购自中国科学院上海生命科学研究院细胞资源中心。
2 方 法
2.1 细胞培养
HEK293细胞置于含10%胎牛血清,100 μg/mL链霉素和100 U/mL青霉素的DMEM培养基中,于含5%CO2,95%空气的37 ℃恒温培养箱中培养。
2.2 药物处理
取生长状态良好的HEK293细胞,吸去培养基后,分别换成含有不同浓度的雷帕霉素、海藻糖、3-甲基腺嘌呤、巴弗洛霉素A1或E64d和pepstatin A的新鲜培养基,对照组添加对应的溶剂。孵育指定时间后,收集、裂解细胞。雷帕霉素、巴弗洛霉素A1、E64d和pepstatin A溶于DMSO中,海藻糖溶于水中,3-甲基腺嘌呤于使用前直接溶于培养基中。
2.3 细胞裂解
细胞经预冷的PBS漂洗后,加入含蛋白酶抑制剂及1 mmol/L PMSF的RIPA裂解液(1% NP-40,50 mmol/L Tris-HCl,pH 7.4,150 mmol/L NaCl,0.25%脱氧胆酸,1 mmol/L EDTA),冰上裂解15 min。用移液器将细胞吹打起来后转移至1.5 mL离心管中,23号针头反复吹打破碎细胞,4 ℃条件下,3 302 r/min离心10 min,取上清液,BCA法测定上清蛋白浓度。
2.4 Western杂交检测LC3II和p62表达水平
细胞裂解液与5×SDS上样缓冲液混匀后,95 ℃加热5 min使蛋白质变性,用于SDS-PAGE。随后,蛋白质被转移至硝酸纤维素膜上。室温下,经含5%脱脂奶粉的TBST封闭1 h后,4℃条件下孵育一抗过夜后,室温条件下分别与相应的连接有辣根过氧化物酶的二抗孵育1 h,用TBST洗去未发生结合的二抗。利用化学发光试剂盒显影蛋白条带。胶片经扫描后,利用Image J定量对应条带的强度。
2.5 细胞毒性实验
将HEK293细胞接种于96孔板中,24 h后加入自噬调节剂处理,继续培养指定时间,按照CCK8试剂盒说明书检测自噬调节剂对细胞的毒性作用。
2.6 统计学分析
3 结 果
3.1 自噬活化剂对自噬标记物的影响
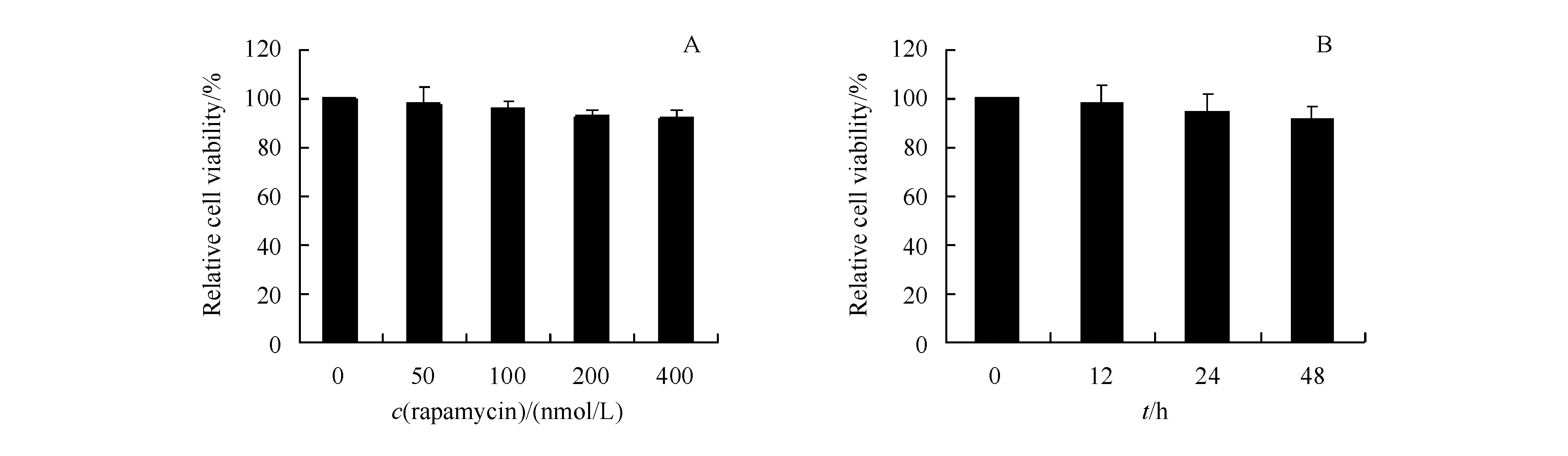
3.1.1 雷帕霉素对自噬标记物的影响 雷帕霉素作为一种应用广泛的自噬活化剂,其可以使mTOR激酶失活,下调p70 S6激酶活性,降低核糖体蛋白S6的磷酸化程度,从而上调自噬活性[11]。HEK293细胞经不同浓度的雷帕霉素处理24 h后,Western杂交检测LC3II和p62的表达,结果显示雷帕霉素可以上调LC3II的表达,并且具有剂量依赖性;类似地,雷帕霉素可剂量依赖性地降低HEK293细胞中p62的表达(图1-A,B)。为了比较雷帕霉素不同处理时间对LC3II和p62表达的影响,HEK293细胞经100 nmol/L雷帕霉素处理12、24或48 h后,检测LC3II和p62的表达,结果表明不同处理时间均引起LC3II表达显著增多(P<0.05),并随着处理时间的延长,LC3II表达增加;而在经雷帕霉素处理12 h 的HEK293细胞中未观察到p62的表达有明显变化,但随着处理时间的延长,p62的表达显著降低(P<0.05)(图1-C,D)。

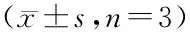
A,B:Incubated with rapamycin at different concentration for 24 h;C,D:Incubated with rapamycin (100 nmol/L) after different duration
*P<0.05vscontrol group
3.1.2 海藻糖对自噬标记物的影响 海藻糖是一种非还原性双糖,其以一种mTOR非依赖性的方式增强自噬活性[12]。HEK293细胞经不同浓度海藻糖处理24 h后,Western杂交检测LC3II和p62的表达,结果显示海藻糖可以上调LC3II的表达,而p62的表达未观察到明显变化(图2-A,B)。此外,利用20 mmol/L海藻糖处理HEK293细胞不同时间,观察到海藻糖可以时间依赖性地增强LC3II的表达;类似地,其对p62的表达没有明显影响(图2-C,D)。
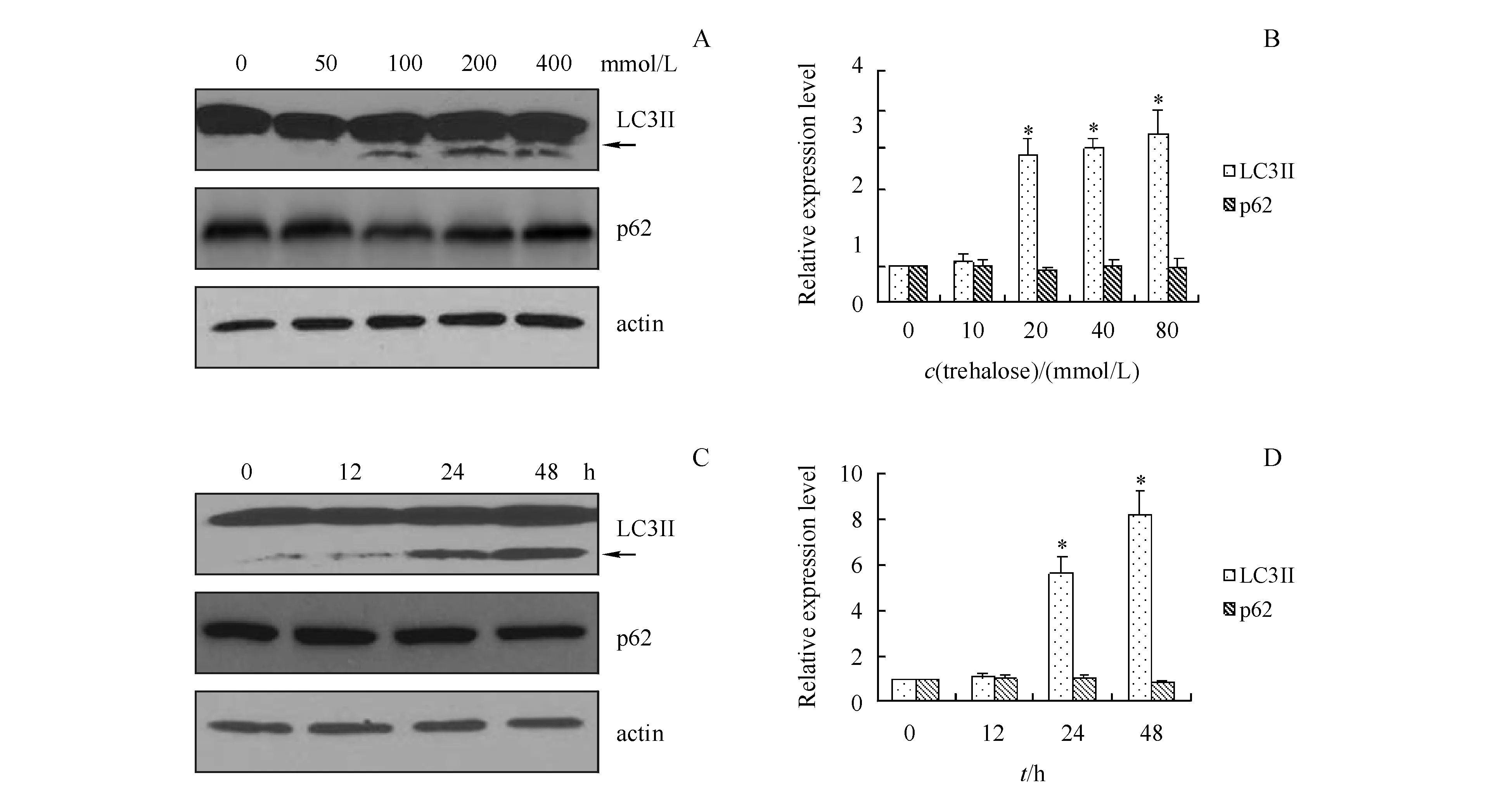
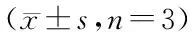
A,B:Incubated with trehalose at different concentration for 24 h;C,D:Incubated with trehalose (20 mmol/L) after different duration
*P<0.05vscontrol group
3.2 自噬抑制剂对自噬标记物的影响
3.2.1 3-甲基腺嘌呤对自噬标记物的影响 3-甲基腺嘌呤通过特异抑制PI3KIII的激酶活性,阻断自噬小体的形成[13]。HEK293细胞经不同浓度的3-甲基腺嘌呤处理24 h后,Western杂交检测LC3II和p62的表达,结果表明随着3-甲基腺嘌呤浓度的增加,LC3II和p62的表达均明显增加(图3-A,B)。同样地,利用5 mmol/L 3-甲基腺嘌呤处理HEK293细胞不同时间,LC3II和p62的表达呈现时间依赖性地增加(图3-C,D)。
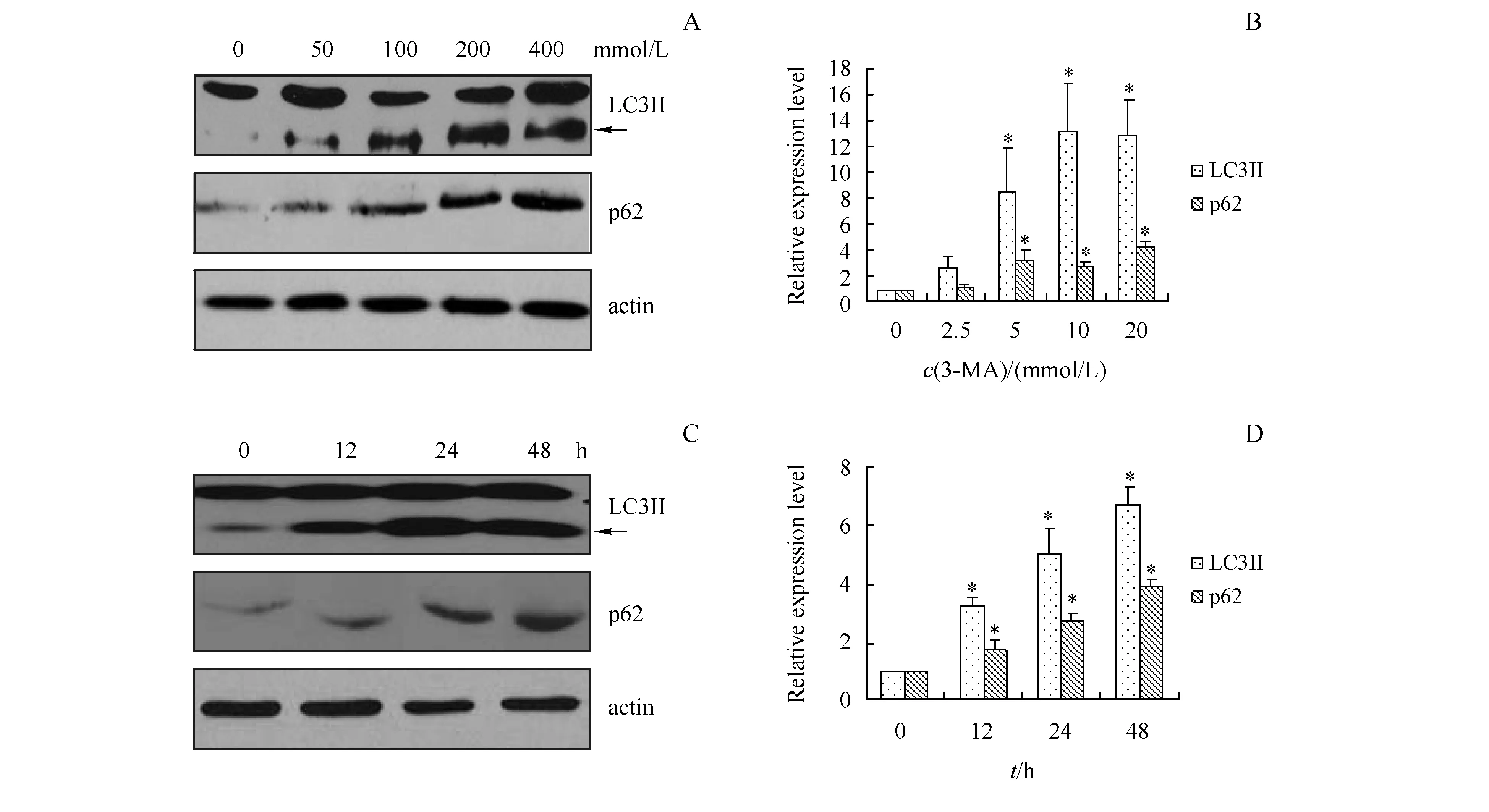
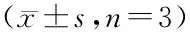
A,B:Incubated with 3-MA at different concentration for 24 h;C,D:Incubated with 3-MA (5 mmol/L) after different duration
*P<0.05vscontrol group
3.2.2 巴弗洛霉素A1对自噬标记物的影响 巴弗洛霉素A1可特异地抑制液泡膜上的氢离子ATP酶,使溶酶体腔内不能酸性化,从而干扰自噬小体与溶酶体的融合[14]。利用不同浓度的巴弗洛霉素A1处理HEK293细胞24 h后,检测LC3II和p62的表达,结果显示巴弗洛霉素A1可显著增加LC3II和p62的表达(P<0.05),并呈现剂量依赖性(图4-A,B)。利用40 nmol/L巴弗洛霉素A1处理HEK293细胞不同时间后,检测LC3II和p62的表达,结果显示巴弗洛霉素A1可时间依赖性地增加LC3II和p62的表达(图4-C,D)。
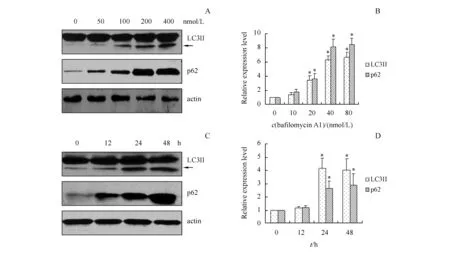
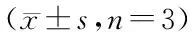
A,B:Incubated with bafilomycin A1 at different concentration for 24 h;C,D:Incubated with bafilomycin A1 (5 mmol/L) after different duration
*P<0.05vscontrol group
3.2.3 E64d和pepstatin A对自噬标记物的影响 E64d是一种膜通透性的组织蛋白酶B、H和L抑制剂;pepstatin A是组织蛋白酶D和E抑制剂[9]。不同浓度的E64d和pepstatin A共同处理HEK293细胞24 h后,检测LC3II和p62的表达,结果显示E64d和pepstatin A可显著增强两者的表达(P<0.05),并呈现剂量依赖性(图5-A,B)。利用E64d和pepstatin A各20 μg/mL同时处理HEK293细胞不同时间,观察不同作用时间对LC3II和p62表达的影响,结果显示E64d和pepstatin A可时间依赖性地上调LC3II和p62的表达(图5-C,D)。
3.3 细胞自噬调节剂的细胞毒性
为明确上述细胞自噬调节剂是否影响细胞活性,HEK293细胞经不同浓度或不同时间雷帕霉素处理后,检测细胞存活率,结果表明不同浓度或处理时间的雷帕霉素对细胞活性均无明显影响(图6)。同样地,HEK293细胞经不同浓度或不同时间的海藻糖、3-甲基腺嘌呤、巴弗洛霉素A1以及E64d和pepstatin A处理后,均未观察到对HEK293细胞有明显的毒性作用(结果未显示)。
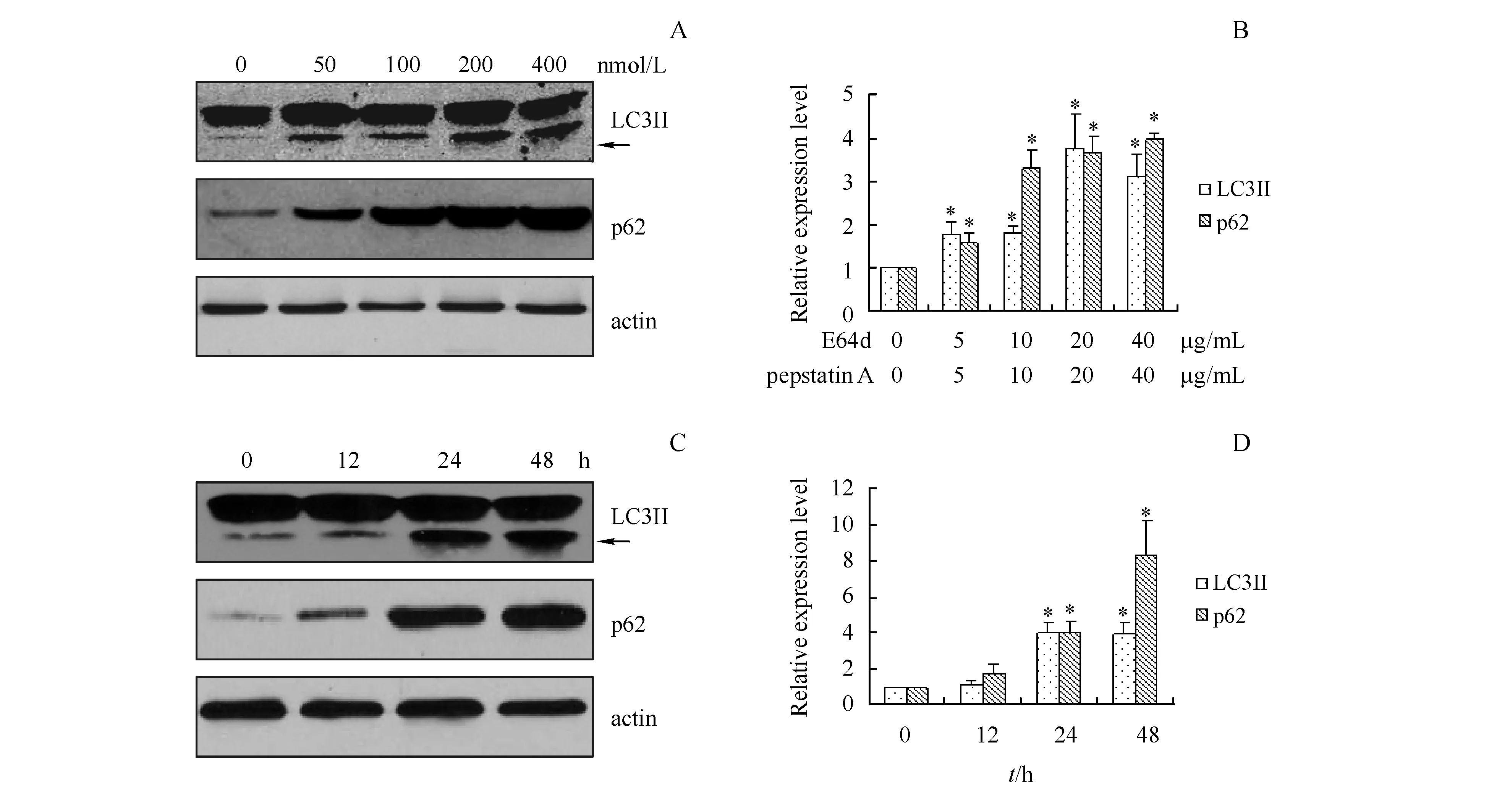
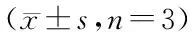
A,B:Incubated with E64d and pepstatin A at different concentration for 24 h;C,D:Incubated with E64d (20 μg/mL)+pepstatin A (20 μg/mL) after different duration
*P<0.05vscontrol group
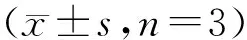
The value in rapamycin treated cells was shown as a percentage of the corresponding one in control cell,which was set as 100%
A,B:Incubated with rapamycin at different concentration for 24 h;C,D:Incubated with rapamycin (100 nmol/L) after different duration
4 讨 论
由于细胞自噬活性检测中分析方法或标准的差异,可能引起对实验结果的误读[9,15-16]。本实验中利用雷帕霉素或海藻糖诱导自噬小体形成;或者利用3-甲基腺嘌呤抑制自噬起始阶段、巴弗洛霉素A1抑制自噬小体与溶酶体的融合以及E64d和pepstatin A阻断自噬溶酶体的降解过程,均引起LC3II表达水平明显升高。因此,LC3II的增多既可反映自噬活性增强引起的自噬小体数量增加,也可能是由于自噬小体与溶酶体融合受阻或者自噬溶酶体的降解受阻引起的。一般情况下,LC3I的表达量比较稳定,但在5和10 mmol/L 3-甲基腺嘌呤处理组中其表达量与其他组有较大差别(图3-A),这可能与不同处理条件下自噬活性状态不同相关,但具体原因仍待进一步深入研究。
为了明确自噬活性的变化,通常结合观察自噬特异降解底物p62的表达。抑制细胞自噬的各个阶段时,LC3II的堆积伴随着p62表达的明显升高,并且呈现时间和剂量依赖性;而利用雷帕霉素诱导细胞自噬活性,促进p62降解,并且与LC3II的增多相比,p62的减少具有滞后性,例如在诱导自噬的早期,LC3II升高的同时未能检测到p62下调,提示清除作为自噬底物的p62需要较长时间,这可能与雷帕霉素诱导自噬的能力相对较慢有关[3],也可能和p62与自噬小体膜结合不够紧密相关[6]。
通过同时检测LC3II和p62来判断自噬活性的方法具有一定的局限性。由于自噬过程中LC3II被溶酶体中的水解酶降解[9],如果LC3II的溶酶体降解速度远小于自噬小体形成速度,LC3II水平的升高代表自噬的活化,而LC3II的表达在不同细胞中具有差异性,如果在某些细胞中自噬的本底水平较高,自噬活化时形成的LC3II被迅速降解,LC3II水平保持不变甚至降低,则其不能真实准确反映自噬的活化。另外,p62作为自噬标记物,尤其是作为自噬活化时的标记物时,由于表达变化的滞后性,同时其他自噬非依赖途径参与了p62代谢[10],其可能不能准确反映真实的自噬状态。尽管同样作为自噬诱导剂,但雷帕霉素和海藻糖对LC3II和p62表达的影响存在差异。海藻糖可以上调LC3II的表达,但对p62的表达未见明显影响,这可能是由于与雷帕霉素相比,海藻糖增强自噬活性的能力较弱,也可能与细胞系相关[17]。
最后,由于LC3II和p62的堆积可以是阻断细胞自噬的不同阶段引起的,目前还难以区分具体是哪一步骤受到抑制。因此,要客观评价细胞自噬状态也可选择其他多种方法综合评定,包括观察自噬小体的超微结构或长寿命蛋白的自噬性降解等[3-4,18]。
总之,本研究比较了多种调控细胞自噬不同阶段的调节剂对自噬标记物LC3II和p62表达的影响,结果验证了LC3II和p62的表达在细胞自噬的不同阶段均受到严格调控,不同的自噬调节剂对其表达的调控存在明显差异,为利用两者表达的变化解析细胞自噬活性检测结果及筛选新型自噬调节剂提供了参考。
参 考 文 献
[1] Choi AM,Ryter SW,Levine B.Autophagy in human health and disease[J].NEnglJMed,2013,368(7):651-662.
[2] Schneider JL,Cuervo AM.Autophagy and human disease:emerging themes[J].CurrOpinGenetDev,2014,26:16-23.
[3] Klionsky D,Abdalla F,Abeliovich H,etal.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2012,8(4):445-544.
[4] Klionsky D,Cuervo A,Seglen P.Methods for monitoring autophagy from yeast to human[J].Autophagy,2007,3(3):181-206.
[5] Kabeya Y,Mizushima N,Ueno T,etal.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBOJ,2000,19(21):5720-5728.
[6] Ichimura Y,Kominami E,Tanaka K,etal.Selective turnover of p62/A170/SQSTM1 by autophagy[J].Autophagy,2008,4(8):1063-1066.
[7] Law BY,Mok SW,Wu AG,etal.New potential pharmacological functions of Chinese herbal medicines via regulation of autophagy[J].Molecules,2016,21(3):359.
[8] Cheng Y,Ren X,Hait WN,etal.Therapeutic targeting of autophagy in disease:biology and pharmacology[J].PharmacolRev,2013,65(4):1162-1197.
[9] Tanida I,Minematsu-Ikeguchi N,Ueno T,etal.Lysosomal turnover,but not a cellular level,of endogenous LC3 is a marker for autophagy[J].Autophagy,2005,1(2):84-91.
[10] Kuusisto E,Suuronen T,Salminen A.Ubiquitin-binding protein p62 expression is induced during apoptosis and proteasomal inhibition in neuronal cells[J].BiochemBiophysResCommun,2001,280(1):223-228.
[11] Gao L,Lv G,Guo X,etal.Activation of autophagy protects against cholestasis-induced hepatic injury[J].CellBiosci,2014,4:47.
[12] Tang Q,Zheng G,Feng Z,etal.Trehalose ameliorates oxidative stress-mediated mitochondrial dysfunction and ER stress via selective autophagy stimulation and autophagic flux restoration in osteoarthritis development[J].CellDeathDis,2017,8(10):e3081.
[13] Wu Y,Wang X,Guo H,etal.Synthesis and screening of 3-MA derivatives for autophagy inhibitors[J].Autophagy,2013,9(4):595-603.
[14] Yu M,Xu X,Jiang N,etal.Dehydropachymic acid decreases bafilomycin A1 induced β-amyloid accumulation in PC12 cells[J].JEthnopharmacol,2017,198:167-173.
[15] Gottlieb R,Andres A,Sin J,etal.Untangling autophagy measurements:all fluxed up[J].CircRes,2015,116(3):504-514.
[16] Mizushima N,Yoshimori T.How to interapret LC3 immunoblotting[J].Autophagy,2007,3(6):542-545.
[17] Honma Y,Sato-Morita M,Katsuki Y,etal.Trehalose activates autophagy and decreases proteasome inhibitor-induced endoplasmic reticulum stress and oxidative stress-mediated cytotoxicity in hepatocytes[J].HepatolRes,2018,48(1):94-105.
[18] Lyu X,Hu Z.New methods to detect autophagic flux[J].ActaPharmSin(药学学报),2016,51(1):45-51.
