水稻蛋白酶抑制剂基因OsLTPL164和OsLTPL151的组成型及诱导型表达模式
2018-06-29何雨娟鞠迪王悦杨雪清王小奇
何雨娟,鞠迪,王悦,杨雪清,王小奇
水稻蛋白酶抑制剂基因和的组成型及诱导型表达模式
何雨娟,鞠迪,王悦,杨雪清,王小奇
(沈阳农业大学植物保护学院/辽宁省经济与应用昆虫重点实验室,沈阳 110866)
【目的】蛋白酶抑制剂(protease inhibitor, PI)是一类广泛存在于植物中的蛋白质,具有抵御植食性昆虫取食危害的功能。然而,水稻()PI基因在二化螟()取食过程中的表达模式尚不清楚。本研究旨在分析水稻蛋白酶抑制剂基因和在二化螟取食及机械损伤下的表达模式,为明确和在水稻防御二化螟中的作用及今后利用这两个基因构建转基因水稻株系打下基础。【方法】以东北地区常规种植的3个水稻品系辽盐2号(1654)、辽星17号(1665)和长白17号(1688)为研究对象,在二化螟危害关键时期(分蘖期)通过机械损伤和接虫处理,在处理后不同时间(0、3、6、12、24、48、72 h)分别对根、茎、叶3个组织进行取样,利用实时荧光定量PCR(RT-qPCR)检测3个水稻品系中和的表达模式。【结果】在3个品系中的组织表达模式一致,在叶片和茎中的表达量均高于根部;在3个品系中的组织表达模式不一致,在1654品系中茎和叶片中的表达量显著高于根部,但在1688和1665品系中根部的表达量显著高于茎和叶片;此外,这两个基因在3个品系间的相同组织中都有不同的表达模式,在根、茎、叶中均呈现在1665品系中表达量最高、在1688品系中表达量次之、在1654品系中表达量最低的表达模式,但在不同组织中的表达模式与不同:在根中,在1665品系中的表达量明显高于1688和1654品系;在茎中,在1654和1665品系中的表达量明显高于1688品系;在叶中,在1654品系中的表达量明显高于1665和1688品系。二化螟取食诱导和在3个品系的叶片中表达上调幅度高于茎和根,且在1665品系中上调的幅度较1688和1654品系中大。在二化螟取食和机械损伤处理不同时间后,两个基因均呈现表达水平先上升后下降再上升的趋势;和在机械损伤6 h后才被显著诱导表达,而二化螟取食3 h后便可诱导和上调表达。【结论】和在3个水稻品系中二化螟取食以及机械损伤均能诱导其表达,推测这两个基因可能与水稻抗二化螟有关,但这两个基因在不同水稻品系中其他具体的功能可能有所不同。
蛋白酶抑制剂;二化螟;防御;诱导表达;RT-qPCR
0 引言
【研究意义】二化螟()属于鳞翅目螟蛾科,是我国水稻上危害最为严重的常发性害虫之一,年发生面积约1 000万公顷,造成的总经济损失达亿元[1]。该虫钻蛀危害,在分蘖期危害水稻可造成枯鞘、枯心苗;在穗期危害造成虫伤株和白穗[2]。在我国,二化螟分布较广,北达黑龙江南至海南岛均有分布[3]。当前,防治水稻二化螟仍主要依赖于化学杀虫剂,但由于该虫具钻蛀危害的特性,难以对其进行有效防治。此外,当前防治策略的单一性,导致害虫对新药产生抗药性的速度加快,施药剂量因而逐渐加大[2]。因此,研发对环境友好的非化学防控新技术成为当前更有效、更安全地防治农作物害虫的主要趋势。【前人研究进展】近年来,利用基因工程技术进行害虫防治已得到快速发展,并已被用于二化螟[4-6]、大螟()[4]、水稻象鼻虫()[7]、褐飞虱()[8]和白背飞虱()[8]等害虫的防治。其中,运用较多的有蛋白酶抑制剂基因(protease inhibitor,PI)[9-10]。蛋白酶抑制剂是一类低分子量的多肽或蛋白质,广泛存在于生物体内[11]。在植物中,PI通过与昆虫消化道内的蛋白消化酶形成复合物,阻断或削弱蛋白酶的水解作用,引起昆虫体内蛋白酶的过量产生,造成昆虫体内必需氨基酸的缺失,从而达到抗虫效果[12]。PI一般包括丝氨酸蛋白酶抑制剂、半胱氨酸蛋白酶抑制剂、天冬氨酸蛋白酶抑制剂、金属蛋白酶抑制剂、谷物胰蛋白酶抑制剂/-淀粉酶抑制剂5个亚族[11,13]。其中,以丝氨酸蛋白酶抑制剂和半胱氨酸蛋白酶抑制剂应用较广泛。丝氨酸蛋白酶抑制剂主要具有抑制鳞翅目昆虫消化蛋白酶的能力,而半胱氨酸蛋白酶抑制剂则主要具有抑制鞘翅目和半翅目昆虫消化蛋白酶的能力[13]。在水稻中的研究表明,丝氨酸蛋白酶抑制剂和半胱氨酸蛋白酶抑制剂可以明显地抑制植食性昆虫的生长和发育[14]。自Hilder等[15]首次将豇豆()丝氨酸蛋白酶抑制剂亚家族的胰蛋白酶抑制剂基因转入烟草并获得转基因抗虫植株以来,利用转PI基因进行害虫防治取得了很大的进展。转的稻株能增强对钻蛀性害虫二化螟及大螟的抗性[4];将编码大麦()胰蛋白酶抑制剂的基因转入水稻种子,水稻象鼻虫取食后,存活率显著低于对照[7]。转半胱氨酸蛋白酶抑制剂基因的水稻能显著抑制南方根结线虫()的产卵量[16]。因此,研究植物PI基因的功能,对利用这些基因进行害虫防治具有重要意义[5]。非特异性脂质转移蛋白(non-specific lipid transfer protein,nsLTP)是基因工程防治技术关注的另外一类重要的植物防御蛋白。现已证明转大麦的马铃薯()可以抵抗病原菌的侵害[17]。小麦()已被证实具有防御病原真菌的作用[18]。在水稻中,在受到病原菌侵染和机械损伤后,在盾片细胞中被诱导表达,表明该基因参与水稻防御功能[19];水稻仔苗受盐胁迫6 h后,上调表达419倍,表明该基因与盐胁迫应答相关[20]。由于与nsLTP在结构上的相似性,一些nsLTP基因也被归在PI家族中[21]。其中一些nsLTP基因同时具有PI和nsLTP两个家族的功能[22-23]。中国水稻数据网(http://www.ricedata.cn/gene/)显示,已知的编码水稻nsLTP蛋白的基因有52个;其中,由于结构上与nsLTP明显不同,已被移出nsLTP家族[21],现归为PI家族的谷物胰蛋白酶抑制剂/-淀粉酶抑制剂亚族;编码type II型LTP(LTP2),也属于蛋白酶抑制剂基因。不同植物的PI和nsLTP基因具有不同的组织表达模式,可能与它们的生物学功能有关。例如,谷子()脂质转移蛋白仅在茎、叶和穗中表达[24]。水稻在花药中表达水平最高,而在种子和根中不表达[25]。此外,PI和nsLTP基因经常受机械损伤和有害生物诱导表达。Green等[26]研究发现,在遭受机械损伤或马铃薯甲虫()危害后,马铃薯和番茄()叶片中蛋白酶抑制剂含量大幅度提高,这是诱导植物产生蛋白酶抑制剂的首次报道。丹参()的表达水平受病原菌和茉莉酸甲酯的诱导,表明该基因在植物防御反应中具有一定的作用[27]。在小麦中,小麦瘿蚊()幼虫危害和机械损伤均可诱导小麦表达上调[9-10]。【本研究切入点】转录组数据显示水稻蛋白酶抑制剂基因和在二化螟取食24 h后表达量明显上调,推测这两个基因可能具有防御二化螟的作用。然而,和在不同组织中的表达模式以及二化螟取食诱导和受机械损伤后的表达模式尚不明确。【拟解决的关键问题】以东北地区常规种植的辽盐2号(1654)、辽星17号(1665)和长白17号(1688)3个水稻品系为试材,在分蘖期进行人工接种二化螟和机械损伤处理,研究和在3个品系间的组织表达和诱导表达模式,为今后利用这两个基因构建转基因水稻株系打下基础。
1 材料与方法
1.1 试验材料
供试昆虫:二化螟卵由中国农业科学院植物保护研究所廊坊试验基地馈赠。卵在室内人工气候箱(Panasonic品牌,型号MLR-352H-PC)中孵育,条件为温度(26±2)℃,相对湿度70%±5%,光周期16L﹕8D,光照强度2 000 lx。初孵幼虫(1 d)用于试验。
供试水稻:1688、1665、1654品系由沈阳农业大学水稻研究所提供。
1.2 水稻种植与处理
1.2.1 水稻种植 2017年4月14日,对水稻进行浸种、催芽,催芽温度为(26±2)℃;4月21日,对已浸种萌发的种子进行播种育苗;5月20日,在沈阳农业大学水稻田进行插秧。每个水稻品种栽10行,每行10穴,每穴一株,株行距为16.7 cm×26.6 cm;3个品种间各设一行作为保护行。整个生育期不施任何杀虫剂,其他田间管理正常进行。在水稻分蘖盛期进行二化螟接虫处理和机械损伤处理。
1.2.2 二化螟接虫处理 参照周祖铭[28]和王悦等[2]的接虫方法,于6月30日对正值分蘖盛期的水稻按照虫﹕苗=1﹕1的比例进行人工接虫。用小号软头毛笔将二化螟初孵幼虫接于水稻茎秆与第二叶或第三叶叶鞘之间的叶舌处。试验设3次重复,每个重复接虫7株,每株一头。为确保试虫不会转株至相邻水稻植株上,以及田间其他有害生物的干扰,接虫后在每株水稻上加盖一个40目的网笼。接虫不同时间(0、3、6、12、24、48、72 h)后,分别剪取水稻的根、茎和叶,用铝箔纸包裹,立即浸入液氮速冻后,带回实验室于-80℃超低温冰箱中保存。以不接虫的健康水稻植株(0 h)相应组织为对照。
1.2.3 机械损伤处理 在靠近水稻茎秆基部2—3 cm处的两侧,用昆虫针(直径0.32 mm)少力均匀地刺200次。试验设3次重复,每个重复选取7株。为确保试验的准确性,机械损伤后在植株上加盖一个40目的网笼。损伤不同时间(0、3、6、12、24、48、72 h)后,分别剪取水稻的根、茎和叶,用铝箔纸包裹,立即浸入液氮速冻后,带回实验室于-80℃超低温冰箱中保存。以不针刺的健康水稻植株(0 h)相应组织为对照。
1.3 引物设计与合成
使用Primer3在线工具(http://bioinfo.ut.ee/ primer3-0.4.0/)设计和的实时荧光定量PCR(RT-qPCR)引物。根据李冉等[29]筛选的内参基因和,结合本试验的水稻材料,测得的cq值不稳定,最终选取较稳定的和作为内参基因。本试验所用引物由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 RT-qPCR所用基因引物
1.4 总RNA抽提及cDNA第一链的合成
根据Plant RNA Kit(Omega)提取试剂盒的说明书步骤提取RNA。称取100 mg水稻组织,放入用DEPC水处理过的研钵中研磨,此过程中不断加入液氮;充分研磨后,将干粉装入1.5 ml无RNase的离心管中,添加600 µL RB buffer/10 µL-巯基乙醇,充分振荡混匀后,14 000 r/min(4℃)离心5 min;按照说明书逐步提取,提取完成后使用微量分光光度计Nano Drop 2000c(Thermo Fisher Scientific)检测OD260/OD280是否在1.8—2.2范围内,保证所提取的RNA样品的浓度和纯度,然后再利用1%琼脂糖凝胶电泳进一步检测其完整性。将检测合格的总RNA保存于-80℃冰箱备用或立即进行后续试验。选用TaKaRa公司的PrimeScriptTMRT regent Kit with gDNA Eraser(Perfect Real Time)试剂盒反转录合成第一条链cDNA,试验全程使用RNase离心管,反应液的配置均在冰上完成并按照说明书逐步进行,合成cDNA保存于-20℃或立即进行后续试验。
1.5 实时荧光定量PCR
用美国伯乐公司生产的CFX96荧光实时定量PCR仪检测目的基因和的表达水平。RT-qPCR反应体系:在20 µL的反应体系中依次加入7.4 µL ddH2O、1.0 µL cDNA模板、上下游引物(10 µmol·L-1)各0.8 µL、10 µL SYBR®Premix Ex TaqTMⅡ。RT-qPCR反应条件:预变性反应:95℃ 30 s;PCR反应:95℃ 5 s,60℃ 30 s,40个循环。此外再加上RT-qPCR仪器自带的熔解步骤,保证熔解曲线为平滑的单峰且峰值单一,无杂峰。每个样品设置3个重复,以不加cDNA模板作为阴性对照。目标基因表达量采用2-ΔΔCt方法计算。
1.6 数据分析
采用SPSS17.0软件对数据进行统计,和在3个水稻品系中的组成型表达分析采用One-way ANOVA(<0.05),二化螟取食和机械损伤诱导表达分析采用交叉分组的两因素有重复观察值方差分析(<0.05,Duncan test)。
2 结果
2.1 OsLTPL164在3个水稻品系中的组成型表达谱分析
1688品系的茎和叶中表达水平显著高于根(图1-a),在1654品系中表达水平依次为茎>叶>根(图1-b),在1665品系中茎中的表达水平显著高于根(图1-c)。
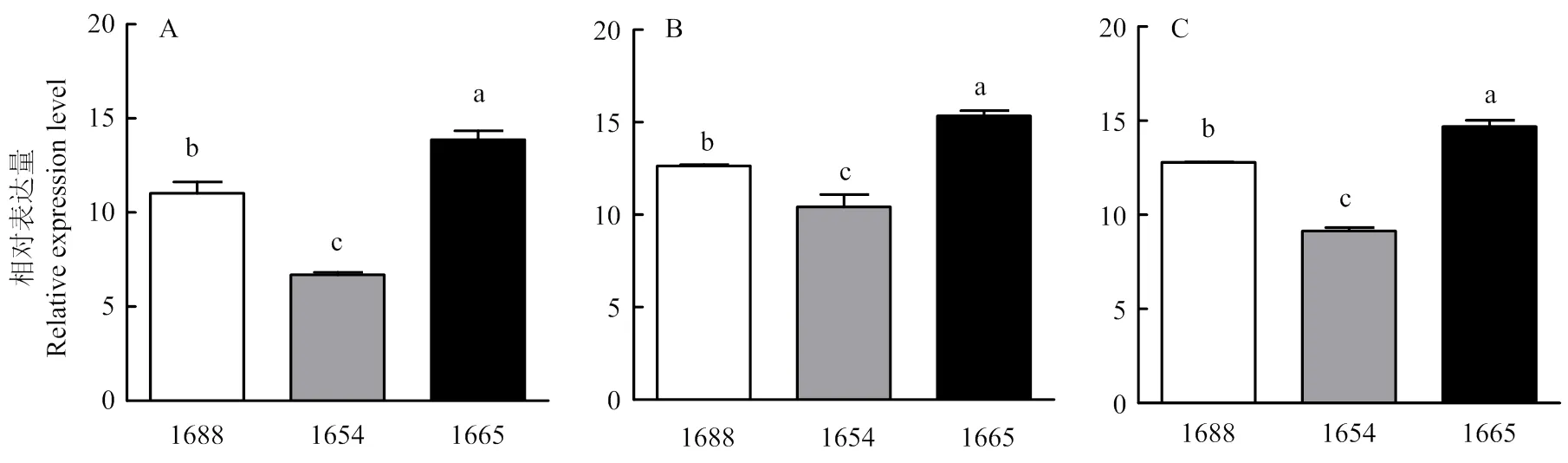
在根(图2-a)、茎(图2-b)和叶(图2-c)中,在3个水稻植株之间的表达差异显著(<0.05),该基因在1665品系中表达量最高,在1688品系中表达量次之,在1654品系中表达量最低。
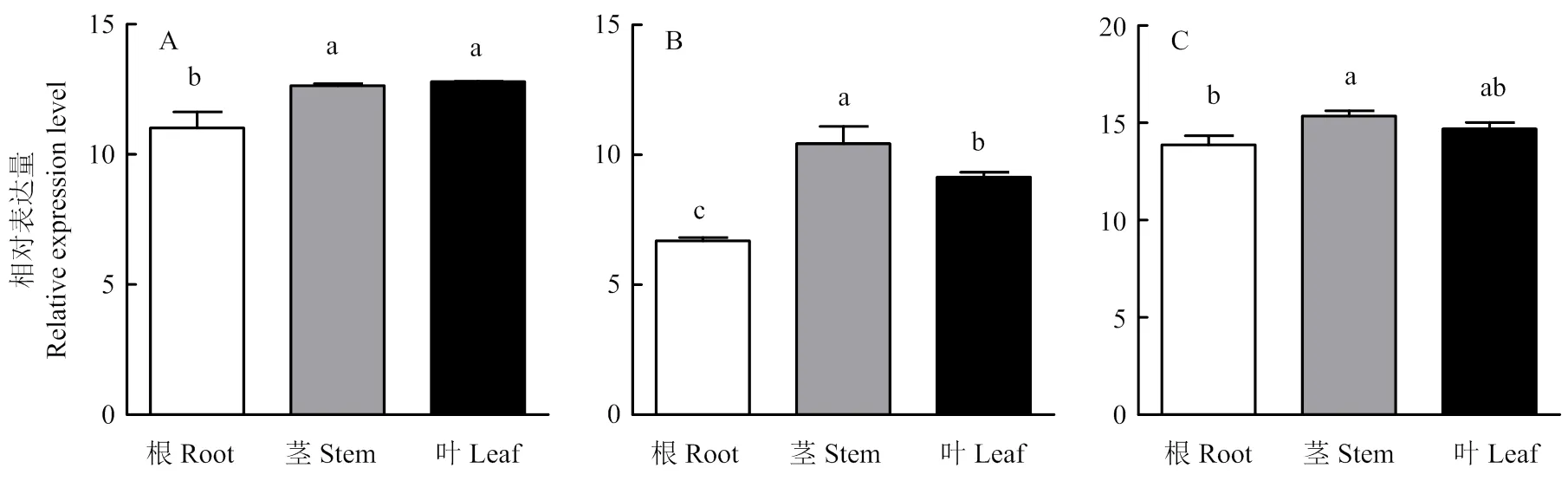
A:1688;B:1654;C:1665。数据均代表平均值±标准差,柱上不同字母代表基因表达差异显著(p<0.05, Duncan test, n=3)。下同
A:根root;B:茎stem;C:叶leaf
2.2 OsLTPL151在3个水稻品系中的组成型表达谱分析
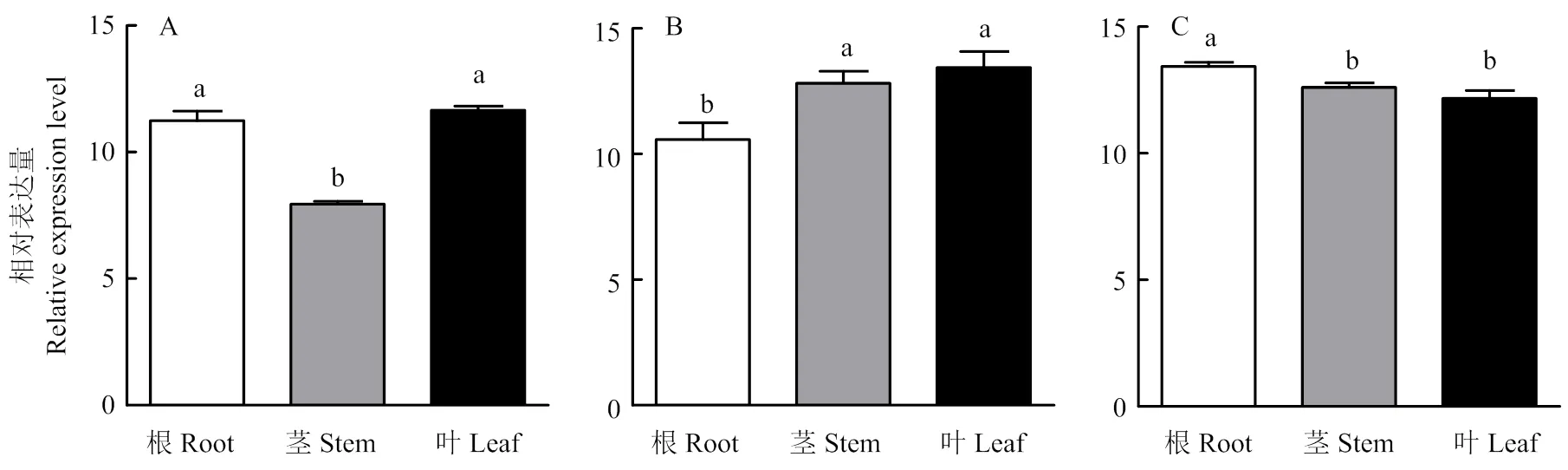
在1688品系根和叶中的表达水平显著高于茎(图3-a);在1654品系茎和叶中的表达水平显著高于根(图3-b);在1665品系根中的表达水平显著高于茎和叶(图3-c)。
在根中,在1665品系中的表达量显著高于1688和1654品系(图4-a);在茎中,在1654和1665品系中的表达量显著高于1688品系(图4-b);在叶中,在1654品系中的表达量显著高于1665和1688品系(图4-c)。
2.3 OsLTPL164在3个水稻品系中的诱导组织表达谱分析
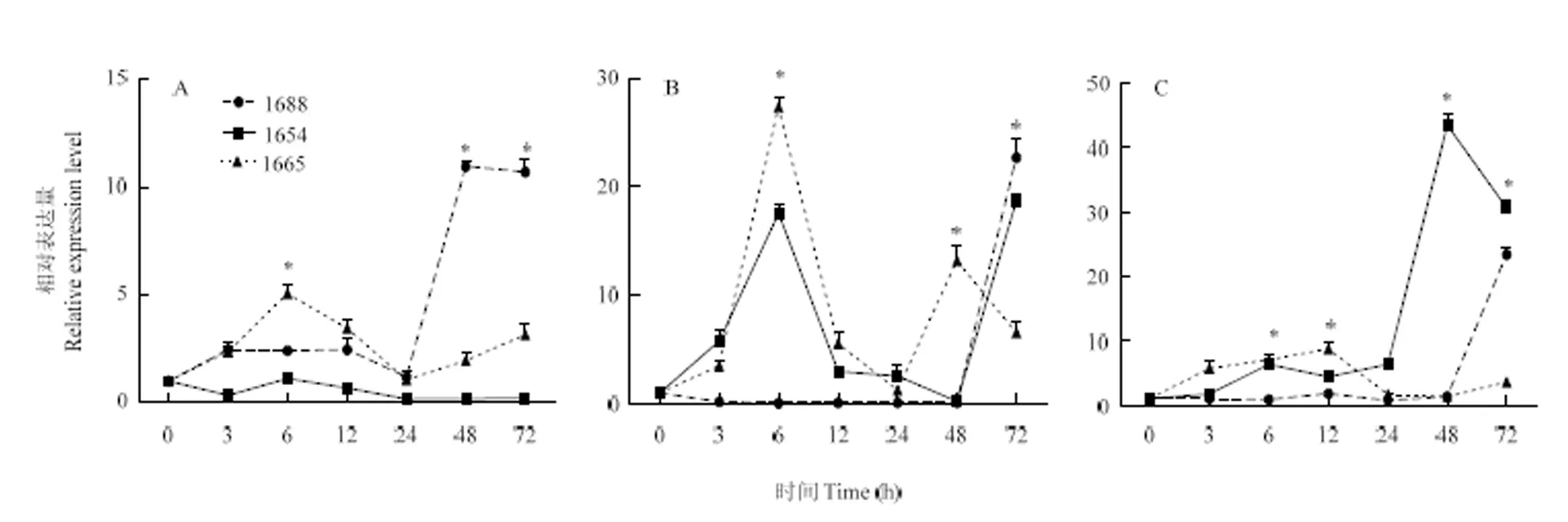
2.3.1 二化螟取食诱导组织表达谱 在根(图5-a)中,在1688品系中,二化螟危害6 h后的表达量显著升高;1665品系在接虫处理后,表达显著上调,在二化螟危害12 h和72 h后,表达水平均显著高于其他时间点;在1654品系中,的表达水平受二化螟取食影响较小,表达量变化不显著。在茎(图5-b)中,1688品系中二化螟取食24 h后的表达量才显著升高;1665品系中,二化螟取食下表达显著上调,并且在危害6 h后,表达水平均显著高于其他时间点;在1654品系中,的表达被显著诱导,并且在3 h的表达水平显著高于其他时间点。在叶(图5-c)中,1688品系中,二化螟取食24 h后的表达量才显著升高;1665品系中,二化螟取食下表达显著上调,并且在危害6 h和72 h后,表达水平均显著高于其他时间点;在1654品系中,的表达水平受二化螟取食影响较小,表达量变化不显著。
A:1688;B:1654;C:1665

A:根root;B:茎stem;C:叶leaf

A:根root;B:茎stem;C:叶leaf
2.3.2 机械损伤诱导组织表达谱 在根(图6-a)中,1688品系中,被机械损伤诱导表达幅度较小;1665品系在机械损伤处理6 h和72 h后,的表达水平均显著高于其他时间点;1654品系中,的表达水平受机械损伤处理影响较小,表达量变化不显著。在茎(图6-b)中,1688品系中,被机械损伤诱导表达幅度较小;1665品系在机械损伤处理72 h后,的表达水平均显著高于其他时间点;1654品系中,被机械损伤诱导表达幅度较小。在叶(图6-c)中,1688品系中,机械损伤处理12 h和72 h后表达水平急剧升高;1665品系在机械损伤处理72 h后,的表达水平均显著高于其他时间点;1654品系中,被机械损伤诱导表达幅度较小。
2.4 OsLTPL151在3个水稻品系中的诱导组织表达谱分析
2.4.1 二化螟取食诱导组织表达谱 在根(图7-a)中,1688品系中,被二化螟诱导表达幅度较小;1665品系在二化螟危害12、48和72 h后,的表达水平均显著高于其他时间点;在1654品系中,的表达水平受二化螟取食影响较小。在茎(图7-b)中,在1688品系中,的表达水平受二化螟危害影响较小;1665品系在二化螟危害6 h和12 h后,的表达水平均显著高于其他时间点;在1654中,在二化螟危害3 h和72 h可以被显著诱导表达。在叶(图7-c)中,在1688品系中,的表达水平受二化螟危害影响较小;1665品系在二化螟危害12 h和48 h后,的表达水平均显著高于其他时间点;在1654中,在二化螟危害6 h和12 h可以被显著诱导表达。

A:根root;B:茎stem;C:叶leaf

A:根root;B:茎stem;C:叶leaf
2.4.2 机械损伤诱导组织表达谱 机械损伤处理后,在3个水稻品系的不同组织中具有不同的表达模式(图8)。在根(图8-a)中,在1688品系中,的表达水平在机械损伤处理48 h和72 h后急剧升高;在1665品系中,机械损伤处理6 h后,的表达水平显著高于其他时间点;在1654品系中,的表达水平受机械损伤处理影响较小。在茎(图8-b)中,在1668品系中,的表达水平在机械损伤处理72 h后急剧升高;在1665品系的茎(图8-b)中机械损伤诱导幅度大于根(图8-a)和叶(图8-c),在机械损伤处理6 h和48 h后,的表达水平显著高于其他时间点;在1654品系中,机械损伤处理6 h和72 h后,的表达水平显著上升。在叶(图8-c)中,在1688品系中,的表达水平在机械损伤处理72 h后急剧升高;在1665品系中,在机械损伤处理6 h和12 h后,的表达水平显著高于其他时间点;在1654品系中,机械损伤处理48 h和72 h后,的表达水平显著上升。
A:根root;B:茎stem;C:叶leaf
3 讨论
PI和nsLTP是植物体内重要的防御蛋白,利用编码这些蛋白的基因开发基于基因工程技术的害虫防治方法,可以有效控制农业害虫的危害。这一方法已得到了广泛的应用[4,9-10,16]。
不同植物的PI和nsLTP基因具有不同的组织表达模式[30]。丹参在茎中表达量最高,其次是叶,而在根中几乎不表达;谷子也仅在茎、叶和穗中表达[24]。这些结果表明该基因可能具有防御病原菌侵染的作用[27]。有研究认为,LTP在表皮组织中的表达与角质膜形成有关,由于根组织不形成像气生组织一样的角质膜,所以LTP在根中表达较少或者不表达[24]。本试验的3个水稻品系中,属于PI家族的在茎和叶中的表达水平均高于根,分析原因为水稻的茎和叶常受二化螟等害虫的危害和植物病原菌等的侵染,该基因可能参与水稻植株地上部分的防御,这与前人的研究结果一致[24]。然而,属于LTP家族的在1688和 1665两个品系的根中表达水平显著高于茎和叶,推测该基因可能与根吸收土壤盐分、营养以及响应重金属等胁迫功能有关[20]。此外,已有研究结果证明,LTP基因家族各成员有着不同的组织表达特异性,在植物不同组织和器官中扮演不同的功能,例如,在菜豆中发现的一种LTP基因仅在根中专一性表达[30]。本研究发现表达模式与以及前人已报导的其他LTP基因[24,27]的表达模式不同,推测是由于不同水稻品系生物学和生理特性不同,其角质膜形成规律不一致造成的。
在3个水稻品系相同组织中的表达水平为在1665中最高,在1688中次之,在1654中最低;在根中的表达水平为1665品系中的表达量显著高于1688和1654品系;在茎和叶中的表达水平为1654品系的表达量高于1665和1688品系。和过去被归属在nsLTP中,但近年来发现它们在结构上与PI相似,被重新划分至PI中[21]。因此和可能同时具有PI和nsLTP两个家族的功能。研究表明,这两类蛋白在植物体内均参与系统防御[7,16-17,19]。抗虫相关基因在抗性较高的水稻品系中表达水平较高,在感虫品系内基因表达水平较 低[31]。所以,笔者推测1665品系较1654和1688品系对二化螟具有更高水平的抗性。下一步将系统地评价3个水稻品系对二化螟的抗性,以明确和与水稻抗虫性之间是否密切相关。
LTP基因经常受机械损伤和有害生物诱导表 达[9-10,19]。在本试验中,和在二化螟取食和机械损伤胁迫下,在3个水稻品系不同组织内表现出不同的表达模式。二化螟取食危害下和在3个水稻品系的茎和叶片中的表达量显著高于根,表明这两个基因可能参与水稻对二化螟取食的防御功能。此外,这一结果可能也与二化螟危害水稻时的取食行为有关。初孵幼虫先在叶片上徘徊、取食一段时间(约30 min),待找到合适的钻蛀部位后,钻蛀入水稻茎干。本研究发现,二化螟对不同PI基因在不同组织中的诱导表达效应也是不同的。在根中,的表达量在二化螟危害48 h以上才显著上调,而在危害3 h或6 h就显著上调表达。但在茎和叶片中,二化螟取食3 h或6 h便显著地诱导和表达。或许是这类基因在植物受有害生物胁迫后固有的表达模式,其特有的生物学功能有待于进一步解析。
与二化螟取食诱导表达不同的是,机械损伤对在1665品系中、在1688品系中不同组织间的表达量与对照相比无显著差异。原因可能是植物应对虫害和机械损伤时的防御机制不同;虫害不仅会造成机械损伤,害虫在取食过程中还会有分泌唾液及其类似物等激发子,进而诱导植物产生防御反应[8]。此外,本试验采用针刺的方式对水稻进行机械损伤,这与二化螟(咀嚼式口器害虫)危害植物的方式有所不同。相关研究得出,具有刺吸式口器的褐飞虱和白背飞虱取食水稻后,水稻的抗虫相关基因被诱导表达的时间比二化螟危害较晚,且表达量较低,与针刺的诱导表达模式相似[8]。此外,与二化螟危害相比较,和均在机械损伤6 h后才被诱导表达,诱导表达的时间较晚。在前人的研究中,机械损伤1 h后,水稻抗虫基因就可以被快速诱导[8,32];小麦在机械损伤0.5—1 h便被快速诱导上调表达,从3 h之后开始下降[33]。这可能与机械损伤的操作方式和不同植物本身LTP基因特性有关。
4 结论
和在3个常规种植的水稻品系中具有不同的组织表达模式以及二化螟取食和机械损伤后诱导模式,推测这两个基因与水稻抗二化螟有关。
[1] 盛承发, 王红托, 高留德, 宣维健. 我国水稻螟虫大发生现状、损失估计及防治对策. 植物保护, 2003, 29(1): 37-39.
SHENG C F, WANG H T, GAO L D, XUAN W J. The rice borers large status, loss estimation and control countermeasure., 2003, 29(1): 37-39. (in Chinese)
[2] 王悦, 杨雪清, 马殿荣, 王小奇. 东北稻区抗螟性水稻品种筛选研究. 中国植保导刊, 2015, 35(12): 26-30.
WANG Y, YANG X Q, MA D R, WANG X Q. Selection of resistant rice varieties to striped stem borer [(Walker)] in northeastern China., 2015, 35(12): 26-30. (in Chinese)
[3] 周圻. 防治稻螟四十年. 昆虫知识, 1990, 27(3): 178-181.
ZHOU Q. Control of the rice borer for 40 years., 1990, 27(3): 178-181. (in Chinese)
[4] XU D, XUE Q, MCELROY D, MAWAL Y, HILDER V A, WU R. Constitutive expression of a cowpea trypsin inhibitor gene,, in transgenic rice plants confers resistance to two major rice insect pests., 1996, 2(2): 167-173.
[5] MOCHIZUKI A, NISHIZAWA Y, ONODERA H, TABEI Y, TOKI S, HABU Y, UGAKI M, OHASHI Y. Transgenic rice plants expressing a trypsin inhibitor are resistant against rice stem borers,., 1999, 93(2): 173-178.
[6] WANG Y N, KE K Q, LI Y H, HAN L Z, LIU Y M, HUA H X, PENG Y F. Comparison of three transgenicrice lines for insecticidal protein expression and resistance against a target pest,(Lepidoptera: Crambidae)., 2016, 23(1): 78-87.
[7] ALFONSO-RIBI J, ORTEGO F, CASTANERA P, CARBONERO P, DIAZ L. Transgenic expression of trypsin inhibitor CMe from barley inandrice, confers resistance to the rice weevil., 2003, 12(1): 23-31.
[8] 王宝辉. 水稻抗虫相关基因和的功能分析[D]. 杭州: 浙江大学, 2012.
WANG B H. Functional analysis of herbivore resistance-related genesand
[9] WU J, LIU X, ZHANG S, ZHU Y C, WHITWORTH R J, Chen M S. Differential responses of wheat inhibitor-like genes to Hessian fly,, attacks during compatible and incompatible interactions., 2008, 34(8): 1005-1012.
[10] SALTZMANN K D, GIOVANINI M P, OHM H W, WILLIAMS C E. Transcript profiles of two wheat lipid transfer protein-encoding genes are altered during attack by Hessian fly larvae., 2010, 48(1): 54-61.
[11] HABIB H, FAZILI K M. Plant protease inhibitors: a defense strategy in plants., 2007, 2(3): 68-85.
[12] JONGSMA M A, BOLTER C. The adaptation of insects to plant protease inhibitors., 1997, 43(10): 885-895.
[13] 刘会香, 张星耀. 植物蛋白酶抑制剂及其在林木抗虫基因工程中的应用. 林业科学, 2005, 41(3): 148-157.
LIU H X, ZHANG X Y. Plant protease inhibitors and their application on forest tree resisting pest genetic engineering., 2005, 41(3): 148-157. (in Chinese)
[14] 武亮. 不同启动子驱动下马铃薯蛋白酶抑制剂PinⅡ转基因水稻的遗传、表达和抗虫性分析[D]. 南京: 南京农业大学, 2006.
WU L. Inheritance, expression and insect resistance analysis of potato protease inhibitor II gene () driven by different promoters in transgenic rice[D]. Nanjing: Nanjing Agricultural University, 2006. (in Chinese)
[15] HILDER V A, GATEHOUSE A M R, SHEERMAN S E, BARKER R F, BOULTER D. A novel mechanism of insect resistance engineered into tobacco., 1987, 330(6144): 160-163.
[16] VAIN P, WORLAND B, CLARKE M C, RICHARD G, BEAVIS M, LIU H, KOHLI A, LEECH M, SNAPE J, CHRISTOU P, ATKINSON H. Expression of an engineered cysteine proteinase inhibitor (Oryzacystatin-IΔD86) for nematode resistance in transgenic rice plants., 1998, 96(2): 266-271.
[17] MOLINA A, GARCIA-OLMEDO F. Enhanced tolerance to bacterial pathogens caused by the transgenic expression of barley lipid transfer protein LTP2., 1997, 12(3): 669-675.
[18] 李钊, 王金凤, 庄洪涛, 蒋雯, 叶兴国, 李斯深, 张增艳. 植物防卫基因和的克隆及其对小麦的转化. 核农学报, 2011, 25(5): 871-878.
LI Z, WANG J F, ZHUANG H T, JIANG W, YE X G, LI S S, ZHANG Z Y. Cloning of plant defense genesandand their transformation to wheat., 2011, 25(5): 871-878. (in Chinese)
[19] GUIDERDONI E, CORDERO M J, VIGNOLS F, GARCIA- GARRIDO J M, LESCOT M, THARREAU D, MEYNARD D, FERRIERE N, NOTTEGHEM J L, DELSENY M. Inducibility by pathogen attack and developmental regulation of the ricegene., 2002, 49(6): 683-699.
[20] LIN K C, WU T M, CHANDRIKA N N P, CHOU S J, HONG C Y. Molecular characterization and subcellular localization of salt-inducible lipid transfer proteins in rice., 2017, 61(3): 501-510.
[21] BOUTROT F, CHANTRET N, GAUTIER M F. Genome-wide analysis of the rice andnon-specific lipid transfer protein (nsLtp) gene families and identification of wheat nsLtp genes by EST data mining., 2018, 9(1): 86.
[22] SKINNER H B, MCGEE T P, MCMASTER C R, FRY M, BELL R M, BANKAITIS V A. Thephosphati- dylinositol-transfer protein effects a ligand-dependent inhibition of choline-phosphate cytidylyltransferase activity., 1995, 92(1): 112-116.
[23] JONES B L, MARINAC L A. Purification and partial characterization of a second cysteine proteinase inhibitor from ungerminated barley (L.)., 2000, 48(2): 257-264.
[24] 冯晓燕, 于静娟, 赵倩, 敖光明. 谷子脂转移蛋白cDNA的克隆及特性研究. 农业生物技术学报, 2003, 11(1): 11-15.
FENG X Y, YU J J, ZHAO Q, AO G M. Cloning and characterization of alipid transfer protein cDNA., 2003, 11(1): 11-15. (in Chinese)
[25] LIU X, SHANGGUAN Y, ZHU J, LU Y Q, HAN B. The ricegene promoter directs anther-specific expression by a combination of positive and negative regulatory elements., 2013, 238(5): 845-857.
[26] GREEN T R, RYAN C A. Wound-induced proteinase inhibitors in plant leaves: A possible defense mechanism against insect., 1972, 175(4023): 776-777.
[27] 刘梅, 生华, 化文平, 储君, 王喆之. 丹参非特异性脂质转移蛋白基因 ()的克隆及其表达分析. 植物生理学报, 2011, 47(1): 63-68.
LIU M, SHENG H, HUA W P, CHU J, WANG Z Z. Cloning and expression analysis of non-specific lipid transfer protein gene()fromBunge., 2011, 47(1): 63-68. (in Chinese)
[28] 周祖铭. 水稻品种抗二化螟鉴定初步研究. 植物保护学报, 1985, 12(3): 159-164.
ZHOU Z M. A preliminary study on the evaluation of rice varieties resistant to striped rice borer., 1985, 12(3): 159-164. (in Chinese)
[29] 李冉, 李建彩, 周国鑫, 娄永根. 水稻虫害诱导相关基因实时定量PCR中内参基因的选择. 植物学报, 2013, 48(2): 184-191.
LI R, LI J C, ZHOU G X, LOU Y G. Validation of rice candidate reference genes for herbivore-induced quantitative real-time PCR analysis., 2013, 48(2): 184-191. (in Chinese)
[30] CHOI D W, SONG J Y, OH M H, LEE J S, MOON J, SUH S W, KIM S G. Isolation of a root-specific cDNA encoding a ns-LTP-like protein from the roots of bean (L.) seedlings., 1996, 30(5): 1059-1066.
[31] 王悦. 抗二化螟水稻品种鉴定及抗虫基因初步挖掘与验证[D]. 沈阳: 沈阳农业大学, 2016.
WANG Y. Identification of resistant rice cultivars to striped stem borer (SSB),(Walker), and preliminary excavation and confirmation of resistant genes[D]. Shenyang: Shenyang Agricultural University, 2016. (in Chinese)
[32] 胡凌飞. 水稻抗虫相关基因及的功能解析[D]. 杭州: 浙江大学, 2014.
HU L F. Functional characterization of herbivore resistance-related genesandin rice[D]. Hangzhou: Zhejiang University, 2014. (in Chinese)
[33] JANG C S, JOHNSON J W, SEO Y W. Differential expression ofandinduced by Hessian fly larval infestation in a wheat line possessingresistance gene., 2005, 168(5): 1319-1326.
(责任编辑 岳梅)
Compositive and Inductive Expression Patterns of Protease Inhibitor Genesand)
HE YuJuan, JU Di, WANG Yue, YANG XueQing, WANG XiaoQi
(College of Plant Protection, Shenyang Agricultural University/Key Laboratory of Economic and Applied Entomology of Liaoning Province, Shenyang 110866)
【Objective】Protease inhibitors (PI) is a kind of protein widely existed in plants. It has the function of resisting herbivorous insects feeding. However, the expression patterns of rice () PI genes in the feeding process of theare not clear. The objective of this study is to analyze the expression patterns of rice protease inhibitor genesandunderinfestation and mechanical damage, which will lay a theoretical foundation for confirming the function ofandinfestation and constructing transgenic rice strains using these two genes in the future. 【Method】Three rice lines, Liaoyan 2 (1654), Liaoxing 17 (1665) and Changbai 17 (1688), which were conventionally planted in Northeast China, were selected as the research materials. Artificial infestation and mechanical injury treatments were performed at the tillering stage of rice, which is the key period of.infestation. The root, stem and leaf of three rice lines were sampled after different times (0, 3, 6, 12, 24, 48, 72 h) of treatments, then the expression level ofandof three rice lines was determined by RT-qPCR. 【Result】The tissue expression pattern of thewas consistent in three rice lines. The expression level ofwas not consistent in three rice lines. The expression level ofwas the highest in 1665 line, followed by 1688 line, and the lowest in 1654 line. Theexhibited different expression patterns in different tissues among three rice lines: in the root, the expression level ofand.infestation, and with a higher inducing effect in 1665 line than that in 1688 and 1654 lines. Bothandshowed a rise -decrease-rise expression tendency at different time points after artificial infestation and mechanical injury treatments. The expression level ofandwas significantly induced after 6 h of mechanical damage treatment, while the expression level ofandcould be significantly induced after 3 h ofinfestation. 【Conclusion】The expression ofand.infestation and mechanical damage treatment, suggesting that both the two genes are involved in resistance to.. However, other specific functions of the two genes in different rice lines might be different.
protease inhibitor;; defense; induced expression; RT-qPCR
2018-01-11;
2018-02-27
国家自然科学基金(31501666)、“青年托举人才工程”项目(YESS20160085)
何雨娟,E-mail:15940518901m@sina.cn。
杨雪清,E-mail:sling233@hotmail.com。通信作者王小奇,E-mail:wxq1120@sina.com
10.3864/j.issn.0578-1752.2018.12.008