大泷六线鱼6个群体遗传多样性的微卫星分析
2018-06-28武世雄姜欣彤王伟张赛赛董安然王宏宇李莹
武世雄,姜欣彤,王伟*,张赛赛,2,董安然,王宏宇,李莹
(1.大连海洋大学水产与生命学院,辽宁省北方鱼类应用生物学与增养殖重点实验室; 2.大连市水产技术推广点总站:辽宁 大连 116023)
大泷六线鱼[1-2](Hexagrammosotakii)属鲉形目(Scorpaeniformes)、六线鱼科(Hexagrammidae)、六线鱼属(Hexagrammos),俗称黄鱼。大泷六线因其味道鲜美且营养价值较高[3],而深受消费者喜爱,因此在水产养殖上具有重要的经济价值。其广泛分布于中国东部(主要为辽宁省和山东省)沿海及日本、韩国、朝鲜等国的近海。然而,近年来海洋资源匮乏问题日益突显,大泷六线鱼资源捕捞量逐渐加大而捕捞个体体型逐渐减小[4]。因此,开展大泷六线鱼的种质资源研究,选育新的优良品种,已变得非常迫切。
遗传多样性是种质资源的重要组成部分,丰富的遗传多样性是渔业优质高产,以及培育优良性状新品种的前提条件,才能够为水产养殖业带来显著的经济效益。目前,关于遗传多样性分析的常用方法主要有形态学标记、细胞学标记、生化标记和分子标记等。其中,微卫星分子遗传标记具有多态性高、共显性等特点,并且片段小、易操作[5],能更好地体现物种的遗传多样性[6]。通过统计与分析微卫星位点的有效等位基因数、杂合度、多态信息含量等结果,可以较好地反映群体内遗传变异情况。微卫星分子标记已被广泛地应用于鲤[6-9]、大黄鱼[10-11]、黄颡鱼[12-13]、石斑鱼[14-15]等多种鱼类[16-22]。刘奇[23]利用跨种扩增方法,筛选了7对适合大泷六线鱼群体分析的微卫星引物(其中有3对引物来自十线六线鱼),研究了中日沿岸的11个地理群体的遗传变异,但该研究中7个取样群体集中在辽宁沿海以外区域,其中只选取了大连黄海地区的两个取样点,对于近年广泛分布于辽宁黄渤海沿岸的大泷六线鱼遗传多样性的评价还不够全面。本研究应用7对适合大泷六线鱼群体分析的微卫星引物(有3对引物来自十线六线鱼),对辽宁沿海和青岛近海大泷六线鱼野生群体进行基因组扫描,评价大泷六线鱼天然种质特征和遗传多样性特点,以期进一步丰富大泷六线鱼遗传学信息,为加强大泷六线鱼天然资源保护和人工繁育增殖工作提供科学理论依据。
1 材料与方法
1.1 样本采集
本研究使用大泷六线鱼分别采自大连(市区、长海县、瓦房店和旅顺)、丹东(东港)和青岛6个地区。为保证实验鱼样品具有真实的代表性,各群体样品均为渔港码头野生采捕获得,样品规格为(20.00±1.50)cm。采捕后,样品低温运输到实验室后冷冻保存,备用核酸提取。采样点分布见图1,样品信息采集见表1。

图1 大泷六线鱼各群体的采样地点Fig.1 Sampling sites of 6 populations of Hexagrammos otakii
表1 大泷六线鱼群体的采样地、测序数量及地理坐标Tab.1 Locality, numbers and geographicalcoordinates of Hexagrammos otakii
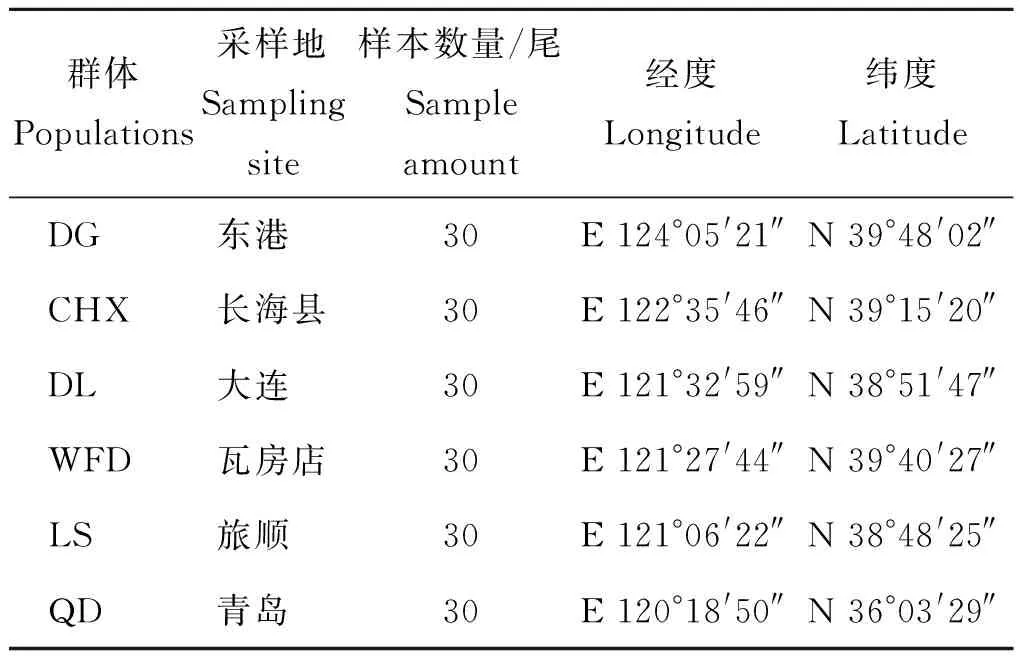
群体Populations采样地Sampling site样本数量/尾Sample amount经度Longitude纬度LatitudeDG东港 30E 124°05'21″N 39°48'02″CHX长海县30E 122°35'46″N 39°15'20″DL大连 30E 121°32'59″N 38°51'47″WFD瓦房店30E 121°27'44″N 39°40'27″LS旅顺 30E 121°06'22″N 38°48'25″QD青岛 30E 120°18'50″N 36°03'29″
1.2 基因组DNA的提取
将冷冻保存的样品剪取鱼尾部的肌肉组织0.10 g,将鱼肉组织放入无菌的1.5 mL离心管中,加400 μL匀浆液和20 μL SDS,用小剪刀充分剪碎肌肉组织至匀浆状态,然后再加3 μL蛋白酶K,充分混匀,于55 ℃水浴锅消化至澄清。
向离心管中加入100 μL乙酸钾溶液抽提,缓慢摇动离心管,4 ℃静置30 min后离心(4 ℃,12 000 r/min)10 min;将上清液吸出(400 μL)放于另一离心管中,加入预冷的无水乙醇1 000 μL使DNA沉淀,轻微振荡离心管,待有絮状沉淀产生后,在-20 ℃静置2 h,离心(4 ℃,12 000 r/min)10 min后,将离心后的无水乙醇小心倒掉,并且用70%乙醇进行2次清洗,将清洗后的离心管中加入无水乙醇(200 μL)再次离心,将沉淀物取出至另一离心管中,敞口放置于室温下干燥,待残留的乙醇完全挥发干净后,再加入50 μL TE,置于4 ℃冰箱1~2 h,使DNA充分溶解。
1.3 微卫星引物
1.3.1 微卫星序列的查找
采用SSRHunter1.3软件对Gene Bank上大泷六线鱼的64条序列进行查找,找出含有微卫星的序列。SSRHunter1.3软件的参数设置为查找含有二碱基、三碱基、四碱基、五碱基或六碱基分别重复5次以上片断的序列。
1.3.2 微卫星引物的设计
挑选含有微卫星的序列通过Primer premier 5.0软件设计出32对引物,将得分前10的引物序列送上海捷瑞生物工程有限公司合成。
设计引物[24]的主要参数如下:引物长度为18~24 bp,其中22 bp最为适宜;PCR产物的分子量大小为125~325 bp;最适的退火温度为50~60 ℃;GC的含量为40%~70%,最适为50%。
1.3.3 微卫星引物的筛选
设计好的引物经优化PCR条件获得3对扩增稳定的引物,编号为LY;另外4对编号为Heot的微卫星引物引自Chen等[25]的研究结果。序列信息见表2。
1.4 PCR扩增
反应体系中含基因组DNA 1 μL(约10 mg/L),10×PCR Buffer 2.5 μL,MgCl21 mmol/L,dNTP混合物0.2 mmol/L,3′和5′端引物各0.4 mmol/L,Taq DNA聚合酶1U,ddH2O补足至25 μL。反应程序按照[26]:94 ℃预变性3 min;94 ℃变性30 s,退火45 s,72 ℃延伸45 s,反应进行30个循环;最后72 ℃延伸7 min。

表2 基因组扫描分析所用微卫星标记及其引物Tab.2 Microsatelite markers and primers used in genomic scanning
注: F示上游引物,R示下游引物。
1.5 数据分析
电泳凝胶经美国UVP凝胶成像系统(BioSpectrum®AC Imaging System,USA)成像,结合凝胶电泳分析软件Gel-Pro Analyzer 4.0,根据标准Marker(DL100)读出扩增片段长度的大小,确定个体的基因型。利用Popgene 1.32软件处理数据,进行卡方检验估计各个基因座在每个群体中是否偏离Hardy-Weinberg平衡,计算各个群体各个座位的等位基因频率(allele frequency)、等位基因数(observed number of alleles,Na)、有效等位基因数(effective number of alleles,Ne)、观测杂合度(observed heterozygosity,Ho)、期望杂合度(expected heterozygosity,He)、遗传相似系数(genetic similarity index,I)、群体间遗传距离[27](genetic distance,Ds)等。用PIC_Calc 0.6软件计算多态信息含量 (polymorphism information content,PIC)[28]。用MEGA 4.1软件以UPGMA算法制作分子进化树。
2 结果
2.1 PCR扩增结果
微卫星的7个标记在群体中经过PCR扩增后进行聚丙烯酰胺凝胶电泳检测,检测结果表现出较为清晰的片段大小以及稳定的多态性,其中部分标记见聚丙烯酰胺凝胶电泳图2。
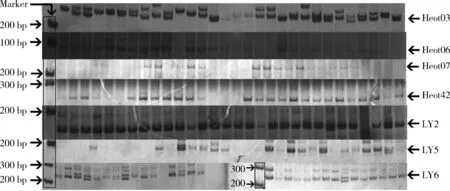
图2 7个位点在长海县群体的扩增电泳图Fig.2 Electrophoresis patterns of CHX population at 7 locus
2.2 Hardy-Weinberg平衡检验
微卫星DNA遵循不受外界压力的中性选择原则,因此在一个理想群体中,各等位基因在群体中的分布频率基本不会改变。运用Hardy-Weinberg精确P值的无偏估测对各群体的多基因座进行的多群体检测(multi-populations test),其原理是基于马可夫链模型(Markov chain method)。本研究检测结果显示,6个大泷六线鱼群体的Hardy-Weinberg平衡偏离常数均发生了极显著的偏离,其结果说明6个大泷六线鱼群体具有极显著的遗传不平衡。单群体单基因座检测(HW test for each locus in each population)结果显示,6个群体中表现为极显著的遗传不平衡(P<0.01)的基因座占全部基因座比例的64.00%,表现为显著的遗传不平衡(0.01
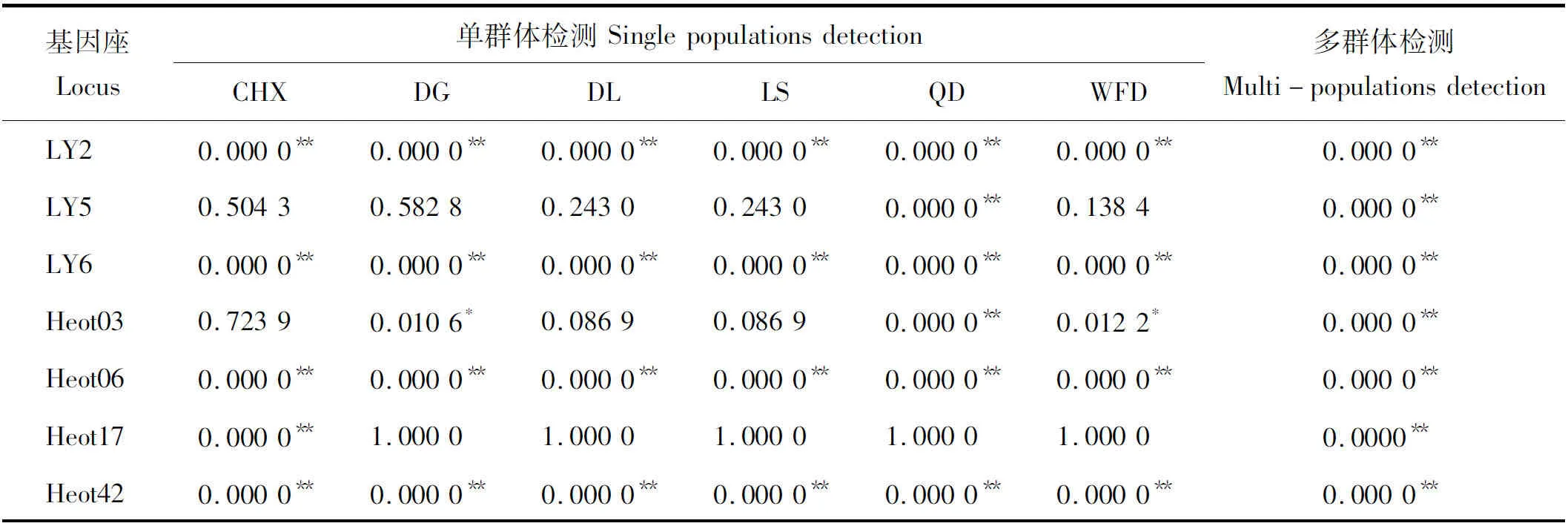
表3 大泷六线鱼群体遗传平衡分析Tab.3 Genotypic equilibrium analysis on 6 Hexagrammos otakii populations
注:*表示显著偏离Hardy-Weinberg平衡(P<0. 05),**表示极显著偏离Hardy-Weinberg平衡(P<0.01)。
2.3 遗传多样性
本研究中大泷六线鱼的6个群体是CHX、DG、DL、QD、LS、WFD,各位点有效等位基因数(Ne)的检测结果为1.00~5.72个,各群体中有效等位基因数(Ne)平均值依次为4.16、2.84、3.09、2.43、3.08和2.43;各位点观测杂合度(Ho)在0.00~0.74之间,各群体平均值为0.26、0.17、0.21、0.05、0.09和0.05;各位点期望杂合度(He)在0.00~0.84之间,各群体平均值为:0.75、0.61、0.69、0.44、0.69和0.44;各位点多态信息含量(PIC)在0.00~0.80之间,各群体平均值为0.69、0.52、0.52、0.47、0.52和0.47(表4)。在所检测的7个位点中,Heot17的多态性最低(0.47),其次为Heot42(0.61),其余5个位点在6个群体中均呈现较高的多态性。各群体中,青岛群体QD和瓦房店群体WFD的遗传多样性最低(0.47),长海县群体CHX最高(0.69)。6个大泷六线鱼群体间的几种统计参数均存在一定差异,但方差分析并未达到显著水平(P>0.05)。

表4 大泷六线鱼群体的多样性指数Tab.4 The genetic diversity indices for 6 Hexagrammos otakii populations

续表4,Tab.4 Contiuned
注:“0.000 0”表示保留4位小数后无进位,“—”表示未检出数值。
2.4 遗传分化
6个大泷六线鱼群体的基因分化系数(Fst)和基因流(Nm)信息见表5。由基因分化系数可知其中LY6和Heot06在群体间成中度遗传分化(0.05 基于等位基因频率,计算出大泷六线鱼6个地理群体间的遗传相似度(I)和遗传距离(Ds),结果如表6所示:WFD与QD群体间的遗传相似度最高(0.660 9),DL与QD群体间最低(0.372 6);WFD与QD群体间的遗传距离最近(0.414 1),DL与QD群体间最远(0.987 2)。基于Nei’s标准遗传距离的UPGMA聚类图(图3),发现6个群体分为2类,DL和CHX两群体亲缘关系较近单独聚为一个分支,QD和WFD群体先聚为一类,再与LS群体聚为一类,最后与DG群体聚在一起形成另一大分支。 表5 大泷六线鱼群体各位点的基因分化系数(Fst)和基因流(Nm)Tab.5 Coefficient of gene differentiation(Fst)and gene flow (Nm)among 6 Hexagrammos otakii populations 表6 大泷六线鱼群体之间的遗传相似性指数I(对角线上方)和遗传距离Ds(对角线下方)Tab.6 Nei’s genetic identity(above diagonal) and genetic distance (below diagonal) for 6 populations of Hexagrammos otakii 注:“—”示无数据。 图3 基于Nei’s遗传距离构建的6个大泷六线鱼 群体UPGMA树Fig.3 The dendrogram of 6 Hexagrammos otakii populations based on standard genetic distance using UPGMA method 生物群体的遗传多样性是评价物种资源状况的一个重要依据,它是物种适应多变的环境条件,维持长期生存和进化的基础。最大限度地维持种内遗传多样性水平,是持续利用种质资源的前提[29]。杂合度(heterozygosity,H)和多态信息含量(PIC)等都是反映群体遗传多样性的度量,其值直接反映群体内个体的均匀度。遗传变异是通过杂合度反映在各个群体的多个位点上表现出来的,杂合度是度量群体遗传变异的一个最适参数[30]。如果观测杂合度值(Ho)和期望杂合度值(He)越接近,则表明该种群受自然选择以及种内近交等因素的影响越小,因而群体处于一个遗传平衡状态[30]。本研究中,6个大泷六线鱼群体CHX、DG、DL、QD、LS和WFD的平均观测杂合度分别为:0.26、0.17、0.21、0.05、0.09和0.05,均远小于它们对应的平均期望杂合度(0.75、0.61、0.69、0.44、0.69和0.44),表明这6个群体均处于遗传不平衡状态,这个不平衡状态与Chen等[25]的研究结果一致。分析原因可能是这几个群体间基因交流由于地理环境等因素变少,在多代繁殖过程中主要形式为种内间的近交繁殖,因此造成了部分等位基因的丢失,从而出现杂合子缺失的现象。而根据表4发现,6个群体的有效等位基因数Ne分别为4.16、2.84、3.09、2.43、3.08和2.43,也与其等位基因数Na(分别为5.43、4.33、3.83、3.50、4.33和3.50)相差较大。分析有效等位基因数目的减少可能是由于生存环境的逐渐恶化、人们的肆意捕捞和活动导致的水体污染加剧,鱼类的产卵场所遭到破坏等[14],这些原因都可导致有效种群缩小,致使有效等位基因丢失。 在评价一个基因座位在种群中的多样性的一个重要标准为多态信息含量(PIC),其值越高,说明基因丰富度越高,表明该群体的遗传多态性水平越高。Botstein等[28]提出检测结果PIC≥0.50时,说明该基因座为高度多态基因座;当PIC≤0.25时,则为低度多态基因座;当结果PIC处于两者之间时,称为中度多态基因座。本研究结果中,除Heot17基因座的多态性较低(0.47),其余位点的PIC值均大于0.50,表现为高多态,说明其等位基因分布较均匀,多态性较高,适合用于大泷六线鱼的遗传多样性研究。6个群体中,青岛和瓦房店群体的PIC值低于0.50,均为0.47;其他4个群体为0.52~0.69,由小到大依次为东港(0.515 4)、大连(0.515 9)、旅顺(0.519 7)和长海县(0.689 1),各群体都表现出较高的多态性。以上数据说明,尽管6个大泷六线鱼群体有效等位基因数的结果显示数量较少,但其他多态性指标的结果显示仍保持着偏高的水平,因此6个大泷六线群体具有较高的遗传多样性特征。 种群的遗传结构受地理隔离、生存环境、种群瓶颈、基因流、选择等多种因素的影响,其中任一因素的变化都可能会造成该种群的遗传结构改变。遗传变异是为了适应不断变化的生存环境必须经历的过程[29]。表示群体间分化的遗传分化系数(Fst)的值范围是0~1。当群体的所有等位基因频率几乎相同时,Fst的值接近于0,各群体间几乎没有分化;当群体间的遗传分化增大时,说明遗传多样性几乎存在于各群体之间,Fst的值接近于1。6个大泷六线鱼群体的微卫星座位遗传分化系数(Fst)的平均值为0.27,表明26.79%的遗传分化来自群体内,73.21%的遗传分化来自群体间,各群体之间存在高度的遗传分化。Nm与Fst呈负相关[Nm=0.25(1-Fst)/Fst],因此遗传流所反映的群体遗传分化与基因分化系数是类似的。Slatkin等[31]认为,理论上,当Nm﹤1时,遗传漂变是影响群体间遗传分化的主要因素;当Nm>1时,基因流是影响种群遗传分化的主要因素。根据公式计算得出群体间基因流的均值(0.68),可以认为大泷六线鱼的种群间的分化结果是遗传漂变造成的。 遗传相似性指数和遗传距离是衡量群体亲缘关系的重要指标,一级亲缘关系的个体间遗传相似指数为0.5,二级亲缘关系为0.25。6个大泷六线鱼群体之间遗传相似系数(I)为0.37~0.66,几乎接近种内不同群体间的遗传相似度水平,同一物种不同群体间的遗传相似应该比较高,此次研究的这6个大泷六线鱼群体间的遗传相似性水平也比较符合这一点。基于大泷六线鱼群体之间遗传距离(Ds)构建的UPMGA系统树显示,6个群体在系统发生中可以分为2个大类,这样的聚类结果与它们在地理上的分布距离没有显著的相关性。结合大泷六线鱼群体间基因流(Nm)的均值为0.68<1,说明大泷六线鱼群体间的分化很可能是遗传漂变造成的。也就是说,造成群体间遗传分化大于群体内遗传分化的主要原因不是基因交流,而很可能是遗传漂变,因此与地理距离无关。 结合形态学[32]、线粒体序列的聚类分析[33]结果来看,每种方法获得的系统树不尽相同,其中一个最可能的原因在于系统树的构建过程中会受到所选择的分子标记引物、物种、分析软件以及计算方法等因子的影响,但因子的选择目前又没有一个统一的标准,所以导致最后分析的结果有所差异,这种现象在鲑科鱼类的研究中也有所体现[34]。但是,本研究结合微卫星标记与形态学[32]、线粒体序列的聚类分析[33]的研究结果显示,大泷六线鱼群体间发生了较大的遗传分化,遗传多样性较为丰富。本研究对验证6个大泷六线鱼存在遗传多样性分化有积极意义。 已发现大泷六线鱼自然资源锐减,这提示我们要吸取长江鲥濒临灭绝后再采取措施的教训,现阶段应即刻开始着手大泷六线鱼繁育技术研究,实现科学的人工增殖,积极保护大泷六线鱼资源。保护鱼类首先要保护种质资源,丰富的遗传信息是增殖和育种的基础。大泷六线鱼分布于西北太平洋、日本和朝鲜半岛近海、中国黄海等地,期望全球专家联合起来,共同摸清掌握大泷六线鱼各地理群体遗传多样性信息。 本研究利用7对微卫星分子标记对大泷六线鱼(Hexagrammosotakii)的6个地区群体(大连、丹东和青岛等地)进行了遗传多样性和遗传分化评估。结果表明:1)LY2、LY5 、LY6、Heot03、Heot06和Heot42 6个微卫星标记位点的PIC值均大于0.50,表现为高多态性,说明本方法适合用于大泷六线鱼的遗传多样性研究;2)6个大泷六线鱼群体的微卫星座位遗传分化系数(Fst)的平均值为0.27<0.50,表明大泷六线鱼遗传分化主要来自群体间;3)大泷六线鱼群体间基因流(Nm)平均值为0.68<1,推测大泷六线鱼群体间的遗传分化较大可能是遗传漂变造成的。 参考文献: [1] 刘蝉馨. 辽宁动物志[M]. 沈阳:科学技术出版社, 1987. [2] 王伟, 高伟峰, 张赛赛,等. 大泷六线鱼6个野生群体遗传多样性的12S rRNA基因分析[J]. 水产学杂志, 2017, 30(5):7-12. [3] 康斌, 武云飞. 大泷六线鱼的营养成分分析[J]. 海洋科学, 1999, 23(6):23-25. [4] 冯昭信, 韩华. 大泷六线鱼资源合理利用的研究[J]. 大连海洋大学学报, 1998, 13(2):24-28. [5] 张云武, 张亚平, Oliver A R. 微卫星及其应用[J]. 动物学研究, 2001, 22(4):315-320. [6] Desvignes J F, Laroche J, Durand J D, et al. Genetic variability in reared stocks of common carp (CyprinuscarpioL. ) based on allozymes and microsatellites[J]. Aquaculture, 2001, 194:291-301. [7] 全迎春,孙效文,梁利群. 应用微卫星多态分析四个鲤鱼群体的遗传多样性[J].动物学研究, 2005,26(6): s595-s602. [8] 常玉梅, 孙效文, 梁利群. 中国鲤几个代表种群基因组DNA遗传多样性分析[J]. 水产学报, 2004, 28(5):481-486. [9] 董在杰,刘念, 朱文彬,等. 清水江鲤基于微卫星标记和形态指标的遗传分析[J]. 南方水产科学, 2018, 14(1):1-8. [10] 王文文,常玉梅,梁利群.微卫星分析四个大黄鱼群体的遗传多样性[J]. 水产学杂志,2009,22(2):6-11. [11] 黄良敏,谢仰杰,苏永全,等.闽-粤东族与岱衢族养殖大黄鱼的遗传多样性研究[J]. 厦门大学学报(自然科学版),2006,45(6):836-840. [12] 李大宇,殷倩茜,侯宁,等. 黄颡鱼(Pelteobagruseupogon)不同生态地理分布群体遗传多样性的微卫星分析[J]. 海洋与湖藻,2009,40(4):460-468. [13] 马洪雨,姜运良,郭金峰,等.利用微卫星标记分析东平湖黄颡鱼的遗传多样性[J].激光生物学报, 2006,15(2):136-139. [14] 刘丽,刘楚吾,郭昱嵩,等.青石斑鱼微卫星DNA标记的筛选及群体遗传多样性分析[J].中国水产科学, 2008,15(1):22-29. [15] 王家祺,郭丰,丁少雄,等.斜带石斑鱼不同地理群体遗传变异的微卫星分析[J].海洋科学,2009,33(11):60-62. [16] 马波,姜作发,霍堂斌.下游黑龙江茴鱼种群遗传变异及地理分化的微卫星分析[J].中国水产科学,2009,16(5):678-688. [17] 刘丽,刘楚吾. 5种笛鲷属鱼类的遗传多样性及分子标记[J]. 农业生物技术学报, 2006,14(3):349-355. [18] 鲁双庆,刘臻,刘红玉,等.鲫鱼4群体基因组DNA遗传多样性及亲缘关系的微卫星分析[J].中国水产科学,2005,12(4):371-375. [19] 刘海金,朱晓琛,孙效文,等.牙鲆5个养殖群体的遗传多样性分析[J].中国水产科学, 2008, 15(1):30-37. [20] 张庭,卢迈新,叶星,等.四个奥利亚罗非鱼群体的微卫星分析[J].水生生物学报,2009,33(3):498-506. [21] 顾颖,郭忠宝,谷晶晶,等.大菱鲆微卫星标记的分离及其多态性位点检测[J].大连水产学院学报,2009,24(4):366-369. [22] 季晓芬,段辛斌,刘绍平,等.基于微卫星评估草鱼放流亲本对野生群体遗传多样性的影响[J].水产学报, 2018, 42(1):10-17. [23] 刘奇.大泷六线鱼(Hexagrammosotakii)生物学特征与遗传多样性研究[D].山东:青岛海洋大学,2010. [24] Liewlaksaneeyanawin C, Ritland C E, El-Kassaby Y A, et al. Single-copy,species-transferable microsatellite markers developed from loblolly pine ESTs[J]. Theor Appl Genet, 2004, 109: 361-369. [25] Chen S L,Miao G D,Shao C W, et al. Isolation and characterization of polymorphic microsatellite loci from fat greenling (Hexagrammosotakii) [J]. Conserv Genet, 2009,10:1429-1431. [26] 张锐, 孙美榕, 林洽辉,等. 鱼类基因组DNA提取方法的优化及PCR扩增[J]. 水生态学杂志, 2006, 26(4):7-9. [27] Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals[J]. Genetics, 1978, 19: 583-590. [28] Botstein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms.[J]. Am J Hum Genet, 1980, 32(3):314-331. [29] 季维智, 宿兵. 遗传多样性研究的原理与方法[M]. 杭州:浙江科学技术出版社,1999. [30] Nei M,Maruyama T,Chakraborty R. The bottleneck effect and genetic variability in populations [J]. Evolution,1975,29:1-10. [31] Slatkin M. Gene flow and the geographic structure of natural populations[J]. Science, 1987,236: 787-792. [32] 孙诗萌, 安百胜, 蔡明城,等. 大泷六线鱼不同群体的形态差异分析[J]. 水产学杂志, 2015, 28(4):6-11. [33] 李莹, 王伟, 孟凡平,等. 利用线粒体DNA控制区部分序列分析不同地理群体大泷六线鱼遗传多样性[J]. 海洋科学, 2012, 36(8):40-46. [34] 马波,姜作发.乌苏里江2种细鳞鲑种群遗传多样性及亲缘关系的微卫星分析[J].中国水产科学,2007,14(1):39-45.2.5 聚类分析



3 讨论
3.1 群体的遗传多样性
3.2 群体的遗传分化
4 结论
