北黄海慢原甲藻形态结构与腹泻性贝类毒素组成
2018-06-28勾玉晓刘磊李冬梅梁玉波
勾玉晓,刘磊,李冬梅,梁玉波*
(1.大连海洋大学水产与生命学院;2.国家海洋环境监测中心:辽宁 大连116023)
腹泻性贝类毒素(diarrhetic shellfish poisoning,DSP)是由海洋有毒微藻等产生的富集于贝类体内的一种生物毒素,人类食用后会出现腹泻等中毒症状。该毒素在全球沿岸海域广泛分布,其主要成分是大田软海绵酸(okadaic acid, OA)毒素。OA毒素最初是从软海绵(Halichondriaokadaii与H.melanodocia)中分离出来的[1],后来发现海洋底栖性原甲藻(Prorocentrum)是大田软海绵酸的主要来源,海洋底栖性原甲藻主要有利马原甲藻(P.lima)[2]、凹形原甲藻(P.concavum)[3]、P.hoffmannianum[4]、P.maculosum[5]、P.belizaanum[6]和慢原甲藻(P.rhathymum)[7-8]等。海洋底栖性原甲藻大都具有毒性,这也是每当发现底栖原甲藻类新种时,便被标识为 “潜在有毒种”的原因[9]。原甲藻的传统分类和鉴定主要以细胞形状、细胞大小、甲片表面形状及样式、间插板形态以及鞭毛孔板的形态及排列样式等为依据[10-11]。但仅凭形态学分类时常难以区分原甲藻的种类形态特征,分子遗传学就是一种有效的辅助手段,现已得到广泛的应用。
慢原甲藻(P.rhathymum)在热带和亚热带海域较为常见,在中国、美国、科威特、马来西亚等海域均有报道[7-8,12-13]。1992年4月,在美国的拉巴斯城加利福尼亚湾首次报道了慢原甲藻产生的赤潮现象[10],赤潮海域牡蛎肠道和鳃部均发现了大田软海绵酸中毒的病理学症状[14]。目前,慢原甲藻的毒素组成特征已有一些研究。1987年,在慢原甲藻的提取物中发现了具有溶血活性的物质[15],还可产生一系列脂溶性毒素,包括螺环内酯毒素(spirolides)、江鳐毒素(pinnatoxins)和环亚胺毒素(gymnodimine)[16]。而后,在慢原甲藻中检测出了腹泻性贝类毒素(DSP)的主要成分——大田软海绵酸[7-8]。
早期报道中认为可产生腹泻性贝类毒素的底栖类甲藻,如P.lima,主要分布于热带,且北黄海腹泻性贝类毒素的主要产毒藻为鳍藻[17]。本研究旨确定来自北黄海的慢原甲藻分类地位及其毒素组分,以期丰富北黄海贝类毒素信息。
1 材料与方法
1.1 样品收集
2013年9月,在北黄海长山群岛獐子岛海域(39°14′57″N,122°34′44″E)用采水器采集海水样品,水温为21 °C,盐度为28。取1 L用于形态学观察及计数,用5%的戊二醛(V/V)固定,放于1 L样品瓶中。分离微藻的样品用两个洁净的1 L锥形瓶收集,并用低温箱保存运回实验室。将来自样品采集海域的新鲜海水用0.25 μm针头式滤膜过滤后放入96孔板细胞培养板中,每孔放入一个分离出的微藻单细胞。装有微藻的细胞培养板用封口膜密封,放入光照培养箱(上海一恒科学仪器有限公司)中培养并每天观察细胞情况,待细胞增长至每孔10个细胞,将细胞吸出至12孔细胞培养板中,最终扩增至50 mL锥形瓶中。培养条件为:光强3 000 Lx,光暗循环=12 h∶12 h(L/D),温度20 ℃[18]。
1.2 形态观察
使用光学显微镜(Nikon Elipse 80i)观察微藻细胞大体形态,再用1%荧光DAPI核型染料(V/V,Sigma-Aldrich, USA)处理微藻细胞,荧光显微镜下(Olympus IX71)观察微藻细胞核位置。固定处于指数生长期的微藻细胞,随机选取50个微藻细胞测量细胞直径。取5%戊二醛固定样品,约1 mL浓缩藻液加入1 mL 4%锇酸溶液(V/V)二次固定,用0.1 mol/L磷酸盐缓冲液及去离子水漂洗后;经系列梯度乙醇(30、50、70、80、90、95和100%)脱水,在每个梯度浸泡10 min。脱水后的样品经过临界点干燥仪处理,喷金后在扫描电子显微镜(日本JEOL JCM-6000)下观察。
1.3 核糖体18S rDNA序列分析
通过560 g低速离心收集5 mL处于指数生长期的微藻细胞,加入液氮冷冻处理。研磨5 min后,使用试剂盒(Genomic DNA,大连宝生物有限公司)提取DNA。将所提取的DNA经琼脂糖凝胶电泳检测后作为模板,对18S rRNA与ITS进行扩增,扩增引物为18SF(上游引物:5′-CCTGGTTGATCCTGCCAG-3′; 18SR下游引物:5-CCTGGTTGATCCTGCCAG-3′)和ITS4(上游引物:5′-TCCTCCGCTTATTGATATGC-3′;下游引物:5′-GGAAGTAAAAGTCGTAA CAAGG-3′)[19]。PCR反应体系共50 μL,包括25 μL Takara Premix TaqTM,上下游引物各0.5 μL,2 μL DNA模板,用去离子水定容至50 μL。PCR反应条件为94 ℃预变性5 min; 94 ℃变性30 s, 55 ℃退火30 s, 72°C延伸2 min,共40个循环; 72°C延伸10 min[19-20]。将PCR产物送于宝生物工程(大连)有限公司进行测序,将测序结果应用Genbank上的BLAST软件,将来自北黄海的慢原甲藻的ITS rDNA序列与GeneBank数据库中慢原甲藻数据库进行比对,使用MEGA 3.0软件构建分子生物学进化树。
1.4 毒素提取
收集600 mL摇匀藻液,1 000 g 4 ℃离心20 min,去上清后将剩余的微藻细胞残渣用2 mL 100%甲醇提取2次,合并提取液,再用甲醇定容至4 mL。取 1 mL上述提取液,用0.45 μm针头式滤膜(Minisart-plus GF syringe filters, Sartorius)过滤,放入色谱瓶待测。为了验证OA毒素酯类同系物的存在与否,需在上机检测之前对样品进行碱性水解,操作步骤如下:取1 mL上述甲醇溶液样品于色谱瓶中,加入125 μL 2.5 mol/L NaOH溶液,放入76 °C恒温箱,40 min后取出并冷却至室温,加入125 μL 2.5 mol/L HCl溶液中和样品,最后用0.45 μm滤膜过滤至色谱瓶中待测[21]。
1.5 液相色谱-质谱联用分析
采用液相色谱-串联质谱法(LC-MS/MS)分析检测毒素。使用仪器为液相色谱仪(Dionex Ultimate 3000, USA),配有TurboV型电喷雾离子源(Applied Biosystems, USA)的质谱检测器(API4000, USA)。进样量10 μL,柱温箱温度40 °C。色谱条件设置为:以0.05%的氨水(V/V)为流动相A,0.05%的氨水(V/V)溶入90%的乙腈溶液(V/V)为流动相B,流速设置为0.4 mL/min。梯度洗脱程序为:10 min内从10% B相升至90% B相,保持3 min后,再在2 min内从90% B相减少到10% B相,最后恢复至初始状态。使用X-Bridge C18(3 μm ×150 μm, 3.5 μm, Waters Corporation, USA)色谱柱。质谱检测时,首先使质谱仪处于阴离子多反应检测(multiple reaction monitoring, MRM)模式,以每种毒素的[M-H]-型离子为母离子,特征碎片离子为子离子进行分析,每个成分的驻留时间为100 ms,具体的MRM参数条件如表1。其余参数设置如下:幕帘气12 psi;离子喷雾电压4 500 V;离子源温度600 ℃;雾化气13 psi,用分析软件(AB science version 1.5.2, USA)对数据进行分析。
2 结果与分析
2.1 形态特征
在普通光学显微镜下,来自北黄海的慢原甲藻呈椭圆形或卵圆形,显黄褐色(图1a—c)。在荧光显微镜下,可观察到细胞前端有一个明显的细胞核(图1d),处于细胞前半部分位置。沿着细胞长轴可观察到一个类似巨核的区域结构,当细胞处于衰亡期时,该结构较早期细胞的要长,这可能与细胞分裂有关。观察到细胞呈纵向二分裂。在扫描电子显微镜下,慢原甲藻甲片表面光滑,分布有刺胞孔(图2a,2b),壳面前端环鞭毛区有一个凹陷结构,凹陷附近有6~7个刺胞孔,并由背脊延伸出一个小刺状板块[22-23](图2b)。两壳后面端的刺胞孔呈放射状,垂直于壳边缘的浅沟,数量基本与相关研究报道一致[10, 24-25],左壳约90个,右壳面约70个,无拟孔,而墨西哥原甲藻壳面上存在着比刺胞孔更小的孔,这也是区分慢原甲藻与墨西哥原甲藻重要的形态学依据[26]。
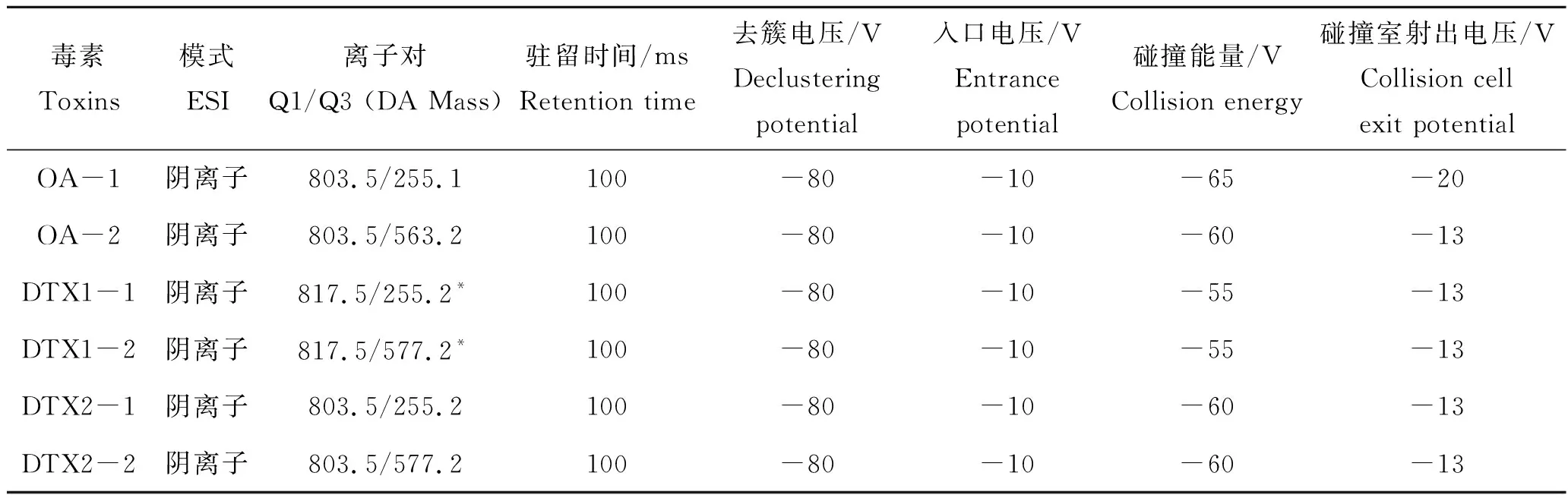
表1 毒素检测质谱参数Tab.1 MRM MS/MS parameters of each toxin
注:DTX(Dinophysis toxin)为鳍藻毒素;*为定量离子对。

图1 北黄海慢原甲藻普通光显微镜图像(a—c)和荧光 显微镜图像(d)(标尺=15 μm)Fig.1 Light microscopy(a—c) and fluorescent microscopy(d) images of Prorocentrum rhathymum isolated from North Yellow Sea, China (scale bar=15 μm)
慢原甲藻原属于热带或亚热带微藻。来自中国北黄海处于指数生长期的慢原甲藻,平均长度为(33.20±1.25) μm,宽度为(24.50±1.39) μm(n=50),细胞明显大于中国南海亚热带慢原甲藻藻株[22],与分离自韩国济州岛的慢原甲藻大小接近[27];亚热带的慢原甲藻又要比热带种个体稍大一些,处于温带的北黄海慢原甲藻比热带和亚热带的慢原甲藻个体均大一些[28-29],符合同一物种处于热带和亚热带的个体大小相对于温带和寒带要小一些的基本生物学规律。

图2 北黄海慢原甲藻扫描电子显微镜图像 右壳面观(a);左壳面观(b),标尺=5 μm。Fig.2 Scanning electron microscopy images of Prorocentrum rhathymum isolated from North Yellow Sea, China Right valve view(a); left valve view (b), scale bar=5 μm.
观察来自北黄海的慢原甲藻活体细胞发现,当浮游细胞自由运动时,两条鞭毛自由舒展,呈波纹状摆动;当鞭毛接触到小颗粒物质时,不断运动将这些物质输送到鞭毛基部附近,细胞只在固定位置“打转”。浮游细胞能够产生黏液,使自身运动速度降低,黏液在培养液中以黏液丝(图1b)和黏液泡(图1c)两种形式存在。在培养初期慢原甲藻具有很强的运动能力,在衰亡期分泌大量黏液,使其运动速度明显降低。
2.2 核糖体18S rRNA序列分析
通过对来自北黄海的慢原甲藻株藻的核糖体18S rRNA基因进行测序,序列编号为MY-2。利用NCBI数据库的核酸BLAST功能进行了序列相似性比较,发现其与P.rhathymum(EU287487)和P.tsawwassenense(EF657885)等遗传相似性最高,亲缘关系最近(图3)。Luo等[22]也证实来自中国南海的慢原甲藻藻株与P.rhathymum(EU287487)同样具有较高的遗传相似性。

图3 基于18S ITS序列的北黄海慢原甲藻藻株系统进化树Fig.3 Phylogenetic tree based on 18S ITS sequence data
2.3 毒素组成分析
取指数生长期的北黄海慢原甲藻提取液,通过液相串联质谱法(LC-MS/MS)检测腹泻性贝类毒素的主要成分,即OA和或DTX等。但结果中并未明确检出OA(RT=8.40 min)和DTX1(RT=9.18 min)组分,而是在保留时间15.36 min时发现了与DTX1的特征碎片离子对(817.5/255.2,817.5/577.2)相同的色谱峰,且空白样品对照中没有出现这一峰谱(图4)。样品经过水解后,保留时间从15.36 min漂移到15.21 min,并在14.21 min和15.21 min出现了两个新的物质峰形(图5),推测可能是DTX1的衍生物或类似物。
近些年来,随着液相质谱检测技术的快速发展,对腹泻性贝类毒素等的脂溶性海洋生物毒素的检测,均用液相串联质谱法进行毒素组分的定性和定量检测。早期研究中多用小鼠生物法检测腹泻性贝类毒素的含量,实际上只是检测了毒性,并不能确定毒素的具体组分[30-33]。
DTX1为聚醚类高分子化合物,可在贝类体内可转化成多种形式的DTX1衍生物[34]。早期报道中对DTX1衍生物的研究多以贝类为研究对象[35-36],藻类中鲜有报道[37]。腹泻性贝类毒素的主要化学成分OA、DTX1、DTX2均易与脂肪酸进行酰化反应生成一系列的衍生物,且这些衍生物也同样具有相应的腹泻毒性,但其经口服后由于在人体内的水解,毒性往往会出现延迟。早先的研究认为这些衍生物只存在于贝类体内,是相应毒素的转化产物。Suzuki等[37]曾证实了虾夷扇贝体内的DTX1的衍生物(7-O-acyl-DTX1)是由DTX1转化而来。后来这些衍生物也在某些原甲藻或鳍藻体内被检测到[38-39];Draisci等[40]成功从Dinophysisacuta中分离到了OA的衍生物并命名为DTX-2C,单离子检测扫描模式(SIM)下其与OA存在相同的碎片离子,但保留时间存在明显差异。本研究中慢原甲藻粗提液在保留时间RT=15.36 min处检测到的未知色谱峰与DTX1拥有相同的碎片离子817.5/255.2,817.5/577.2,故推断其为DTX1的衍生物的可能性较大,目前DTX1衍生物标准品匮乏[41-44],具体化学结构还需结合其他分析手段进行确认。

图4 毒素标准峰形图(a)与北黄海慢原甲藻提取液 峰形图(b)Fig.4 Chromatogram of standard OA and DTX1 (a) and chromatogram of extracts in cultured Prorocentrum rhathymum from North Yellow Sea, China(b)
3 结论
慢原甲藻是多分布于于热带或亚热带的海洋微藻,本研究以从属于温带的中国北黄海海域分离出的慢原甲藻藻株为研究对象,通过光镜、荧光显微镜和扫描电子显微镜的形态学观察并结合18S rRNA序列分析,发现该株藻与P.rhathymum(EU287487)和P.tsawwassenense(EF657885)等遗传相似性最高,确认其为慢原甲藻。通过LC-MS/MS检测该藻产生的毒素,但本研究限于毒素易于衍生化及DTX1标准品匮乏等原因未能明确慢原甲藻腹泻性贝类毒素的主要组分,只根据碎片离子对和出峰漂移时间推断其产物疑似DTX1衍生物。

图5 经过水解后北黄海慢原甲藻提取液的峰形图Fig.5 Chromatogram of cultured Prorocentrum rhathymum after alkaline hydrolysis
参考文献:
[1] Tachibana K, Scheuer P J, Tsukitani Y, et al. Okadaic acid, a cytotoxic polyether from two marine sponges of the genusHalichondria[J]. Am Chem Soc, 1981, 103(32):2469-2471.
[2] Murakami Y, Oshima Y, Yasumoto T. Identification of okadaic acid as a toxic component of a marine dinoflagellateProrocentrumlima[J]. Nsugaf, 1982, 48(1):69-72.
[3] Dickey R W, Bobzin S C, Faulkner D J, et al. Identification of okadaic acid from a Caribbean dinoflagellate,Prorocentrumconcavum[J]. Toxicon, 1994, 28(4):371-377.
[4] Morton S L, Bomber J W. Maximizing okadaic acid content fromProrocentrumhoffmannianumFaust [J]. Appl Phycol, 1994, 6(1):41-44.
[5] Zhou J, Fritz L. Okadaic acid antibody localizes to chloroplasts in the DSP-toxin-producing dinoflagellatesProrocentrumlimaandProrocentrummaculosum[J]. Phycologia, 1994, 33(6): 455-461.
[6] Morton S L, Moeller P D, Young K A, et al. Okadaic acid production from the marine dinoflagellateProrocentrumbelizeanumfaust isolated from the Belizean coral reef ecosystem [J]. Toxicon, 1998, 36(1):201-206.
[7] An T, Winshell J, Scorzetti G, et al. Identification of okadaic acid production in the marine dinoflagellateProrocentrumrhathymumfrom Florida Bay [J]. Toxicon, 2010, 55(3):653-657.
[8] Caillaud A, de la Iglesia P, Campàs M, et al. Evidence of okadaic acid production in a cultured strain of the marine dinoflagellateProrocentrumrhathymumfrom Malaysia [J]. Toxicon, 2010,55(3):633-637.
[9] Aligizaki K, Nikolaidis G, Katikou P, et al. Potentially toxic epiphyticProrocentrum(Dinophyceae) species in Greek coastal waters [J]. Harmful Algae, 2009,8(2):299-311.
[10] Cortés-Altamirano R, Sierra-Beltrán A P. Morphology and taxonomy ofProrocentrummexicanumand reinstatement ofProrocentrumrhathymum(Dinophyceae) [J]. J Phycol, 2003, 39(1):221-225.
[11] Hoppenrath M,Leander B S. Morphology and molecular phylogeny of a new marine sand-dwellingProrocentrumspecies,P.Tsawwassenensesp.nov.(Dinophyceae,Prorocentrales), from British Columbia, Canada [J]. J Phycol, 2008, 44(2):451-466.
[12] Liang J L, Wei-Hong H E, Long C, et al.Prorocentrumrhathymum——A new record of epiphytic dinoflagellates in South China Sea [J]. J Trop Subtrop Bot, 2011, 19(1):40-44.
[13] Saburova M, Al Yamani F, Polikarpov I, et al. Biodiversity of free-living flagellates in Kuwait’s intertidal sediments [J]. Bio Risk, 2009, 3:97-110.
[14] Pearce I, Handlinger J H, Hallegraeff G M. Histopathology in Pacific oyster (Crassostreagigas) spat caused by the dinoflagellateProrocentrumrhathymum[J]. Harmful Algae, 2005, 4(1):61-74.
[15] Yasumoto T, Seino N, Murakami Y, et al. Toxins produced by benthic dinoflagellates [J]. Bio Bull-US, 1987, 172(1):128-131.
[16] Tindall D R, Miller D M, Bomber J W. Culture and toxicity of dinoflagellates from ciguatera endemic regions of the world [J]. Toxicon, 1989, 27:83.
[17] 刘述锡, 樊景凤, 王真良. 北黄海浮游植物群落季节变化[J]. 生态环境学报, 2013(7):1173-1181.
[18] 刘俏, 龙丽娟. 环境因子对慢原甲藻(Prorocentrumrhathymum)生长的影响[J]. 热带海洋学报, 2013, 32(3):93-100.
[19] Douding L U, Wang H, Huang H, et al. Morphological and genetic comparison of two strains of aProrocentrumspecies isolated from Zhejiang coastal water of China and Masan Bay of Korea [J]. Chin J Oceanol Limn, 2011, 29(4):832-839.
[20] White T J, Bruns T D, Lee S B, et al. Amplification and direct sequencing of fungal ribosomal RNA Genes for phylogenetics [M]. PCR Protocols, 1990, 38:315-322.
[21] Hu T, Marr J, Freitas A S W D, et al. New diol esters isolated from cultures of the dinoflagellatesProrocentrumlimaand Prorocentrum concavum [J]. J Nat Prod, 1992, 55(11):1631-1637.
[22] Luo Z, Zhang H, Krock B, et al. Morphology, molecular phylogeny and okadaic acid production of epibenthicProrocentrum, (Dinophyceae) species from the northern South China Sea [J]. Algal Res, 2017, 22:14-30.
[23] Hoppenrath M, Chomérat N, Horiguchi T, et al. Taxonomy and phylogeny of the benthicProrocentrum, species (Dinophyceae)—A proposal and review [J]. Harmful Algae, 2013, 27(7):1-28.
[24] 梁计林, 何伟宏, 龙超,等. 慢原甲藻——南海热带附生甲藻新记录[J]. 热带亚热带植物学报, 2011, 19(1):40-44.
[25] Fukuyo Y. Taxonomical study on benthic dinoflagellates collected in coral reefs [J]. Nippon Suisan Gakk, 1981, 47(8):967-978.
[26] Loeblich A R, Sherley J L, Schmidt R J. The correct position of flagellar insertion inProrocentrumand description ofProrocentrumrhathymumsp. nov. (Pyrrhophyta) [J]. J Plankton Res, 1979, 1(2):113-120.
[27] An S L, Jeong H J, Jang T Y, et al. Morphology and molecular characterization of the epiphytic dinoflagellateProrocentrum, cf.rhathymum, in temperate waters off Jeju Island, Korea[J]. Ocean Sci J, 2013, 48(1):1-17.
[28] 刘俏, 龙丽娟. 慢原甲藻研究进展[J]. 广东农业科学, 2012, 39(15):184-187.
[29] Sadaf G, Saifullah S M. The dinoflagellate genusProrocentrum(Prorocentrales,Prorocentraceae) from the North Arabian Sea [J]. Pakistan J Bot, 2011, 43(6):3061-3065.
[30] Prassopoulou E, Katikou P, Georgantelis D, et al. Detection of okadaic acid and related esters in mussels during diarrhetic shellfish poisoning (DSP) episodes in Greece using the mouse bioassay, the PP2A inhibition assay and HPLC with fluorimetric detection [J]. Toxicon, 2009, 53(2):214-227.
[31] Ramstad H, Larsen S A T, Shen J L. The validity of two HPLC methods and a colorimetric PP2A assay related to the mouse bioassay in quantification of diarrhetic toxins in blue mussels (Mytilusedulis) [J]. Toxicon, 2001, 39(9):1387-1391.
[32] Louppis A P, Badeka A V, Katikou P, et al. Determination of okadaic acid, dinophysistoxin-1 and related esters in Greek mussels using HPLC with fluorometric detection, LC-MS/MS and mouse bioassay [J]. Toxicon, 2010, 55(4):724-733.
[33] Draisci R, Croci L, Giannetti L, et al. Comparison of mouse bioassay, HPLC and enzyme immunoassay methods for determining diarrhetic shellfish poisoning toxins in mussels [J]. Toxicon, 1994, 32(11):1379-1384.
[34] Marr J C, Hu T, Pleasance S, et al. Detection of new 7-O-acyl derivatives of diarrhetic shellfish poisoning toxins by liquid chromatography-mass spectrometry[J]. Toxicon, 1992, 30(12):1621-1630.
[35] Lee J S, Igarashi T, Fraga S, et al. Determination of diarrhetic shellfish toxins in various dinoflagellate species[J]. J Appl Phycol, 1989, 1(2):147-152.
[36] Suzuki T, Ota H, Yamasaki M. Direct evidence of transformation of dinophysistoxin-1 to 7-O-acyl-dinophysistoxin-1 (dinophysistoxin-3) in the scallop Patinopecten yessoensis[J]. Toxicon, 1999, 37(1):187-198.
[37] Suzuki T, Beuzenberg V, Mackenzie L, et al. Discovery of okadaic acid esters in the toxic dinoflagellateDinophysisacutafrom New Zealand using liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Sp, 2004, 18(10):1131-1138.
[38] Miles C O, Wilkins A L, Hawkes A D, et al. Identification of 45-hydroxy-46,47-dinoryessotoxin, 44-oxo-45,46,47-trinoryessotoxin, and 9-methyl-42,43,44,45,46,47,55-heptanor-38-en-41-oxoyessotoxin, and partial characterization of some minor yessotoxins, from Protoceratium reticulatum[J]. Toxicon, 2006, 47(2):229-240.
[39] Fux E, Smith J L, Tong M, et al. Toxin profiles of five geographical isolates ofDinophysis, spp. from North and South America[J]. Toxicon, 2011, 57(2):275-287.
[40] Draisci R, Giannetti L, Lucentini L, et al. Isolation of a new okadaic acid analogue from phytoplankton implicated in diarrhetic shellfish poisoning [J]. J Chromatogr A, 1998, 798(1/2):137-145.
[41] Vale P. Detailed profiles of 7-O-acyl esters in plankton and shellfish from the Portuguese coast[J]. J Chromatogr A, 2006, 1128(1/2):181-188.
[42] Koe W J D, Samson R A, Van H P, et al. Mycotoxins and phycotoxins in perspective at the turn of the millennium[J]. Chem Int, 2002, 24(1):23-23.
[43] Villalba A, Reguera B, Romalde J L, et al. Molluscan shellfish safety[M]//Quilliam M A, Vale P, Sampayo M A M. Direct detection of acyl esters of okadaic acid and dinophysistoxin-2 in Portuguese shellfish by LC-MS. Spain:Conselleria de Pesca e Asuntos Maritimos da Xunta de Galicia and the Intergovernmental Oceanographic Commission of UNESCO, 2013:67-73.
[44] Furumochi S, Onoda T, Cho Y, et al. Effect of carbon chain length in acyl coenzyme A on the efficiency of enzymatic transformation of okadaic acid to 7-O-acyl okadaic acid [J]. Bioorg Med Chem Lett, 2016, 26(13):2992-2996.
