光色对红壳色中华绒螯蟹生长、摄食及体色的影响
2018-06-28左炳楠李晓东姜玉声王正光郑岩刘谞孙娜
左炳楠,李晓东,姜玉声*,王正光,郑岩,刘谞,孙娜
(1.大连海洋大学水产与生命学院,辽宁 大连 116023; 2.盘锦光合蟹业有限公司研发中心,辽宁 盘锦 124200)
多数虾蟹类生有具眼柄的复眼,其主要的神经内分泌器官分布于这一光感受器周围,光照对于视觉的影响往往会改变激素的分泌,进而产生相应的生理反应[1]。研究证实视觉调控的神经内分泌器官可控制真皮层色素细胞和色素体的形态变化,从而可在短时间内改变体色[2]。斑节对虾(Penaeusmonodon)在暗背景下饲养的会比在亮背景中饲养的体色更红[3]。青壳克氏原螯虾(Procambarusclarkii)在水温为28.0~30.0 ℃、无遮蔽物条件下饲养30 d 后,体色由青色转为红色;在18.0~20.0 ℃且有遮蔽物条件下体色仍保持为青色,这表明光照和高温可诱导其向红壳色转变[4]。
自然界中也常可以见到虾蟹类体色多态现象,有别于上述情况,其分化的体色并不在短期内形成,而是可遗传的表型性状[5]。基于体色性状的人工选育研究已在鱼类、贝类和棘皮动物等经济水产动物中有报道[6-8],而对于虾蟹类,除了个别观赏种类有育成的品系外,仍鲜见经济虾蟹类基于体色性状育种研究的报道[9]。中华绒螯蟹(Eriocheirsinensis)俗称河蟹,是中国特色的水产经济动物,随着人工繁育与增养殖技术的进步,产业快速发展,种质保护与良种选育工作也成为了业内关注的焦点问题[10]。本课题组对经多代人工选育获得的红壳色中华绒螯蟹家系这一特殊的育种材料[11-12],进行不同颜色光照实验,探究光色对红壳色仔蟹存活、蜕壳、相残、摄食及生长的影响,旨在探讨视觉环境与蟹类体色的关系,为红壳色中华绒鳌蟹体色研究提供参考。
1 材料与方法
1.1 实验仪器和材料
1.2.1 仪器
培养皿,电子天平(纪铭,JM-A),照度计(上海精密,ZDS-10W-2D),温度计,游标卡尺(三量,111-101),溶氧仪(YSI,550A),数码相机(华为P8 Max,中国)。
1.2.2 材料
实验用红壳色和正常壳色中华绒螯蟹仔蟹取自辽宁盘锦光合蟹业有限公司研发中心,各100只,其头胸甲宽为(2.0±0.3)cm,体质量为(3.0±0.7)g。所用饵料为鲜活凡纳滨对虾(Litopenaeusvannamei)。
1.2 实验方法
1.2.1 实验分组与管理
因为虾蟹类体色与背景明暗度有关[13],本研究在保持光强一致时,探讨光色对红壳色和正常壳色仔蟹体色的影响,因此在长、中、短波长范围内选择红、绿、黄、白、蓝5种代表性的光色进行实验。
实验设置红、绿、黄、白、蓝5种颜色光照组,每组2个平行。饲养实验在长方形水槽(66.0 cm×46.0 cm×36.0 cm)中进行,水深15.0 cm,每个水槽饲养10只仔蟹,雌、雄比例为1∶1。光源为LED灯(3.0 W),通过调整灯头到水面的距离,将每个水槽水面上方的光照强度调整为(1 800.0±50.0)Lx。水槽中设置1个充气石(3.5 cm×3.0 cm)与少量透明网状遮蔽物,整个水槽用不透光布遮盖。
饲养实验持续35 d,每天早晚各投喂虾肉一次,投
喂后12 h收集残饵,通过测定饵料吸水率,计算摄食量。早上虹吸法排污1次,每3天换水1/2。保持水中溶解氧(6.0±1.0)mg/L,水温(24.0±1.0)℃。光照周期为14 h∶10 h (L∶D)。每周测定全部实验仔蟹的头胸甲长(mm)、甲宽(mm)、甲高(mm)和体质量(g)等生长指标,统计每组仔蟹的存活数与蜕壳数。
1.2.2 仔蟹壳色的测定
实验采用色调-饱和度-亮度(HSB)模型对蟹壳颜色进行评价(图1),其中H为色调(°),S为饱和度(%),B为亮度(%)[14-16]。每周进行拍照,记录仔蟹壳色时,由各组取4只仔蟹置于自制的无影摄影箱中,将数码相机固定于样品上方30.0 cm处,确保可以拍摄仔蟹头胸甲的全部区域,结合蜕壳记录,选择蜕壳前和后3 d的照片进行比较分析。图像分析采用Adobe Photoshop CS6 (美国Adobe)软件,设置取样框像素为11×11。仔蟹头胸甲分为4个区域进行测量,如图2所示,最后以各指标的平均值±标准误表示。
1.2.3 数据计算与分析
吸水率X(%)=(M1-m)/m×100
式(1)
日摄食量F(g/d)=m-M2(1-X)+m-
M3(1-X)
式(2)
体质量特定生长率(special growth rate)
式(3)
头胸甲特定生长率(special growth rate)
式(4)
日摄食率(feed intake)
式(5)

图1 色调-饱和度-亮度(HSB)颜色模型[17]Fig.1 The model of hue, saturation and brightness (HSB)[17]
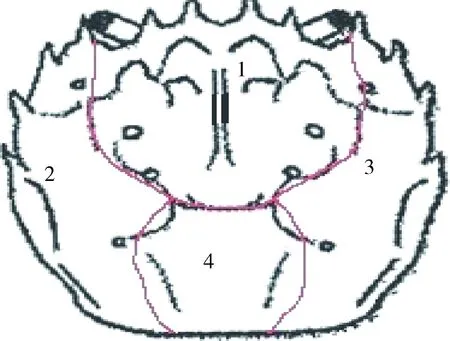
图2 中华绒螯蟹甲壳测量分区 1~4为壳色测定的4个区域。Fig.2 The measured sections on carapace of a Chinese mitten crab E. sinensis 1—4 section refers to meaured sections.
食物转换化率(feed conversion efficiency)
式(6)
成活率(%)=试验结束时存活个体数/初始时
个体数×100
蜕壳率(%)=蜕壳仔蟹数/初始仔蟹数×100
致残率(%)=蜕壳致残个体数/试验开始时个
体数×100
式(1)~ (6)中:X为虾肉的吸水率,m为初始质量(g),M1为吸水12 h后虾肉质量(g),F为日摄食量(g),M2为白天投喂12 h后剩余虾肉的质量(g),M3为晚上投喂12 h后剩余虾肉的质量(g),W1、W2分别是初始和结束时中华绒螯蟹仔蟹的平均质量(g),L1、
L2分别是试验初始和结束时仔蟹的头胸甲宽(mm);t为实验时间(d)。
所有实验结果用平均值±标准误差表示,使用SPSS 20.0(IBM, 美国)进行单因素方差分析,Duncan多重比较分析,差异显著性水平设为0.05。
2 结果与分析
2.1 不同颜色光照对两种壳色仔蟹生长的影响
不同颜色光照中两种壳色仔蟹存活率不同,如表1所示。红壳色仔蟹存活率在绿光(50.00%)与白光(25.00%)的影响下相差一倍,且差异显著(P<0.05)。正常壳色仔蟹黄光组的最高(50.00%),红光组与蓝光组存活率(30.00%)最低,黄光组、绿光组与红光组、白光组、蓝光组差异显著(P<0.05)。红壳色仔蟹红光、绿光和蓝光组的存活率高于正常壳色仔蟹对应光色组,但差异不显著(P>0.05)。
两种壳色中华绒螯蟹仔蟹不同光色组的蜕壳率不同(表1)。红壳仔蟹蜕壳率在红光(65.00%)与绿光(60.00%)中显著高于其他3组(P<0.05),说明红光和绿光能促进仔蟹蜕壳;正常壳色仔蟹蜕壳率在黄光(60.00%)与红光(30.00%)影响下相差一倍且差异显著(P<0.05),说明光照颜色影响蜕壳。红壳色仔蟹红光、绿光组的蜕壳率显著高于同光照组正常壳色仔蟹(P<0.05)。
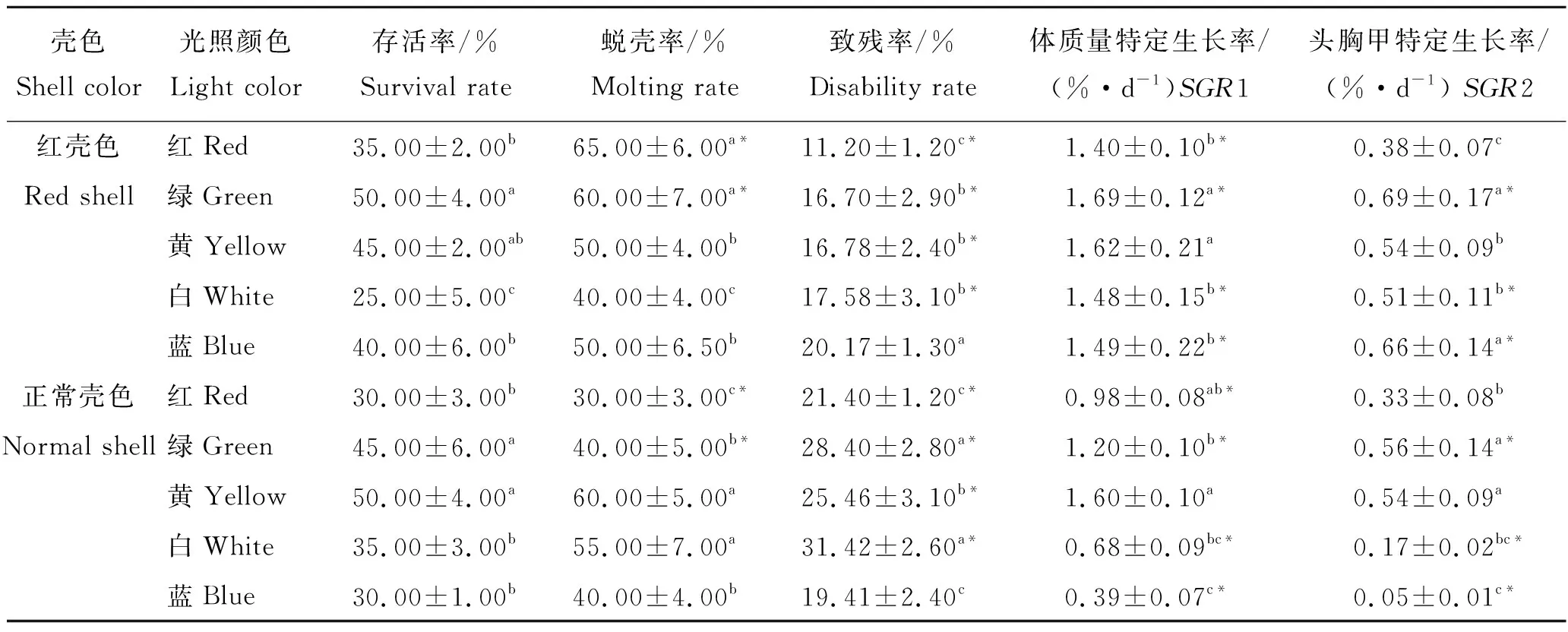
表1 不同颜色光照对两种壳色中华绒螯仔蟹生长的影响Tab.1 Effects of different color light on growth performance of two shell color juvenile crab E. sinensis
注: 同列标有不同小写字母者表示组内有显著性差异(P<0. 05),标有“*”表示组间有显著差异(P<0. 05),下同。
两种壳色中华绒螯蟹仔蟹在不同颜色光照中均存在相残现象。红壳色仔蟹致残率在红光中(11.20%)显著低于其他4组(P<0.05),说明红光中可降低仔蟹致残率。正常壳色仔蟹白光组的致残率最高(31.42%),蓝光组最低(19.41%),且白光组显著高于其他各组(P<0.05)。除蓝光组外,各颜色光照中正常壳色仔蟹致残率均高于红壳色仔蟹,正常壳色仔蟹相残性要高于红壳仔蟹,其中白光组的致残率比红壳色仔蟹高78.72%,且差异极显著 (P<0.01)。
红壳色仔蟹绿光组的SGR1(1.69%/d)、SGR2(0.69%/d)均大于其余4组,说明仔蟹适合在绿光生长;红光组SGR1(1.40%/d)、SGR2(0.38%/d)均小于其余4组,说明红壳色仔蟹不适宜在红光中生长。正常壳色仔蟹在蓝光组SGR1(0.39%/d)、SGR2(0.05%/d)均显著小于其余4组(P<0.05),说明正常壳色仔蟹不适宜在蓝光中生长。红壳色仔蟹各光色组SGR1、SGR2均高于正常壳色仔蟹相应光色组,说明红壳仔蟹在实验条件下其生长高于正常壳色仔蟹。
2.2 不同颜色光照对两种壳色仔蟹摄食的影响
由表2可知,红壳仔蟹FI、FCE在各光色组中无显著差异(P>0.05),说明受光照颜色影响不明显。正常壳色仔蟹在蓝光组FI(1.00%/d)显著低于其余4组(P<0.05);蓝光组FCE(10.26%)和白光组FCE(11.05%)受光照颜色影响明显,且显著低于其他3组(P<0.05),说明其摄食、食物转化受到抑制;而在黄光中FI、FCE均高于其余4组,说明其摄食、食物转化得到促进。除蓝光组外,两种壳色仔蟹各光色组FI无显著差异(P>0.05);红壳仔蟹各光色组FCE均高于正常壳色仔蟹,除黄光组外其余4组差异显著(P<0.05)。
红壳色与正常壳色仔蟹各光色组的夜间摄食占比均高于白昼,但各组之间无显著差异(P>0.05)。由此检测,两种体色仔蟹在不同光照中均表现出一定的昼夜摄食节律,但其昼夜摄食节律受光照颜色影响不明显。
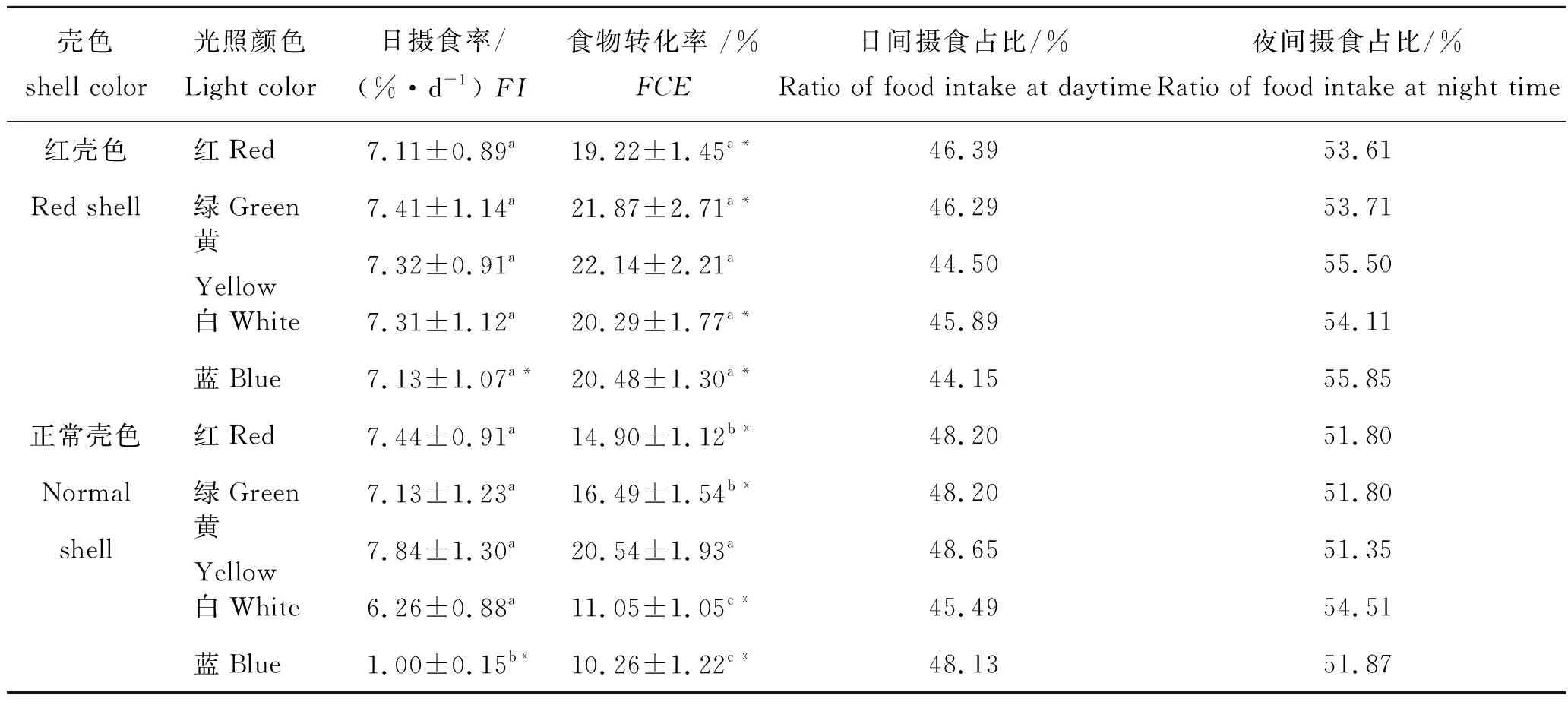
表2 不同颜色光照对两种壳色中华绒螯蟹仔蟹摄食的影响Tab.2 Effects of different color light on feeding of two shell color juvenile crab E. sinensis
2.3 不同颜色光照对两种壳色仔蟹壳色的影响
如表3所示,蜕壳前,红壳色仔蟹绿光组的H值最高(33.68°),白光组最低(11.87°),且差异显著(P<0.05);黄光组S值最高(46.62%),白光组最低(36.68%),与其他4组差异显著(P<0.05);黄光组B值最高(49.63%),白光组最低(39.68°),两组间差异显著(P<0.05),其余各组间无显著差异(P>0.05)。蜕壳后,红壳仔蟹蓝光组的H值最高(20.00°),红光组最低(8.26°),两组间差异显著(P<0.05);黄光组S值最高(31.18%),绿光组最低(14.00%),黄光、红光、蓝光组与白光、绿光组差异显著(P<0.05);绿光组B值最高(31.00%),黄光组最低(20.50%),绿光、白光、蓝光组与黄光组差异显著(P<0.05)。因此,红壳仔蟹蜕壳前、后体色变化明显(表3、图3)。根据HSB颜色模型,色调H越靠近0点红色加深,饱和度S越高色彩越强烈,亮度B越高色彩越明亮。蜕壳后红壳色仔蟹红光、绿光、黄光组的H值降低,红色加深,白光、蓝光组H值上升,红色变浅;各组S值和B值减小,体色变浅,变暗(图3)。
蜕壳前,正常壳色仔蟹黄光组H值最高(29.00°),蓝光组最低(6.50°),且显著低于其他各组(P<0.05);绿光组S值最高(40.43%),蓝光组最低(8.50%),两组差异显著(P<0.05);绿光组B值最高(42.81%),红光组最低(22.93%),两组差异显著(P<0.05)。蜕壳后,正常壳色仔蟹在黄光组H值最高(67.18°),白光、蓝光组最低(0.00°),与其他3组差异显著(P<0.05);红光组S值最高(11.19%),白光、蓝光组最低(0.00%),差异显著(P<0.05);黄光组B值最高(40.88%),绿光组最低(20.31%),黄光组与其他各组差异显著(P<0.05)。正常壳色仔蟹在红光、绿光、黄光组的H值上升,红色变浅,白光、蓝光组H值下降,红色加深;各光照组S值均下降,体色变浅;红光、黄光组B值上升,体色变亮;绿光、白光、蓝光组B值下降,体色变暗(表3、图3)。

表3 不同颜色光照对中华绒螯蟹仔蟹壳色的影响Tab.3 Effects of different color light on the shell color of juvenile crab E. sinensis
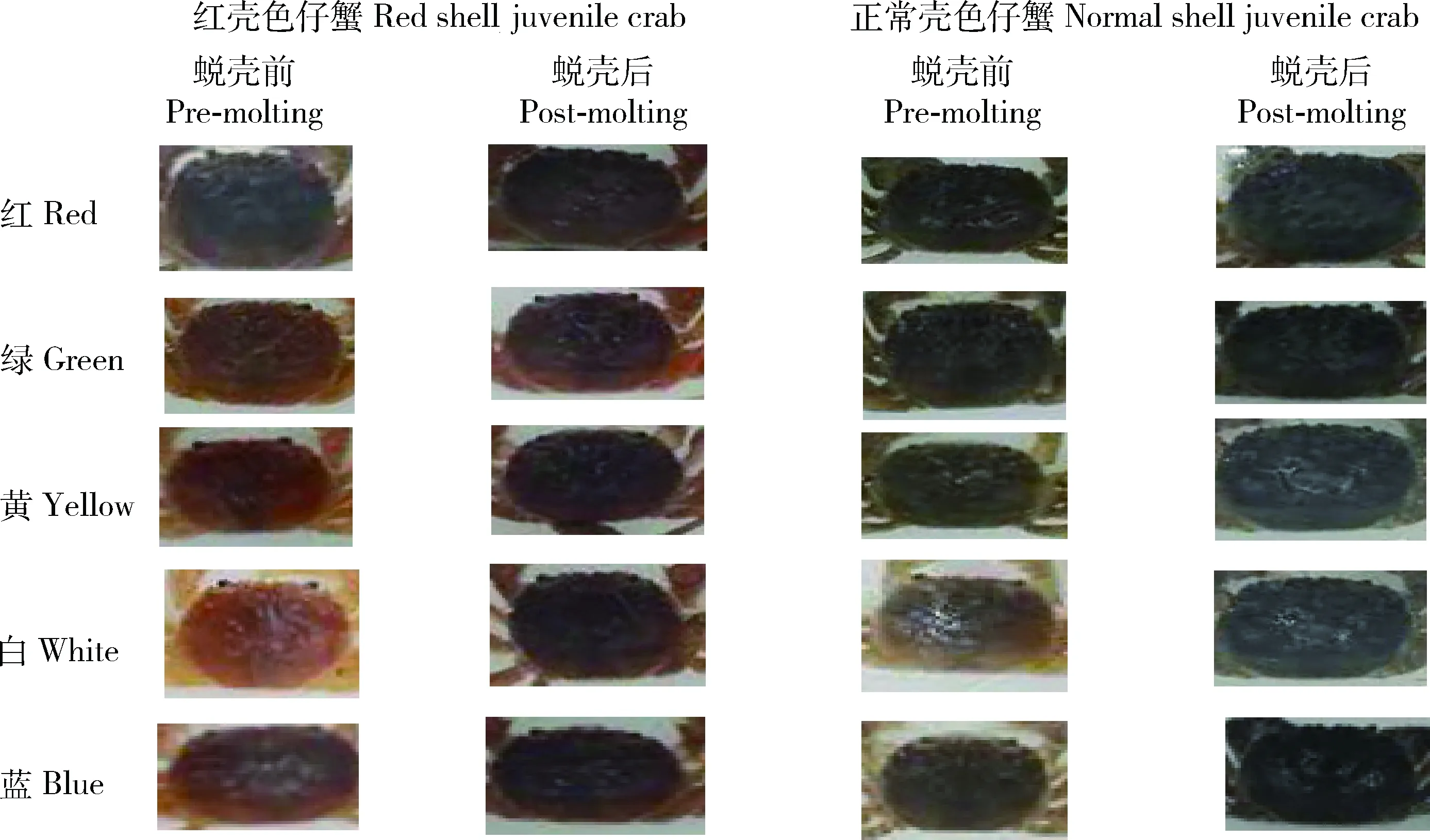
图3 不同颜色光照中中华绒螯蟹仔蟹蜕壳前后体色的比较Fig.3 Comparison on the shell color of pre-and post-molting juvenile crab E. sinensis in different color light
3 讨论
3.1 光照颜色对两种壳色仔蟹的存活与生长的影响
光照作为水生动物生存环境中重要的生态因子之一,影响水生动物的个体发育、存活、生长和繁殖等生理活动[18-19]。光照颜色对甲壳动物行为及生理活动的影响已有报道,但其结果因种类不同而有差异。日本沼虾(Maacrobroachiumnipponense)在红光下摄食最活跃[20]。蓝光向黄光或绿光有节律的转换会促进凡纳滨对虾(Litoplenaeusvannamei)的生长[21]。三疣梭子蟹(Portunustrituberculatus)在红色光照下趋光明显,而黄光中趋光减弱[18]。本研究中不同颜色光照对两种壳色仔蟹的存活、生长均有影响。红壳色仔蟹红光、绿光和蓝光组的存活率高于相应光色组正常壳色仔蟹;除蓝光组外,各颜色光照组红壳色仔蟹致残率均低于正常壳色仔蟹。仔蟹的死亡多出现于蜕壳前后,主要表现为蜕壳过程死亡,或蜕壳后被其他个体残食,其中以相残导致的死亡为主。实际观察中也发现红壳色仔蟹活跃程度较正常壳色仔蟹低,喜好长时间静止,与前期研究结果相一致[11],这也是前者相残率低的原因。研究表明,蟹类的视觉系统存在两种颜色敏感型感光蛋白,一种对紫色-紫外线敏感,另一种对蓝绿-绿光敏感[22]。陈明卫等[23]的研究也发现,中华绒螯蟹自溞状幼体至大眼幼体均对蓝光表现出明显的趋向性。视觉系统的差异可能是导致不同光色组仔蟹行为与生长表现不同的根本原因。而红壳色中华绒螯蟹更有可能因其异常体色引起视觉相关色素代谢的变异,进而导致其在不同光照颜色与正常仔蟹不同的生长表现。红壳色仔蟹在红光中蜕壳率最高,相残率最低,而正常壳色仔蟹在黄、绿光中的生长表现较好,日后可以通过优化养殖环境的光照条件,减少仔蟹的相残,促进生长。
3.2 光照颜色对两种壳色仔蟹摄食的影响
虾蟹类动物在长期的进化过程中形成了对特定水环境的适应性,自然光照节律的变化及水体中藻类、有机物、悬浮颗粒等在不同水层中营造出适合其生长的光照环境[24]。不同颜色光照会影响虾蟹类的摄食行为,改变其能量分配模式,最终对蜕壳、生长及其他生理机能产生影响[18]。本研究中正常壳色仔蟹在蓝光中的摄食率与生长率明显低于其他各实验组,表明蓝光对其生理功能具有干扰效应。研究表明,虾蟹类代谢能在能量分配中占有较大的比例,其决定了生长能的积累[25]。实际观察也发现蓝光中仔蟹活动量大,增加了呼吸代谢的能量消耗,其生长则受到了影响。中国明对虾(Fenneropenaeuschinensis)在蓝光中的呼吸代谢耗能也明显升高[26],这一现象是否与虾蟹类特殊的视觉机理相关仍有待深入研究。红壳色仔蟹各光色组的食物转化率与体质量特定生长率均高于相应组的正常壳色仔蟹,这一结果符合其能量代谢规律。然而,与正常壳色仔蟹不同,红壳色仔蟹在不同颜色光照中的摄食与生长并无明显的差异,没有表现出特异的反应。两种壳色颜色视觉的差异仍有待分子水平的研究。
3.3 光照颜色对两种壳色仔蟹体色的影响
本研究利用基于HSB模型的图像分析技术,从视觉与数据上区分光照颜色对中华绒螯蟹仔蟹体色的影响,实现体色的数据量化。拍照时光线、温度、设备特性、人为操作等因素都会对照片色彩产生影响,因此拍摄照片过程中必须采用降噪处理[27]。实验采用自制无影拍摄箱,通过设置顶灯、底灯,以及反光板等设施实现无影拍摄,同时配备固定焦距的相机,避免了自然光照及人工调焦对拍摄的影响。 Wade等[13]运用基于人类颜色视觉的L*a*b(Lab)模型研究了斑节对虾的体色,发现在暗背景中饲养的斑节对虾体色较比亮背景深。相对于Lab模型,色调-饱和度-亮度(HSB)模型是一种数学表达色,其更接近人类色彩视觉。
虾蟹的体色取决于真皮与甲壳中虾青素含量及其结合方式。这种脂溶性类胡萝卜素色素只能通过摄食获取合成的原料,经过代谢转运至色素细胞中沉积[28]。本研究选择及处理方式一致的虾肉投喂仔蟹,以消除食物中虾青素对壳色的影响。蜕壳后红壳色仔蟹在红光、绿光、黄光组H值降低,红色加深,各组S值下降,体色变暗;而正常壳色仔蟹在红光、绿光、黄光组的H值上升,红色变浅,各组S值下降,体色变暗。红光、绿光、黄光中,两种壳色仔蟹蜕壳前、后体色变化不同,表现出其体色调控机理方面的差异。多数虾蟹类的体色会随栖息地光照、温度等环境条件,饵料中色素的种类与含量,及蜕壳、疾病等自身生理状态在一定范围内而改变[2]。自然界中也常可见到虾蟹类体色多态现象,有别于上述以色素细胞和色素体形态变化为基础的生理调控机制,它们分化的体色并不在短期内形成,而是与遗传发育水平的调控相关[5]。红壳色中华绒螯蟹的体色性状是经过多代定向选育的结果,为遗传水平上的变异,因此其体色素代谢及色素细胞调控可能与正常壳色蟹不同,而颜色视觉是否会进一步影响体色的调控还需要日后深入研究。
4 结论
不同颜色光照对两种壳色中华绒螯仔蟹生长的影响不同。绿光对红壳色仔蟹更有利于促进生长、降低致残,而黄光则对正常壳色仔蟹更有利。体质量特定生长率和致残率在两种壳色中受5种光照影响最明显。利用图像分析技术,以数字化形式描述了两种壳色中华绒螯蟹仔蟹的体色,发现红光、绿光、黄光中,两种壳色仔蟹蜕壳前、后体色变化不同。红壳色仔蟹在绿色光下适合生长发育,体色加深明显;正常壳色仔蟹在黄光下适合生长发育,在绿光中体色变黑,加深明显。说明两种壳色仔蟹体色调控机理方面可能存在差异。因此,优化养殖环境的光照条件可有助于减少仔蟹的相残,促进其存活、蜕壳、摄食和生长。
参考文献:
[1] 宁黔冀. 甲壳动物激素及其应用[M]. 北京: 化学工业出版社, 2006.
[2] Wade N M, Gabaudan J, Glencross B D. A review of carotenoid utilisation and function in crustacean aquaculture[J]. Aquaculture, 2015, 9 (2): 1-16.
[3] Tume R K, Sikes A L, Tabrett S, et al. Effect of background colour on the distribution of astaxanthin in black tiger prawn (Penaeusmonodon): effective method for improvement of cooked colour[J].Aquaculture, 2009, 296(1): 129-135.
[4] 郭风英, 周鑫, 赵朝阳, 等.2种不同体色的克氏原螯虾卵巢发育及生长特性研究[J]. 海洋湖沼通报, 2012(2):89-96.
[5] Leimar O. Environmental and genetic cues in the evolution of phenotypic polymorphism [J]. Evol Ecol, 2009, 23(1): 125-135.
[6] 孙效文.鱼类分子育种学[M].北京:海洋出版社,2010.
[7] 张跃环,闫喜武.杨凤, 等.菲律宾蛤仔(Ruditapesphilippina-rum)大连群体两种壳型家系生长发育比较[J]. 生态学报, 2008, 28(9): 4246-4252.
[8] 王国中, 杨智贤. 台湾观赏虾[M]. 上海: 展新文化事业股份有限公司, 2014.
[9] 楼允东. 鱼类育种学[M]. 北京: 中国农业出版社, 2001.
[10] 李晓东.北方河蟹养殖新技术[M]. 北京 : 中国农业出版社, 2006.
[11] 司永国,李晓东,姜玉声,等. 红壳色中华绒螯蟹仔蟹养殖方式研究[J]. 大连海洋大学学报, 2017(2): 139-144.
[12] 姜玉声.辽宁沿海虾蟹类与增养殖[M]. 沈阳: 辽宁科学技术出版社, 2015.
[13] Wade N M, Anderson M, Sellars M J, et al. Mechanisms of colour adaptation in the prawnPenaeusmonodon[J] .J Exp Biol,2012, 215(2): 343-350.
[14] 文东, 崔炜, 漆杰峰. Photoshop CS3平面设计基础与项目实训[M]. 北京: 北京科海电子出版社, 2009.
[15] 杨灿朝,梁伟.通过光谱与视觉模型研究动物体色[J].动物学研究, 2013, 34(6):564-573.
[16] Wade N M, Melville-Smith R, Degnan B M, et al. Control of shell colour changes in the lobster,Panuliruscygnus[J]. J Exp Biol, 2008, 211(9): 1512-1519.
[17] Yasir I, Qin J G. Effect of light intensity on color performance of false Clownfish,AmphiprionocellarisCuvier[J]. J World Aqua Soc, 2009(3): 337-350.
[18] 王馨. 光照对三疣梭子蟹行为、呼吸代谢和生长影响的研究[D]. 青岛:中国海洋大学, 2014.
[19] 刘涵,姜玉声,栾攀,等.不同颜色光照对日本蟳摄食与生长的影响[J]. 大连海洋大学学报, 2012, 27(6): 528-533.
[20] 郁桐炳, 唐渝, 尤洋, 等. 5 种波长光对日本沼虾人工育苗幼体成活率的影响[J]. 湛江海洋大学学报, 2004, 24 (4): 5-9.
[21] Guo B, Mu YC , Wang F, et al. Effect of periodic light color change on the molting frequency and growth ofLitopenaeusvannamei[J]. Aquaculture, 2012,362/363(9):67-71.
[22] Porter M L,Cronin T W, McClellan D A, et al. Molecular characterization of crustacean visual pigments and the evolution of pan crustacean opsins [J].Mol Bio Evol, 2007, 24(1): 253-268.
[23] 陈明卫,高维玉,姜玉声, 等.光色对中华绒螯蟹幼体诱集与仔蟹摄食的影响[J].大连海洋大学学报,2016(4):362-367.
[24] 褚衍亮. 不同光照条件对日本沼虾Macrobrachiumnipponense复眼结构的影响[D]. 杭州: 浙江大学, 2002.
[25] 张胜负, 蒋科技, 顾孝连, 等. 光照强度对拟穴青蟹幼体生长及能量收支的影响[J]. 海洋渔业, 2011, 33(2): 187-194.
[26] 王芳. 光照对中国明对虾(FenneropenaeusChinensis)生长的影响及其机制[D]. 青岛: 中国海洋大学, 2004.
[27] 张云, 杨宏伟, 罗克勇.中华绒螯蟹蟹壳颜色的识别量化研究[J]. 江苏农业科学, 2005(6):115-117.
[28] 龚志, 伊淑平, 孔丽,等.3种类胡萝卜素源对中华绒螯蟹体色改善效果的比较研究[J].动物营养学报, 2014, 26(8): 2408-2413.
