四溴联苯醚慢性胁迫对大泷六线鱼血液生化指标的影响
2018-06-28张赛赛姜欣彤王伟董安然
张赛赛,姜欣彤,王伟*,董安然
(1.大连海洋大学水产与生命学院,辽宁省北方鱼类应用生物学与增养殖重点实验室;2.大连市水产技术推广总站:辽宁 大连 116023)
多溴联苯醚(polybrominated diphenyl ethers,PBDEs)是一种添加型阻燃剂,由于其具有良好的阻燃性能,被广泛地应用于纺织、橡胶、塑料、电子、化工等生产领域中,其理化性质与多氯联苯相似,是一种普遍存在的潜在持久性有机污染物[1]。PBDEs化学结构稳定,具有亲脂性和食物链富集等特点。近年来,因各种环境介质中以及人体和生物材料中频频检出PBDEs,且含量不断增加,所以引起了更大的关注[2]。四溴联苯醚(tetra-brominated diphenyl ethers,BDE-47),属于PBDEs同系物。虽然在商业中的生产和使用较少,但生物对其的吸收速度大于其他PBDEs,是存在于环境样本和人体组织中最主要的PBDEs同系物之一[3-4]。 目前关于BDE-47毒性的研究主要集中在哺乳动物的胚胎毒性、生殖毒性、甲状腺毒性、神经毒性和内分泌干扰毒性等方面[5-6],在水生生物毒性研究方面,Jin等[7]和Shao等[8]分别发现BDE-47对虹鳟性腺组织细胞和鳃上皮细胞有毒性及损伤作用,但关于BDE-47对水生动物血液生化和免疫指标的影响尚未有明确清晰的认识,也缺乏体内作用机制等深入系统的毒理效应的研究,因此有必要丰富BDE-47对水生生物毒理效应的相关研究。
大泷六线鱼(Hexagrammosotakii),俗称黄鱼,隶属于鲉形目(Scorpaeniformes)、六线鱼科(Hexagrammidae)、六线鱼属(Hexagrammos),属于近海冷温岩礁性鱼类,在中国的黄海和渤海近岸常见,辽宁和山东等地的近海多岩礁海区多是其栖息地,日本、韩国和朝鲜等国的近海也有捕获记录。该鱼肉质细嫩、味美,营养丰富,被誉为“北方石斑”,是百姓喜爱的食用鱼种之一。目前,该鱼遗传多样性和繁殖生物学已获得广泛共识[9-10],但PBDEs等环境持久有机污染物对大泷六线鱼血液生化指标的研究仍未见报道。基于此,本研究探讨BDE-47慢性胁迫对大泷六线鱼血液生化指标的影响,旨在明确主要的潜在毒性指示因子,以期为其评估近海环境污染情况提供数据支持。
1 材料与方法
1.1 实验材料
实验用大泷六线鱼于2016年4月初捕捞自大连市旅顺口区近海,共获得500尾,充氧运回大连海洋大学水产与生命学院实验室。实验所用水槽为120 L的聚乙烯水槽(70 cm×40 cm×32 cm),所用海水为沉淀和过滤后的自然海水,水温(21±1)℃,盐度为32,pH值为(7.9±0.1)。BDE-47(CAS:5436-43-1,纯度为50 μg/mL)购自百灵威试剂公司,二甲基亚砜(DMSO)购自上海生工有限公司,其余试剂均购自大连沈联化学试剂玻璃仪器有限公司,所有化学试剂均为分析纯。
1.2 饲养管理
实验大泷六线鱼暂养7 d,期间不投喂任何饵料,每天换水一次,去除伤鱼和病鱼,选取健康、体长相近(18.30±1.30)cm的大泷六线鱼用于实验,分别放入120 L水槽中,进行驯养。每天投喂冰鲜野杂鱼一次,喂食后2 h换1/2体积水,驯养期为10 d。
1.3 实验方法
实验分组:待样品鱼被驯化之后,对其分组进行实验,共设置空白对照组、DMSO对照组和5个浓度梯度组,共7组,每组2个平行。实验共使用14个120 L水槽,每个水槽投放20尾实验鱼。其中,空白对照组不加任何试剂;DMSO对照组添加二甲基亚砜(DMSO),使其终浓度为25 μg/L。参考海洋环境[11]中BDE-47的浓度设置了5个浓度梯度组,分别为5 ng/L(A组)、50 ng/L(B组)、500 ng/L(C组)、5 μg/L(D组)和50 μg/L(E组)。每7天测定一次样品鱼,实验进行42 d。
将实验鱼麻醉(苯甲醇∶海水=1∶1 000,V/V)后,采用穿刺尾静脉取血法收集2 mL血液,经过前处理后,将血清分装成2份,送至大连市体检中心进行平行测定。测定的血清生化指标有血清血糖 (GLU)、总蛋白 (TP)、白蛋白(ALB)、总胆红素 (TBIL)、尿素、碱性磷酸酶 (AKP) 和乳酸脱氢酶 (LDH),共7个。
1.4 数据处理
所有实验数据以平均值±标准差 (Mean±SD,n=2) 表示,实验数据用SPSS 22.0(IBM, USA)进行处理,在单因子方差分析 (One-way ANOVA)的基础上,采用Turkey’s多重比较各组间差异,以P<0.05为差异显著。本研究使用SPSS22.0对7个生化指标进行主成分分析,通过主成分分析获得的得分图筛选出最具有代表性的指示物。
2 结果
2.1 BDE-47对大泷六线鱼血清GLU含量的影响
由表1可知,GLU值在第1、2、4周各实验组显著差异组较多,分别有6、15、10对显著差异集;第5、6周均有3对显著差异集;第3周各实验组GLU值之间差异不显著(P>0.05)。第1周B组和C组GLU值显著高于其他组(P<0.05),GLU值最高B组是最低A组的227.52%,差异显著(P<0.05)。第2周各实验组差异多样性较多,有15对显著差异集,GLU值最高出现在A组,是GLU最低B组的308.04%,差异显著(P<0.05)。第3周各实验组之间血糖值差异不显著(P>0.05)。第4周各实验组差异多样性较多,有10对显著差异集,GLU值最低出现在C组,最高出现在E组,是C组值的219.41%。第5周GLU值最高C组是最低空白对照组的1.48倍。第6周GLU值最高A组是最低值C组的1.54倍。
2.2 BDE-47对大泷六线鱼血清TP含量的影响
由表2可知,血清中TP含量在第1周各实验组显著差异较多,有10对显著差异集;第3~6周均有3对显著差异集;第2周各实验组之间差异多样性较少。第1周中DMSO组实验鱼血清中TP含量最高,是最低组B组的200.06% (P<0.05)。第2周时较高浓度BDE-47组(D组)和高浓度组(E组)实验鱼血清中TP含量显著高于其他各组(P<0.05),分别为20.55 g/L和20.14 g/L。第3周空白对照组、DMSO对照组、低浓度BDE-47A组和B组,实验鱼血清TP含量显著高于C、D和E组(P<0.05),C组TP含量显著低于各组,是最高组的69.38%,差异显著(P<0.05)。第4周不同BDE-47浓度实验组鱼血清TP含量随BDE-47浓度增加呈下降趋势。第5周实验鱼血清TP含量随浓度变化趋势与第4周相同,其中空白对照组、DMSO对照组和低浓度BDE-47组(A组)实验鱼血清TP含量较高,显著高于其他组(P<0.05);高浓度BDE-47组(E组)实验鱼血清TP含量显著低于其他组(P<0.05),最低为21.64 g/L。第6周实验鱼血清TP含量随浓度变化趋势与第5周一致。
表1BDE-47对大泷六线鱼GLU含量的影响
Tab.1ChangesofBDE-47onbloodglucoseconcentrationofHexagrammosotakiimmol·L-1

组别Groups第1周1st week第2周2nd week第3周3rd week第4周4th week第5周5th week第6周6th week空白对照组3.03±0.07d2.90±0.07bc2.58±0.25a2.45±0.13d2.45±0.11c2.72±0.18abDMSO对照组2.90±0.08d3.05±0.06b2.65±0.08a2.63±0.04cd2.55±0.16bc2.55±0.03b5 ng·L-1组2.58±0.06d3.45±0.07a2.82±0.11a2.93±0.17bc2.93±0.14bc2.95±0.10a50 ng·L-1组5.87±0.11a1.12±0.04f2.67±0.08a2.45±0.06d2.90±0.17bc2.50±0.10b500 ng·L-1组5.63±0.07a2.15±0.06e2.50±0.08a1.70±0.08e3.63±0.17a1.92±0.08c5 μg·L-1组5.08±0.23b2.58±0.16cd2.93±0.10a3.13±0.03b3.07±0.08ab2.63±0.08ab50 μg·L-1组3.83±0.17c2.27±0.14de2.97±0.11a3.73±0.13a2.98±0.17bc2.95±0.03a
注:结果以平均值±标准差(mean±SD,n=2)表示,同列上标不同字母表示差异显著(P<0.05),下同。

表2 BDE-47对大泷六线鱼TP含量的影响Tab.2 Effects of BDE-47 on the total protein content of Hexagrammos otakii g·L-1
2.3 BDE-47对大泷六线鱼血清ALB含量的影响
由表3可知,各实验组大泷六线鱼血清ALB含量随时间延长有上升趋势,但高浓度BDE-47组到第6周时实验鱼血清ALB含量显著低于各实验组(P<0.05),空白对照组是它的6.51倍。 第1、2、3、5周DMSO对照组实验鱼血清ALB含量最高。第4周空白对照组实验鱼血清ALB含量最高。第6周E组实验鱼血清ALB含量最低,其他组实验鱼血清ALB含量均高于E组,且其他组间无显著差异(P>0.05)。
2.4 BDE-47对大泷六线鱼血清TBIL含量的影响
由表4可知,实验鱼血清中TBIL值每周差异显著多样性整体较其他指标少,第1~4周各实验组差异不显著(P>0.05);第6周各实验组差异显著集为3对,多于第5周。 第5周时,DMSO对照组TBIL值显著低于其他组(P<0.05),E组TBIL值最高,剩余各组差异均不显著(P>0.05),E组TBIL值是DMSO对照组的151.32%。第6周各实验组的TBIL值随BDE-47浓度的增加呈明显的上升趋势,E组TBIL值是DMSO对照组的1.98倍,差异显著(P<0.05)。
2.5 BDE-47对大泷六线鱼血清中尿素含量的影响
由表5可知,空白对照组和DMSO对照组血清中尿素含量在每周的差异均不显著(P>0.05),说明两对照组中尿素含量在实验全过程中维持稳定;不同浓度BDE-47实验组尿素含量随时间延长呈降低趋势。第1周时D组血清中尿素含量显著低于其他实验组(P<0.05),是空白对照组尿素含量的52.31%;第2周,空白对照组血清中尿素含量显著高于不同浓度BDE-47实验组(P<0.05),空白对照组尿素含量最高是最低组D组的148.94%。第3周,两对照组实验鱼血清中尿素含量显著高于其他组(P<0.05),其他组无显著差异(P>0.05)。第4周,两对照组实验鱼血清中尿素含量显著高于其他组(P<0.05),其中C组实验鱼血清中尿素含量显著最低(P<0.05)。第5周,A组、B组和C组实验鱼血清中尿素含量显著较低(P<0.05),而两对照组实验鱼血清中尿素含量显著高于实验组(P<0.05),且最高值是最低值的2.35倍。第6周,两对照组实验鱼血清中尿素含量最高,且显著高于其他实验组(P<0.05),不同浓度BDE-47实验组间无差异。
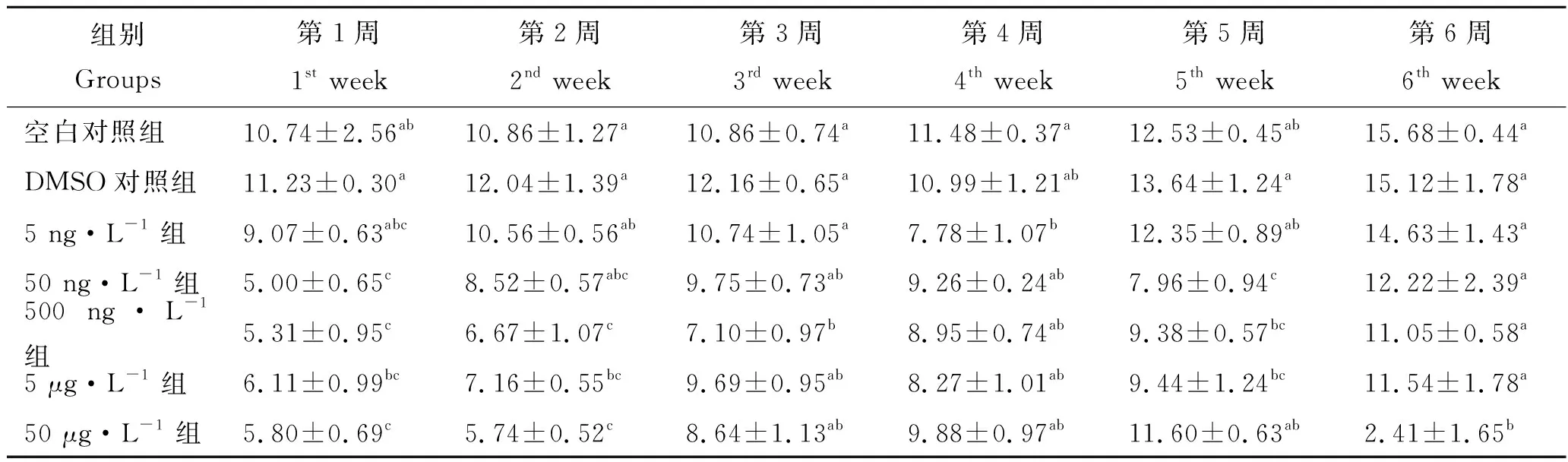
表3 BDE-47对大泷六线鱼ALB含量的影响Tab.3 Effects of BDE-47 on the serum albumin content of Hexagrammos otakii g·L-1
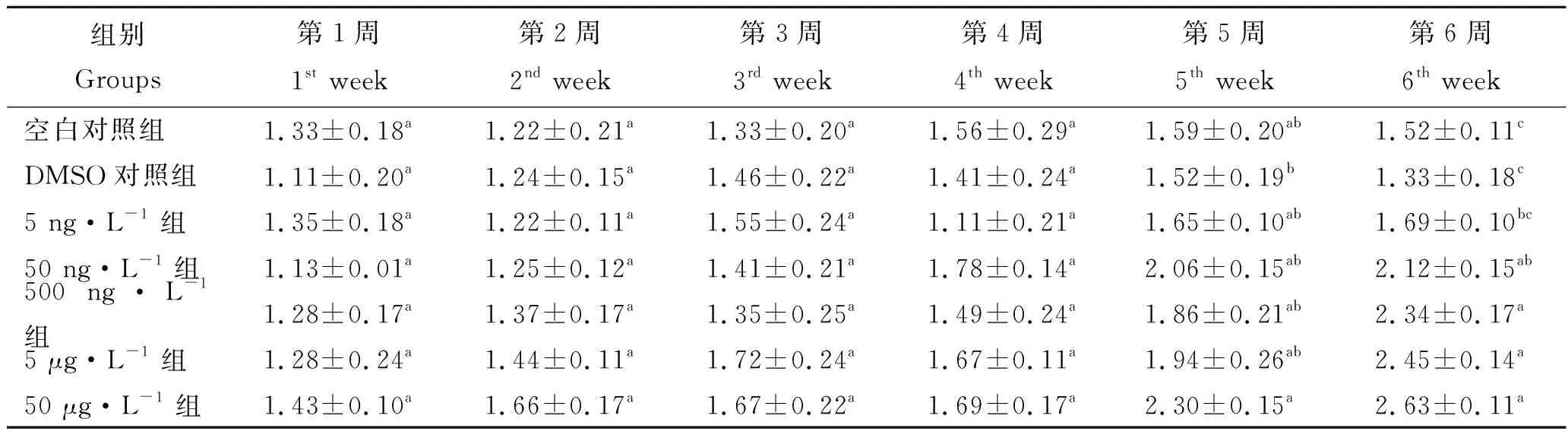
表4 BDE-47对大泷六线鱼TBIL含量的影响Tab.4 Effects of BDE-47 on serum total bilirubin concentration of Hexagrammos otakii μmol·L-1

表5 BDE-47对大泷六线鱼血清中尿素含量的影响Tab.5 Effects of BDE-47 on serum urea concentration of Hexagrammos otakii mmol·L-1
2.6 BDE-47对大泷六线鱼血清中AKP活力的影响
由图1可知,各组碱性磷酸酶随BDE-47含量的增加整体呈上升趋势。第1周,E组AKP值显著高于其他各组(P<0.05),DMSO对照组显著低于其他组(P<0.05),E组AKP值是DMSO对照组1.86倍。第2周,D组和E组AKP值显著高于其他各组(P<0.05),空白对照组显著低于其他组(P<0.05),E组AKP值最大是空白对照组2.84倍。第3周,E组AKP值显著高于其他各组(P<0.05),空白对照组显著低于其他组(P<0.05),E组AKP值最大是空白对照组2.61倍。第4周,E组AKP值显著高于其他各组(P<0.05),空白对照组和DMSO对照组显著低于其他组(P<0.05),E组AKP值最大是空白对照组1.75倍。第5周,E组AKP值显著高于其他各组(P<0.05),空白对照组显著低于其他组(P<0.05),AKP值最大E组是空白对照组2.59倍。第6周, E组的AKP值最大是空白对照组2.63倍。

图1 BDE-47对大泷六线鱼血清AKP活力的影响 结果表示为平均值±标准差(mean±SD, n=2),同组上标不同小写字母表示差异显著(P<0.05),下同。Fig.1 Changes of BDE-47 on serum alkaline phosphatase of Hexagrammos otakii The data are shown as mean±SD (n=2), with in the same group, values with the different superscripts are significantly different(P<0.05),the same below.
2.7 BDE-47对大泷六线鱼血清中LDH活力的影响
由图2可知,第3~5周各实验浓度组显著差异较多,均有6对显著差异集。第1周,不同浓度BDE-47实验组之间差异不显著(P>0.05)。第2周,D组实验鱼血清中LDH值显著高于其他组(P<0.05),D组LDH值是空白对照组的1.77倍。第3周,B组实验鱼血清中LDH值显著高于其他组(P<0.05),B组LDH值是空白对照组的3.40倍。第4周和第3周趋势一致,B组LDH值是空白对照组的1.63倍。第5周,A组和B组实验鱼血清中LDH值显著高于其他组(P<0.05),空白对照组和DMSO对照组实验鱼血清中LDH值显著低于其他组(P<0.05),A组LDH值是空白对照组的5.77倍。第6周,空白对照组和DMSO对照组实验鱼血清中LDH值显著低于其他组(P<0.05),不同浓度BDE-47实验组之间差异不显著(P> 0.05)。
2.8 实验中7个生化指标主成分分析
通过胁迫时间和暴露浓度的横纵比较分析发现:随着胁迫时间的延长,500 ng/L组对7个指标的影响最明显;随着暴露浓度的增加,第4周各指标波动最大。因此,本研究以500 ng/L和第4周为重点,通过主成分分析筛选出7个生化指标中最具有代表性的指示物。通过主成分分析(PCA)碎石图可知(图3),PCA提取出1个特征值(即GLU),且对生化指标的影响贡献率达100%,无变量的信息丢失。

图2 BDE-47对大泷六线鱼血清LDH活力的影响Fig.2 Changes of BDE-47 on serum lactate dehydrogenase of Hexagrammos otakii

图3 7个指标主成分分析碎石图 提取方法为主成分;1~7的成分分别是GLU、 TP、ALB、TBIL、尿素、AKP和LDH。Fig.3 Principal component analysis of 7 parameters in this study Extraction method is used with PCA. 1-7 represents GLU, TP, ALB, TBIL, urea, AKP and LDH, respectively.
3 讨论
3.1 BDE-47慢性胁迫对大泷六线鱼血液生化指标的影响
本实验过程中,该鱼存活率100%,说明本实验浓度下BDE-47慢性胁迫为轻度胁迫[12]。鱼类的血液指标可以反映出鱼体的营养状况、对环境的反应情况、机体的代谢情况及疾病等。当生物体受到逆境胁迫时,机体会发生生理或病理的变化,这些变化会反映在血液的生化指标上[13]。
本研究结果表明:与对照组相比,除A组外的实验组GLU浓度首先有升高趋势;随着时间的延长,各实验组GLU浓度呈下降趋势,与对照组差异显著(P<0.05),说明GLU提供机体活动所需的能量,在鱼体中GLU能够处于一种动态平衡,但容易发生变化,其高低受栖息环境、活动性、投饵等诸多因素的影响。实验组的TP和ALB先降低和或后再升高,因此依据血液指标的改变指示生物机体的功能变化,不仅可以研究环境有毒物质作用的靶器官系统,也可为阐明环境有毒物质作用机理提供有力依据[14-15]。鱼类的血液学指标也可应用于鱼病诊断和环境检测领域[16]。
TBIL主要由衰老红细胞血红蛋白的辅基血红素降解产生和由肝细胞中非血红蛋白的血红素蛋白质的辅基血红素分解产生两种代谢途径[17]。由实验结果可知(表4),第5周时,各实验组的TBIL值均显著高于空白对照组(P<0.05);第6周时,各实验组的TBIL值均显著高于空白对照组(P<0.05),原因可能是随着污染物浓度的增高和胁迫时间的延长,生物体内血液流速缓慢,运送代谢物质的能力也下降,从而导致代谢物堆积,引起TBIL值升高。
尿素作为蛋白质分解代谢的终产物,由氨基转变而来,主要由肾脏排泄。血液中尿素浓度主要受肾功能、蛋白质摄入量和分解代谢情况影响。从本研究数据可以看出(表5),从第2周开始,各实验组血清中尿素含量均显著低于空白对照组(P<0.05),这体现了血液中尿素含量的变化与总蛋白的变化是基本同步的。
AKP是生物体代谢的关键酶,是磷代谢过程中的重要酶类之一,对鱼类骨骼的钙化起着重要的作用,因而它有着重要的生物学意义。在正常情况下,血清AKP活性是很低的。本研究结果中,从第2周开始各浓度组AKP值均显著高于空白对照组(P<0.05),DMSO组也与对照组有显著差异(P<0.05),但并未找到相关文献有类似现象,有待继续研究其原因;而且D组和E组,随着胁迫时间的延长,呈现出明显的时间-效应关系,随时间延长AKP应答增强。
LDH是生物氧化的重要酶,它主要催化糖酵解过程中乳酸与丙酮酸的相互转化[18],在肝脏、心脏等多种组织器官中广泛存在。LDH是衡量组织损伤很敏感的一项指标,当组织器官出现生理或病理变化时,LDH会被释放到血液中[19]。LDH也存在于生物体的很多组织细胞中,其活性值要高出血清中的很多倍,因此当生物体受损伤时,LDH释放,相应地血清中的LDH就会明显的增多。本研究结果显示(图2),从第3周开始,各实验组LDH值均显著高于空白对照组和DMSO对照组(P<0.05),这与上述的研究结果一致。
3.2 BDE-47慢性胁迫对大泷六线鱼肝脏的影响
肝脏是生物体重要的代谢、解毒器官之一,承担机体内多种代谢活动,是代谢有毒物质的主要器官。当鱼体受到污染物胁迫时,肝脏对污染物进行代谢,同时会有一系列的应答反应。长时间或者高浓度物质胁迫时肝脏无法完全代谢掉有害因子,因此会对肝脏造成一定的影响。肝功能变化可以体现在血液生化指标中,比如TBIL、TP和ALB等。
肝脏细胞具有超强的摄取TBIL的功能,血液中的TBIL经肝细胞不断地摄取、结合、转化及排泄,最终被及时清除。因此,临床医学上通常用它作为诊断肝脏疾病或胆道是否发生异常的重要参考指标之一[20]。第5周时,其他各实验组TBIL值高于空白对照组但不显著;第6周除外,各实验组的TBIL值均显著高于空白对照组(P<0.05)。原因可能是胁迫时间延长,实验鱼体质下降血液流速变缓慢,运送代谢物质的能力也下降,或是高浓度长时间下大泷六线鱼肝脏已受损,代谢TBIL的能力下降从而导致血清TBIL显著增高。第6周时,A组TBIL值与两对照组差异不显著(P<0.05),可能因为BDE-47浓度较低。刘迁等[21]对患有肝胆综合征草鱼的血清指标检测,发现总胆红素显著高于正常状态(P<0.05),说明鱼类肝脏受到损伤时总胆红素会升高,与本研究的发现一致。
肝功能的强弱也可以通过血清总蛋白及白蛋白的含量判定[22-24]。血清中两个指标的含量变化会反映出肝功能的受损伤程度,在诊断肝脏疾病方面起着至关重要的作用。本研究结果中各实验浓度组(除第5周A组外)的血清TP均低于空白对照组,说明BDE-47导致肝脏合成蛋白质的能力下降。TP的最低值均出现在第6周的E组(高浓度组),由此可以推测此时鱼体的肝脏合成蛋白能力已严重受损,受6周BDE-47的胁迫鱼体可能导致肝部受到严重损伤。由表2和表3可见,第6周时血清TP与ALB值随BDE-47浓度的增大呈明显降低趋势,推测可能是由于高浓度有机污染物对肝脏损伤的程度严重造成的。巩华等[25]对投喂不同剂量恩诺沙星和氯霉素鲤的研究发现,高浓度药物影响下鲤血清TP、ALB值均出现下降,停止投喂药饵5 d后两指标有回升,这与本研究结果一致。
尿素由氨基转变而来,在肝脏中通过鸟氨酸循环合成。从本研究数据(表5)可以看出,从第二周开始,各实验组血清中尿素含量均显著低于对照组(P<0.05),而在临床上,血液中尿素含量显著下降主要系肝实质性受损,生成减少所致。
在正常情况下,血清AKP活力是很低的,因此医学上把AKP活力的测定作为肝脏疾病和骨病的临床检验指标,当有肝脏病或骨病时,血清AKP活力会显著升高[26]。本研究结果中,从第2周开始各浓度组AKP值均显著高于对照组(P<0.05),而且D组和E组,随着时间的延长,呈现出明显的时间-效应关系。由此可以判定,四溴联苯醚对大泷六线鱼的肝脏造成了严重的损伤。
3.3 BDE-47慢性胁迫对大泷六线鱼潜在指示物的提取
GLU是血液中最重要的能源物质之一,是鱼类各种生命活动所需能量的直接来源。GLU的高低受机体内糖酵解和糖异生等多种方式调节,二者之间常处于动态平衡状态。当生物体受到外源刺激(如环境胁迫)时,GLU作为首要和迅速利用的能量物质被用于调动机体适应性反应,从而导致血液中GLU浓度升高[28]。许氏平鮋(Sebastesschlegelii)、花鲈(Lateolabraxmaculatus)和斜带石斑鱼(Epinepheluscoioides)受运输胁迫[29]和盐度胁迫后[30]GLU均表现先大幅度升高,而后恢复到正常范围[30];不同的是许氏平鮋在24 h、花鲈在1周、斜带石斑鱼在6 d达到峰值。这表明GLU恢复的快慢与鱼种属和环境胁迫形式有关。本研究结果也证实了受BDE-47慢性胁迫大泷六线鱼血液GLU先升高后降低。本研究中各浓度实验组(除A组外)第3周后GLU呈波动变化。可能是由于BDE-47刺激后,机体基础代谢水平升高,参与代谢BDE-47消耗能量需求增加肝糖原和肌糖原异生作用增强有关。
糖异生是生物体维持GLU平衡的重要途径,肝脏是糖异生发生的主要器官。葡萄糖-6-磷酸酶(G6Pase)和磷酸烯醇式丙酮酸羧基酶(PEPCK)是参与糖异生的关键酶。其活性与mRNA表达量因鱼的食性和种类不同而异[31]。从其他血液生化指标看,TBIL反映第5周开始不同浓度组实验鱼肝脏受到不同程度损伤,TP反映各实验组(除第5周A组外)实验鱼肝脏合成蛋白质能力下降,ALB反映各实验组实验鱼肝脏受不同程度损伤,LDH反映第3周开始肝脏出现损伤表现,AKP指标反映第2周开始肝脏出现受损表现。肝脏的损伤也可能影响了大泷六线鱼糖异生过程以及G6Pase和PEPCK的活性。本研究主成分分析提取GLU为唯一特征值,可能不仅与鱼类糖异生过程对外源刺激敏感,也可能与其他6个血液生化指标的可调节过程相对迟钝或维持自我稳态能力较强有关。基于此,GLU可用于鱼类环境污染物胁迫的潜在指示物。
4 结论
不同浓度BDE-47慢性胁迫会对大泷六线鱼的血液生化指标造成不同程度影响。除AKP指标,其余指标空白对照组和DMSO对照组无明显差异,说明DMSO不影响BDE-47毒理效应的分析。随着胁迫时间的延长,500 ng/L组对7个指标的影响最明显,其中GLU受各浓度影响最明显。随着胁迫浓度的增加,第4周各指标波动最大,其中第2周和第4周GLU受影响最大。第1和3周,随着BDE-47胁迫浓度的升高,TP呈现先降低后升高趋势,且在第1周表现最为明显;而ALB在各浓度BDE-47组中变化无明显规律。TBIL第1~4周各浓度组差异不显著(P>0.05),但第6周各实验组变化差异明显高于第5周(P<0.05)。在不同浓度BDE-47实验组中,尿素含量随时间延长呈降低趋势;AKP活性随时间延长均呈现显著升高的趋势(P<0.05),LDH则在3~5周变化较为明显。通过主成分分析C组和4周胁迫条件下,7个生化指标提取特征值,发现GLU是其中最具有代表的指标。因此,GLU在浓度和时间维度上是7个生化指标中最敏感的,可以作为评价该鱼类对所在BDE-47环境影响的潜在的指示物。本研究将为进一步完善BDE-47对鱼类的安全性评价提供参考。
致谢:在此感谢实验过程中给予帮助的老师和同学们,特别要感谢在论文修改过程中给予大力帮助的张伟倩编辑。
参考文献:
[1] Darnerud P O. Toxic effects of brominated flame retardants in man and in wildlife[J]. Environ Int, 2003, 29(6):841-853.
[2] Tomy G T, Palace V P, Halldorson T, et al. Bioaccumulation, biotransformation, and biochemical effects of brominated diphenyl ethers in juvenile lake trout (Salvelinusnamaycush)[J]. Environ Sci Technol, 2004, 38(5):1496-504.
[3] Bi X, Qu W, Sheng G, et al. Polybrominated diphenyl ethers in South China maternal and fetal blood and breast milk[J]. Environ Pollut, 2006, 144(3):1024-1030.
[4] Hites R A. Polybrominated diphenyl ethers in the environment and in people: a meta-analysis of concentrations[J]. Environ Sci Technol, 2004, 38(4):945-956.
[5] Branchi I, Capone F, Alleva E, et al. Polybrominated diphenyl ethers: neurobehavioral effects following developmental exposure[J]. Neurotoxicology, 2003, 24(3):449-462.
[6] Wit C A D. An overview of brominated flame retardants in the environment [J]. Chemosphere, 2002, 46(5):583-624.
[7] Jin S, Yang F, Hui Y, et al. Cytotoxicity and apoptosis induction on RTG-2 cells of 2,2′,4,4′-tetrabromodiphenyl ether (BDE-47) and decabrominated diphenyl ether (BDE-209)[J]. Toxicol in vitro, 2010, 24(4):1190-1196.
[8] Shao J, Dabrowski M J, White C C, et al. Flow cytometric analysis of BDE 47 mediated injury to rainbow trout gill epithelial cells[J]. Aquat Toxicol, 2010, 97(1):42-50.
[9] 李莹, 王伟, 孟凡平,等. 利用线粒体DNA控制区部分序列分析不同地理群体大泷六线鱼遗传多样性[J]. 海洋科学, 2012, 36(8):40-46.
[10] 孙诗萌, 安百胜, 蔡明城,等. 大泷六线鱼不同群体的形态差异分析[J]. 水产学杂志, 2015, 28(4):6-11.
[11] 夏重欢. 中国沿海地区海鱼体内持久性有机污染物痕量元素的污染水平以及对人类健康的风险评估[D]. 武汉:中国科学技术大学, 2011.
[12] 张赛赛, 孙德启, 姜欣彤,等. 四溴联苯醚慢性胁迫对大泷六线鱼生长及抗氧化酶活力的影响[J]. 大连海洋大学学报, 2017, 32(6):700-707.
[13] 周玉, 郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163- 169.
[14] 翟良安, 倪朝辉, 叶雄平. “浸螺杀”对鲤鱼生化和血液指标影响的研究[J]. 淡水渔业, 1992, 4: 24-27.
[15] Jarvis P L, Ballantyne J S. Metabolic responses to salinity acclimation in juvenile shortnose sturgeon Acipenser brevirostrum[J]. Aquaculture, 2003, 219(1/2/3/4):891-909.
[16] Ceron J J, Sancho E, Ferrando M D, et al. Metabolic effects of diazinon on the European eel:Anguillaanguilla[J]. J Environ Sci Health(Part B), 1996, 31(5): 1029-1040.
[17] 常玉梅, 曹鼎臣, 孙效文, 等. 低温胁迫对鲤血清生化指标的影响[J]. 水产学杂志, 2006, 19(2): 71-75.
[18] 张勤, 徐韧, 王桂兰. 石油污染对莫桑比克罗非鱼血清酶活性的影响[J]. 海洋学报(中文版), 1998, 4:60-64.
[19] Bader A, Petters O, Keller M, et al. Paracetamol treatment increases telomerase activity in rat embryonic lives cells [J]. Pharmacol Rep, 2011,63(6):1435-1441.
[20] 梁小明, 邵天伟, 陈昌辉. 胆红素对机体的病理损伤和生理保护作用[J]. 实用医院临床杂志, 2012, 9(3):172-175.
[21] 刘迁, 谭青松, 陈孝煊,等. “肝胆综合症”草鱼血液生化特性及组织结构变化[J].安徽农业科学,2009,37(14):6463-6465,6467.
[22] 张淑艳,熊惠顺.肝病患者血清前白蛋白和白蛋白的检测及临床意义[J].临床军医杂志,2010,38(2):279-280.
[23] Huo H Z, Wang B, Liang Y K, et al. Hepatoprotective and antioxidant effects of licorice extract against CCl4-induced oxidative damage in rats [J]. Int J Mol Sci, 2011, 12(10): 6529-6543.
[24] Yang L, Wang C Z, Ye J Z, et al. Hepatoprotective effects of polyprenols fromGinkgobilobaL.leaves on CCl4-induced hepatotoxicity in rats [J]. Fitoterapia, 2011,82(6):834-840.
[25] 巩华, 李华, 于毅,等. 恩诺沙星对鲤酯酶同工酶和血清生理生化指标的影响[J]. 大连海洋大学学报, 2005, 20(1):29-33.
[26] 冯晓雷, 吴俊毅. 碱性磷酸酶在骨肿瘤诊断中的价值[J]. 中国肿瘤临床与康复, 2016(8):967-969.
[28] 许源剑, 孙敏. 环境胁迫对鱼类血液影响的研究进展[J]. 水产科技, 2010(3):27-31.
[29] 洪磊, 张秀梅. 环境胁迫对许氏平鲉和花鲈血糖、血沉降的影响[J]. 中国水产科学, 2005, 12(4):414-418.
[30] 余德光, 杨宇晴, 王海英,等. 盐度变化对斜带石斑鱼生理生化因子的影响[J]. 水产学报, 2011, 35(5):719-728.
[31] 王广宇, 刘波, 谢骏,等. 鱼类糖代谢几种关键酶的研究进展[J]. 上海海洋大学学报, 2008, 17(3):377-383.
