一种新型寡聚噻吩类有机小分子DHOT的合成及其光伏性能
2018-06-25栾向峰李玲蒋历辉彭红建邹应萍
栾向峰,李玲,蒋历辉,彭红建,邹应萍
(中南大学 化学化工学院, 湖南 长沙,410083)
伴随着人类文明的长足进步和社会、经济的迅猛发展,人类对能源的需求量越来越多。但人们对作为常规能源的化石燃料的过度使用导致了能源危机,这就使得人们开始寻找和开发新能源。太阳能作为清洁环保的可再生能源越来越受到重视,将太阳能转化为电能的太阳能电池已成为人们研究热点[1−4]。机光伏材料具有材料合成容易、质量小、可大范围操作、成本低、柔韧性好和可大规模应用等优点,引起了人们的广泛关注,目前效率最高可达 13%[5]。有机光伏材料的给体主要有有机小分子材料和有机聚合物材料。有机聚合物材料存在材料提纯困难、器件效率重复性差等不足,这在一定程度上限制了聚合物的应用。然而,有机小分子材料具有结构明确、易于纯化及重复性好等优点,因此,有机小分子光伏材料的研究成为太阳能电池的研究热点[6−12],成为新一代有机太阳能电池有效的候选者。近年来,有机小分子光伏材料发展与应用非常迅速。TYLER等[13]研究了Pechmann有机小分子光伏材料,发现其能量转化效率不到 2%。SUN等[14]报道了有机小分子材料 p-DTS(PTTh2)2光电转化效率达到6.7%,为小分子光伏材料提供了更高的发展平台。YIN等[15]研究了基于DPP单元有机小分子光伏材料,其效率也只有5.29%。BAI等[16]研究了基于三苯胺和DPP的4种有机小分子光伏材料,其最高转化率为4%。WANG等[17]利用基于氟代苯并噻二唑作为缺电子单元,引达省(IDT)作为富电子单元,联二噻吩作为封端单元的寡聚物材料和与富勒烯衍生物共混获得光电转化效率高达 9.1%和填充因子高达 77%的有机太阳能电池器件。随着科学技术的不断发展,有机聚合物和有机小分子在太阳能电池中的应用不断创新,有机小分子太阳能电池最高转化效率达到12.50%[18−22]。目前,人们致力于新的有机小分子材料结构单元和性能优良的有机小分子材料研究。噁二唑类化合物主要用于生物抗菌,人们很少对其光伏性能进行研究。随着钯催化在有机合成中的应用[23−24],本文作者在分子中引进噁二唑,采用钯催化合成一种新型的寡聚类噻吩2,5-二[5-(4′-辛基-[2,2′-二噻吩]-5-基)-3-己基-1,3,4-噁二唑-2-硫酮]噻吩。该化合物物具有较宽的吸收光谱,对其进行表征,并将其应用到光伏领域,可为进一步研究有机小分子光伏太阳能电池提供新的思路。
1 实验
1.1 试剂
主要试剂如下:5-溴噻吩-2-甲酸、乙醇、浓硫酸、肼、氢氧化钾、四氢呋喃、甲苯、二硫化碳、氯仿、碘己烷和N-溴代丁二酰亚胺,上海国药集团生产;四(三苯基膦)钯、三丁基(4-辛基-2-噻吩基)锡烷、2,5-双(三甲基锡基)噻吩,太平洋化源公司生产。甲苯在使用前需要干燥除水,其他试剂均为市售,分析纯,使用前未进行任何处理。
1.2 仪器与测试方法
1H NMR谱采用Bruker DMX−500 核磁共振仪测定,以TMS为内标,CDCl3作溶剂;紫外−可见光谱用Hitachi UV−3010 紫外−可见光谱仪测试,三氯甲烷为溶剂。循环伏安曲线在型号为Zahner IM6e电化学工作站上测定,参比电极为Ag/AgCl(0.1 mol/L);对电极为铂丝,工作电极为铂片。光伏器件结构采用典型的三明治结构,氧化铟锡(ITO)作为正极,金属铝作为负极。光伏活性层由DHOT与PC71BM按不同质量比共混组成,厚度为 50~70 nm。电池器件的面积为4 mm2。用500 W氙灯与AM 1.5G的滤光片组合作为模拟太阳光的白光光源,测量时,光强为100 mW/cm2;J−V曲线使用Keithley 236 进行测量,并通过Labview软件由计算机进行控制。测量对外量子效率(PCE或EQE)时,以500 W氙灯作为光源,利用精密光栅单色仪输出不同波长的单色光,照射到器件后,用Keithley DMM 195数字万用表读电流,用标准硅电池作为参比进行计算。
1.3 化合物DHOT的合成
采用活性基团拼接的分子设计方法将2类杂环进行拼接,通过金属锡化物和钯催化合成一种新的寡聚类噻吩有机小分子化合物 DHOT, 并将其应用于太阳能电池中。其具体合成路线如图1所示。
1.3.1 5-(5-溴噻吩-2-基)-1,3,4-噁 二唑-2(3H)-硫酮(4)的合成
在圆底烧瓶中加入化合物3(0.884 3 g,4.0 mmol),氢氧化钾(0.336 6 g,6.0 mmol),无水乙醇35 mL,CS2(0.548 4 mL,8.0 mmol),磁力搅拌回流,每隔2.0 h补加二硫化碳 0.5 mL,补加2次,反应8.0 h后停止。反应完成后,减压旋干抽去溶剂,加入30 mL水,剧烈震荡,过滤得滤液,调节pH到2~3,析出大量淡黄色固体,过滤得淡黄色固体4(0.843 0 g,产率为80.1%)。
1H NMR结果如下: 化学位移δ7.63(d,J=4.0 Hz,1H), 7.44 (d,J=4.0 Hz, 1H)。
1.3.2 5-(5-溴噻吩-2-基)-3-己基-1,3,4-噁 二唑-2(3H)-硫酮(6)的合成
在圆底烧瓶中加入中间体4(1.052 5 g,4.0 mmol),KOH(0.224 4 g,4.0 mmol),MeOH(25 mL),THF(25 mL),室温下磁力搅拌,反应8.0 h后停止。反应完成后,减压旋干抽去溶剂,加THF 10 mL继续旋干真空干燥,得到中间体5。
用DMF 30 mL溶解上述氮钾盐,向反应瓶中加入碘己烷(1.697 0 g,8.0 mmol),室温磁力搅拌,反应24 h后停止。反应完成后,加入稀盐酸(5%,20 mL),加入二氯甲烷25 mL萃取,萃取3次,合并萃取液,有机相用饱和食盐水 25 mL洗涤 3次除去多余的DMF,用无水硫酸钠干燥,旋干除去溶剂。通过柱色谱分离(展开剂二氯甲烷与石油醚体积比为 1:5)得到白色固体化合物6(0.733 0 g,产率52.77%)。

图1 DHOT合成路线Fig. 1 Synthetic route of DHOT
1H NMR结果如下:化学位移δ7.45 (d, 偶合常数J=4.0 Hz, 1H), 7.13 (d,J=4.0 Hz, 1H), 3.30 (t,J=7.4 Hz,2H), 1.90−1.27 (m, 12H), 0.92 (t, 3H)。
1.3.3 3-己基-5-(4′-辛基-[2,2′-二噻吩]-5-基)-1,3,4-噁二唑-2(3H)-硫酮(7)的合成
将化合物6(1.384 0 g,4.0 mmol),三丁基(4-辛基-2-噻吩基)锡烷(2.626 0 g,5.4 mmol)溶于无水甲苯(60 mL),通氩气20 min,保证反应体系无氧。向反应体系中加入Pd(PPh3)4(277 mg)缓慢升温至115 ℃反应24 h。反应结束后,将混合物倒入水中,用二氯甲烷萃取。收集二氯甲烷萃取液,旋蒸除去溶剂后,粗产物用石油醚与二氯甲烷(体积比为 3:1)作洗脱剂过硅胶柱提纯,得到淡黄色固体7(1.04 g,产率56.28%)。
1H NMR 结果如下:δ7.59 (d,J=3.9 Hz, 1H), 7.17(d,J=3.9 Hz, 1H), 7.13 (s, 1H), 6.92 (s, 1H), 3.33 (t,J=7.3 2H), 2.61 (t,J=7.7 Hz, 2H), 1.90−1.20 (m, 20H),0.89 (m, 6H)。
1.3.4 5-(5′-溴-4′-辛基-[2,2′-二噻吩]-5-基)-3-己基-1,3,4-噁二唑-2(3H)-硫酮(8)的合成
在反应瓶中依次加入化合物 7(1.315 0 g,2.85 mmol),氯仿25 mL,乙酸25 mL。在0 ℃避光条件下,分批加入NBS(0.559 0 g,3.14 mmol),然后升至室温反应过夜。反应结束后,减压旋蒸掉多余溶剂,粗产物用石油醚与二氯甲烷(体积比为 4:1)过硅胶柱得到淡绿色固体8(0.780 0 g,产率50.87%)。
1H NMR结果如下:δ7.58 (d,J=3.9 Hz, 1H), 7.12(d,J=3.9 Hz, 1H), 6.99 (s, 1H), 3.33−3.29 (m, 2H),2.59−2.55 (m, 2H), 1.92−1.22 (m, 20H), 0.95−0.86 (m,6H)。
1.3.5 DHOT的合成
将化合物 8(0.416 0 g,0.859 mmol),2,5-双(三甲基锡基)噻吩(0.101 0 g,0.246 mmol)溶于干燥的甲苯20 mL,在氩气保护条件下向反应体系中加入四(三苯基膦)钯(28 mg),升温至110 ℃反应36 h。完毕后,将混合物倒入水中,用二氯甲烷萃取,旋干溶剂后过硅胶柱,用石油醚与二氯甲烷(体积比为1:2)作洗脱剂,得到暗红色固体DHOT(70 mg,产率28.34%)。1H NMR图谱如图2所示。从图2可以看出:δ7.61(d,J=3.9 Hz, 2H), 7.19 (d,J=3.8 Hz, 2H), 7.15 (d,J=2.3 Hz, 4H), 3.31 (t,J=7.4 Hz, 4H), 2.83 (t, 4H), 1.98−1.18(m, 40H), 0.92 (m, 12H)。

图2 DHOT的1H NMR图Fig. 2 1H NMR spectrum of DHOT
2 结果与讨论
2.1 DHOT的热稳定性
材料具备一定的热稳定性是制备光伏器件的前提。通过热重分析(TGA)测定有机化合物的热稳定性能,测定结果如图3所示。从图3可以看出:当温度为 296 ℃时,DHOT 的质量损失仅为 5%。这表明DHOT 具有良好的热稳定性,完全可以满足其在光电材料应用领域的要求。

图3 DHOT的TGA 曲线Fig. 3 TGA thermogram of DHOT
2.2 DHOT的光学性能
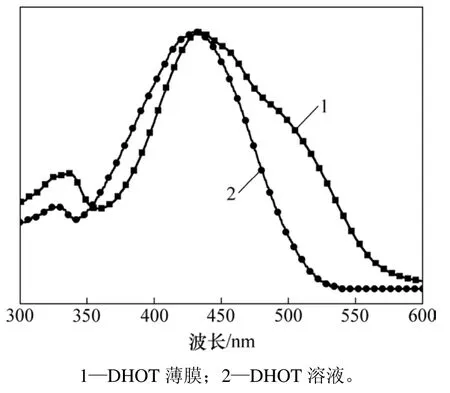
图4 DHOT的紫外−可见吸收光谱图Fig. 4 UV−vis absorption spectra of DHOT
紫外−可见吸收光谱能够提供大量关于化合物的光谱吸收信息。DHOT的吸收光谱如图4 所示。在溶液和薄膜状态下,DHOT表现出较宽的吸收平台,吸收范围为 300~600 nm。在溶液状态下,其短波波长335 nm处的吸收峰主要归结于主链上的 π–π*电子跃迁;而425 nm处的最大吸收峰是由主链上的受体单元和给体单元之间电荷转移(ITC)所形成。在薄膜状态下,小分子的最大吸收波长红移10 nm,并出现了明显的吸收肩带,表明小分子在薄膜状态下具有更强的分子间作用力。因此,小分子吸光范围较宽,可以有效吸收太阳光,并将其有效转换为电能。
2.3 DHOT的电化学性能
DHOT光伏器件的性能见表1。为了研究DHOT的电化学性能,采用循环伏安法(CV)得到小分子的起始氧化还原电位,进而计算得到相应HOMO和LUMO能级。图5所示为DHOT的循环伏安曲线图,电解液为含 0.1 mol/L Bu4NPF6的乙腈溶液,扫描速率为50 mV/s。从图5可以看出:DHOT在阳极区域表现出准可逆性,其氧化掺杂电流明显高于还原区域的n-掺杂电流。依照方程式[4]:EHOMO=−e(Eox+4.4)(eV),ELUMO=−e(Ered+3.59)(eV),得到聚合物的 HOMO 和LUMO能级(其中:EHOMO和ELUMO分别为HOMO和LUMO的电位;Eox为起始氧化电位,Ered为起始还原电位;e为电荷)。相对于Ag/AgCl参比电极,DHOT的起始还原电位为−0.81 V,相应的 LUMO能级为−3.59 eV;起始氧化电位为1.05 V,相应的HOMO能级为−5.45 eV。根据HOMO和LUMO能级可以得到DHOT的电化学能隙为1.86 eV,电化学能隙与光学能隙基本一致。

表1 DHOT光伏器件的性能Table 1 Optical properties of DHOT

图5 DHOT薄膜的循环伏安曲线Fig. 5 Cyclic voltammogram of DHOT film cast on platinum plate
2.4 DHOT的光伏性能
光电流的产生取决于载体子生成和运输的效率。为了研究共混膜的电荷传输,采用空间电荷限制电流(SCLC)法测量光敏层的空穴迁移率和电子迁移率,其对应的器件结构分别为ITO / PEDOT:PSS /DHOT:PC71BM / Au和ITO/Al/DHOT:PC71BM/Al。利用空间电荷限制电流方法进行测试,可通过下式计算空穴迁移率和电子迁移率:

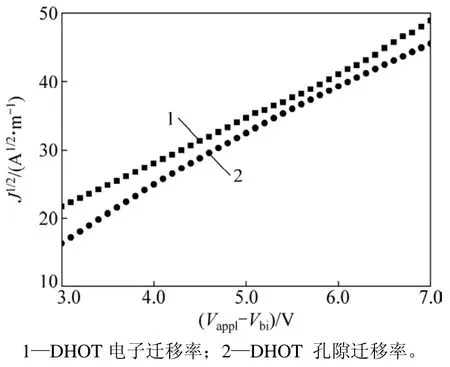
图6 DHOT的J1/2−V 曲线Fig. 6 J1/2−V curves of solar cell based on DHOT
其中:J为电流密度;μ0为零场迁移率;d为活性层的厚度;V=Vappl-Vbi;Vappl为应用电场电势;Vbi为内建电压;ε0为真空介电常数;εr为介电常数;γ为电导系数。DHOT的J1/2−V曲线见图6。据图6和式(1)得出该小分子的空穴迁移率和电子迁移率分别为3.67×10−5和 3.16×10−5cm2.V−1.s−1,器件表现出相对较平衡的空穴迁移率和电子迁移率,有助于获得较高的填充因子(FF)和短路电流(Jsc)。 DHOT光伏器件的电流密度−电压(J−V)曲线如图7所示。光伏性能参数见表1。基于小分子DHOT的初步器件能量转换效率为1.03%,开路电压Voc为0.84 V,短路电流密度Jsc为 3.99 mA/cm−2,FF为 30.7%。

图7 DHOT光伏器件的J−V 曲线Fig. 7 J−V curves of solar cell based on DHOT
2.5 活性层的形貌表征
活性层的表面形貌是影响器件性能的重要因素,良好的表面形貌、合适的粗糙度以及较好的纳米相分离会得到较高的迁移率和FF。为了研究活性层的表面形貌,用轻敲式的原子力显微镜(AFM)对活性层进行扫描并拍摄表面形貌图。当DHOT与PC71BM质量比m(DHOT):m(PC71BM)=1:1 时,光伏活性层的原子力显微镜图见图 8。其中,图 8(a)所示为活性层原子力高度图,图 8(b)所示为原子力相图,图8(c)所示为原子力的三维高度图。从图8可以看出:光伏活性层的粗糙度(RMS)为1.45 nm,DHOT与PC71BM发生了较明显相分离,形貌优化有待进一步提高,可以进一步提高其能量转化率。
3 结论

图8 m(DHOT):m(PC71BM)=1:1活性层的AFM图Fig. 8 AFM images of m(DHOT):m(PC71BM)=1:1 active layer
1)合成了一种新型寡聚类噻吩有机小分子 2,5-二[5-(4′-辛基-[2,2′-二噻吩]-5-基)-3-己基-1,3,4-噁二唑-2-硫酮]噻吩(DHOT),并将其应用于太阳能电池研究。DHOT具有良好的热稳定性,较宽的吸收光谱、合适的HOMO 与LUMO 能级,能量转换效率为1.03%,开路电压(Voc)为 0.84 V,短路电流密度(Jsc)为 3.99 mA/cm2,填充因子(FF)为30.7%。
2)当m(DHOT):m(PC71BM)=1:1 时,活性层的粗糙度RMS为1.45 nm,DHOT与PC71BM相发生了较明显分离。由于吸收光谱较宽,能级合适,此类有机小分子化合物极有望成为新型高性能的太阳能电池材料。
[1]BRABCE C J. Organic photovoltaics:technology and market[J].Solar Energy Materials and Solar Cells, 2004, 83(3): 273−292.
[2]王全志, 井西利, 马懿恒, 等. 高效硅太阳能电池减反射膜系折射率分布[J]. 激光与红外, 2011, 41(6): 669−672.WANG Quanzhi, JING Xili, MA Yiheng, et al. Refractive indexes distribution of anti-reflection coatings for high efficiency silicon solar cells[J]. Laser and Infrared, 2011, 41(6):669−672.
[3]ROBERT F S. Outlook brightens for plastic solar cells[J].Science, 2011, 332(6027): 293−294.
[4]刘波, 贺跃辉, 夏宁, 等. 窄带隙 Pechmann 类聚合物的合成及光伏性能[J]. 中国有色金属学报, 2014, 24(5): 1359−1364.LIU Bo, HE Yuehui, XIA Ning, et al. Synthesis and photovoltaic properties of low bandgap Pechmann-based polymer[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(5): 1359−1364.
[5]ZIMMERMANN Y S, SCHÄFFER A , HUGI C, et al. Organic photovoltaics:potential fate and effects in the environment[J].Environ Int, 2012, 49: 128−140.
[6]MISHRA A, BAUERLE P. Small molecule organic semiconductors on the move: promises for future solar energy technology[J]. Angewandte Chemie International Edition, 2012,51(9): 2020−2067.
[7]WALKER B, KIM C, NGUYEN T. Small molecule solution-processed bulk heterojunction solar cells[J]. Chemistry of Materials, 2011, 23(3): 470−482.
[8]WEI G, WANG S, SUN K, et al. Solvent-annealed crystalline squaraine: PC70BM (1:6)solar cells[J]. Advanced Energy Materials, 2011, 1(2): 184−187.
[9]ZHOU H, YANG L, STUART A C, et al. Development of fluorinated benzothiadiazole as a structural unit for a polymer solar cell of 7% efficiency[J]. Angewandte Chemie International Edition, 2011, 123(13): 2995−2998.
[10]HUANG Jianhua, ZHAN Chuanlang, ZHANG Xin, et al.Solution-processed DPP-based small molecule that gives high photovoltaic efficiency with judicious device optimization[J].ACS Appl Mater Interfaces, 2013, 5(6): 2033−2039.
[11]COUGHLIN J E, HENSON Z B, WELCH G C, et al. Design and synthesis of donors for solution-processed high-efficiency organic solar cells[J]. Accounts of Chemical Research, 2014,47(1): 257−270.
[12]GUPTA V, KYAW A, WANG D H, et al. Barium: an efficient cathode layer for bulk-heterojunction solar cells[J]. Scientific Reports, 2013, 3(24): 1965−1970.
[13]TYLER B N, ERIC A B K, MICHAEL B S.Thiophene-containing pechmann dye derivatives[J]. Organic Letters, 2010, 12(21): 4816−4819.
[14]SUN Y, WELCH G C, LEONG W L, et al. Solution-processed small-molecule solar cells with 6. 7% efficiency[J]. Nature Materials, 2012, 11(1): 44−48.
[15]JI C, YIN L, WANG L, et al. Linkage effects of linear D-p-A-p-D typediketopyrrolopyrrole-triphenylamine based solution-processable organic small molecule photovoltaic materials[J]. Journal of Materials Chemistry C, 2014, 2(20):4019−4026.
[16]BAI Huitao, CHENG Pei, WANG Yifan, et al. A bipolar small molecule based on indacenodithiophene and diketopyrrolopyrrole for solution processed organic solar cells[J].Journal of Materials Chemistry A, 2014, 2(3): 778−784.
[17]WANG Jinliang, WU Hongbin, LIU Feng. Series of Multifluorine Substituted oligomers for organic solar cells with efficiency over 9% and fill factor of 0.77 by combination thermal and solvent vapor annealing[J]. J Am Chem Soc, 2016,138(24): 7687−7697.
[18]LI Miaomiao, GAO Ke, WAN Gao, et al. Solution- processed organic tandem solar cells with power conversion efficiencies>12%[J]. Nature Photonics, 2017, 11: 85−90.
[19]YUAN Jun, QIU Lixia, ZHANG Zhiguo, et al. A simple strategy to the side chain functionalization on the quinoxaline unit for efficient polymer solar cells[J]. Chem Commun, 2016, 52:6881−6884.
[20]HE Dingjun, QIU Lixia, ZHANG Zhiguo, et al. Two new fluorinated copolymers based on thieno[2,3-f]benzofuran for efficient polymer solar cells[J]. RSC Adv, 2016, 6:62923−62933.
[21]QIU Beibei, YUAN Jun, ZOU Yingping, et al. An Asymmetric small molecule based on thieno[2,3-f]benzofuran for efficient organic solar cells[J]. Org Electron, 2016, 35: 87−94.
[22]LIU Weifang, QIU Lixia, JIANG Lihui, et al. Synthesis and characterization of 5,6-bis(n-octyloxy)[2,1,3]selenadiazolebased polymers for photovoltaic applications[J]. Polym Bull,2016, 73(2): 385−398.
[23]BRAUNECKER W A, OOSTERHOUT S D, OWCZARCZYK Z R, et al. Ethynylene- linked donor-acceptor alternating copolymers[J]. Macromolecules, 2013, 46(9): 3367−3375.
[24]FLAMINI R, CARLOTTI B, SPALLETTI A, et al. Spectral properties and photophysics of arylacetylenes in thin films[J].Organic Photonics and Photovoltaics, 2014, 2(1): 1−11.
