传质对土壤微生物燃料电池的产电性能及阿特拉津降解的影响
2018-06-12朱丹丹李先宁
李 蕾 王 辉 朱丹丹 李先宁
(东南大学能源与环境学院, 南京 210096)
阿特拉津(Atrazine)是一种使用较为普遍的三嗪类除草剂,主要用于选择性去除田中阔叶杂草及禾本科杂草.近年来在许多国家的河流、湖泊中均检出阿特拉津与其降解的中间产物[1].阿特拉津属于难降解有机污染物,相关研究表明其被土壤吸附降解性较低,具有生物蓄积性,对人和动物有一定的毒性[2].
微生物燃料电池(microbial fuel cell, MFC)是一种以微生物为催化剂的新型生物电化学系统.微生物在阳极厌氧条件下分解有机底物,维持自身生长的同时产生电子和质子,电子被阳极捕集后经外部电路传递至阴极形成电流,质子从电池内部传递到阴极,与阴极的氧气结合生成水[3].MFC技术广泛运用于处理水或沉积物[4],而土壤中蕴含着种类丰富且数量庞大的微生物,对构建MFC具有天然优势,以土壤为基质的微生物燃料电池称为土壤微生物燃料电池(soil microbial fuel cell,土壤MFC).Wang等[5]使用MFC加速石油烃在土壤中的降解,阳极附近土壤中的去除率提高了120%.Zhang等[6]构建以4层碳网为阳极的空气阴极MFC,比较石油烃在不同结构土壤MFC中的降解.Wang等[7]构建单室无膜土壤MFC去除难降解有机物六氯苯,比较外阻和电极间距发生改变时对土壤MFC产电性能的不同影响.
阿特拉津的降解途径主要有脱氯羟基化反应、侧链脱烷基反应等,最终形成无毒且稳定的三聚氰酸[8].MFC的装置构型[9-10]、电极材料[11]和传质等[12]均可对其净化及产电性能造成影响,而对土壤MFC的影响因素还包括土壤的含水率、含砂量、有机物含量、电导率等[13-15].物质在土壤中的扩散速度及质量传递比在水相中慢得多,导致土壤MFC内阻较高,净化土壤的影响半径较小[16],降低了土壤MFC的性能.Fe3+/Fe2+作为电子穿梭体可以促进电子传递,赵亚楠等[17]发现浓度为500 mg/L铁离子可有效改善SMFC的运行特性,功率密度峰值可上升到103.09 mW/m. Domínguez-Garay等[18]将二氧化硅混入土壤,改变土壤的电导率;Li等[19]用微电极测试技术证实在土壤中添加二氧化硅可使得MFC内部传质增强,促进了石油烃的降解.
已有研究表明添加单一介质可以提高微生物燃料电池的产电性能[18],但是缺乏对多种介质的对比研究.本文构造了空气阴极土壤MFC,通过添加不同介质来影响物质在土壤MFC中的传递.由于氧气参加阴极反应,因而对电池的整体性能具有重要影响.本文在添加同一介质的条件下,构造阴极水层,研究降低阴极氧浓度时土壤MFC中的传质,对比不同条件下土壤MFC的产电性能及阿特拉津降解的差异.
1 材料与方法
1.1 实验材料
采集0~20 cm的表层农田土,研磨过筛(筛孔小于2 mm),土壤的基本性质见表1.

表1 土壤的基本理化性质
计算并称取定量的阿特拉津溶于丙酮,然后与处理过的土壤混合,在室温下放置于通风厨内.每天搅拌3次,待丙酮挥发干净,重新过筛,使阿特拉津与土壤充分混匀,存于密封箱中备用.
1.2 实验装置
1.2.1 电极的制备
阴极和阳极均采用圆形碳毡(φ40 mm×5 mm),使用前分别用盐酸溶液(1 mol/L) 和氢氧化钠溶液(1 mol/L)各浸泡1 h,再用去离子水清洗,在60 ℃温度下烘干备用.
1.2.2 土壤MFC装置的构建
本研究以阿特拉津为土壤污染物搭建土壤MFC,装置主体为直径40 mm、高150 mm的圆柱形有机玻璃反应器,结构如图1所示.电极材料采用制备好的碳毡,阳极和阴极均由钛导线(φTi=0.8 mm)引出,外电路由导线连接恒定电阻形成闭合回路.阳极接种的微生物采用经培养及预处理的浓缩厌氧污泥,然后添加乙酸钠浓度为5 g/L的营养液至土壤饱和,外接300 Ω电阻.土壤MFC成功启动后,每周向阳极投加10 mL营养液保证阳极微生物的正常代谢活动,投加前向营养液中吹入氮气来维持阳极厌氧环境.
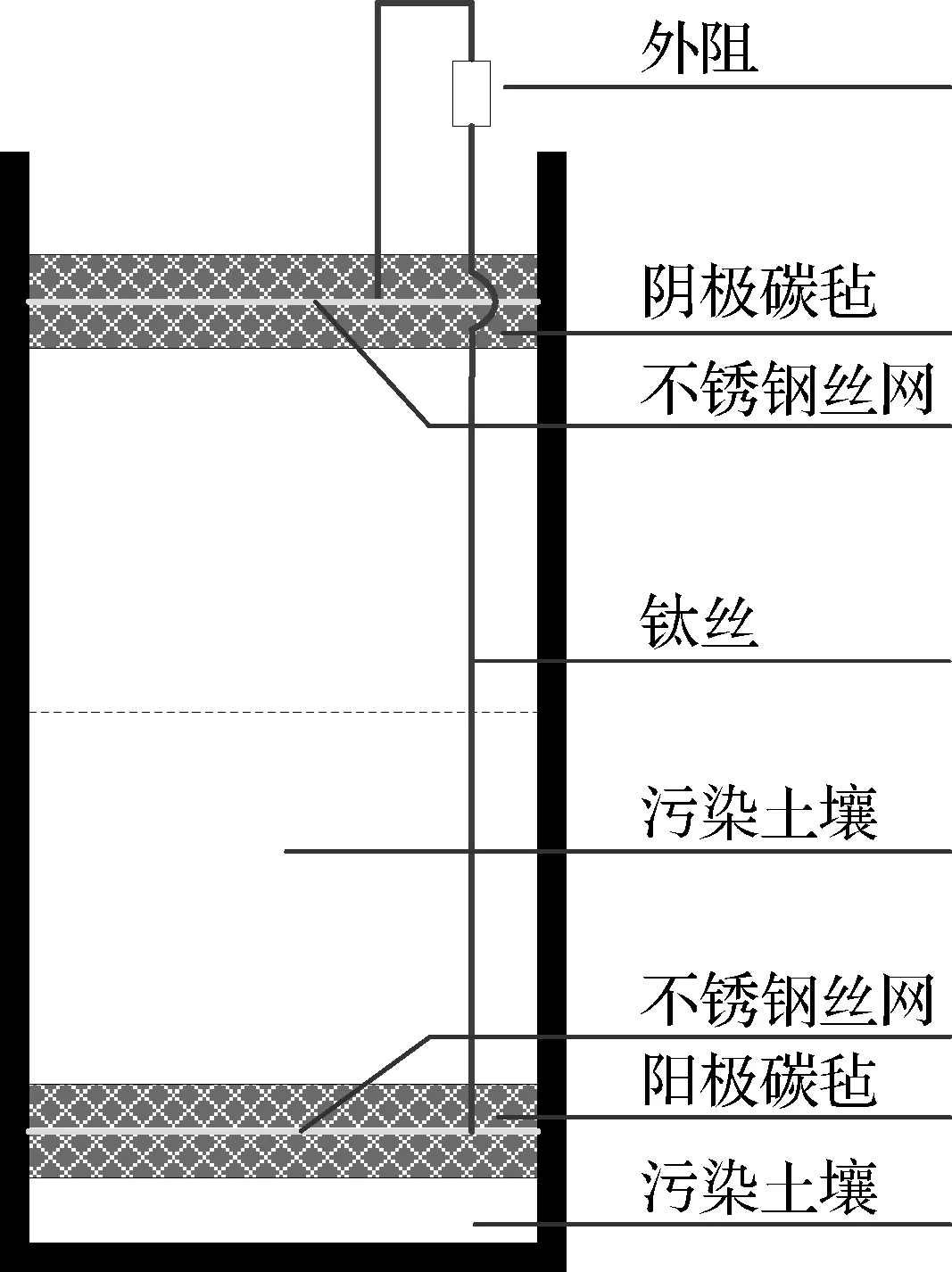
图1 土壤MFC装置示意图
1.3 实验设计
首先将介质和污染土壤以体积比1∶4的比例进行混合,搅拌均匀,待搭建反应器时使用.本研究共设4组实验组,其中3组向土壤MFC的土层中分别添加二氧化硅(粒径φ=0.074~0.15 mm)、小颗粒活性炭(粒径φ=1~2 mm)和大颗粒活性炭(粒径φ=3~5 mm),分别记为MFC-1,MFC-2,MFC-3,另一组在添加大颗粒活性炭(φ=3~5 mm)的同时构造10 mm的阴极水层,记为MFC-4.土壤MFC运行过程中持续加水,保持高度为10 mm,每组实验组设置3个平行样,并设置断路装置作为对照组.从土壤MFC的产电特性和阿特拉津的去除率来评价改变条件对实验的影响,并分别对比相同条件下实验组和对照组中电流对阿特拉津去除的影响.
1.4 分析与计算
1.4.1 土壤MFC产电性能的测定
使用数字万用表测量土壤MFC的输出电压,每天测定3次.
在装置添加营养液后,采用稳态放电法测量土壤MFC的极化曲线与功率密度曲线,测定过程中分别连接50~100 000 Ω的一系列负载电阻,然后分别测量负载电阻两端的电压及阴阳极电势.
采用电化学阻抗谱法并用电化学工作站测量土壤MFC的内阻.
1.4.2 污染土壤采样及预处理
土壤MFC均为序批式装置,实验进行9周,在每周加营养液前对污染土壤取样1次,取样时将污染土层全部取出,冷冻干燥后研磨过筛混合均匀.土样预处理步骤为:① 称取2.0 g样品放入15 mL离心管中,在依次加入0.5 g无水硫酸钠、10 mL提取液(5 mL丙酮+5 mL正己烷)后,涡旋震荡3 min,然后置于超声波发生器中萃取1 h;② 使用冷冻离心机以7 000 r/min离心3 min,将上层清液用有机滤膜过滤,然后将2 mL滤液加入试管中;③ 加丙酮定容,使用气相色谱-质谱联用仪(ITQ1100 Thermo Fisher)对阿特拉津进行定量分析.
1.4.3 计算方法
根据所测得到的电压与外接电阻,按下式计算土壤MFC的电流密度I与功率密度P:
(1)
P=UI
(2)
式中,U为输出电压,V;R为外电路电阻,Ω;A为阳极碳毡的投影面积,m2.
根据所测阿特拉津的浓度,分别按下式计算阿特拉津去除率D和降解速率V:
(3)
(4)
式中,C0为阿特拉津的初始质量浓度,mg/kg;Ct为反应t天后阿特拉津的质量浓度,mg/kg.
根据下式[20]得到半衰期t1/2:
(5)
(6)
式中,kobs为反应的速率常数.
2 结果与讨论
2.1 土壤MFC的电化学性能分析
2.1.1 电压
图2为MFC-1,MFC-2,MFC-3,MFC-4外接300 Ω电阻时电压随时间的变化.4组土壤MFC共运行63 d,最大电压均未超过100 mV;前20天4组装置的电压无明显规律波动;20天后,MFC-1,MFC-2,MFC-3的电压值随着每周添加乙酸钠等营养物质大致呈周期性变化,峰值电压均可达到70 mV;MFC-4的电压输出值与其他3组相比,处于较低水平,峰值电压低于50 mV,周期性不明显.
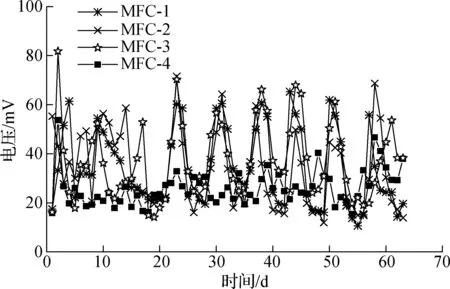
图2 土壤MFC的闭路电压变化曲线
土壤MFC的输出电压与底物浓度具有相关性,且投加乙酸钠对产电菌有一定的富集作用[21-22],因此产电菌可利用较高浓度底物产生高电压输出,然而运行前20天4组装置的电压变化并无一定规律.冯玉杰等[23]利用生活污水驯化3周后得到稳定的阳极电压输出,这说明装置运行前期为产电菌的阳极驯化阶段.无水层装置MFC-1,MFC-2,MFC-3的电压随着营养物质的添加呈明显周期性变化,而阴极设有水层的MFC-4的电压变化无周期性且电压值为4组中最低,表明阴极氧含量的减少会对土壤MFC的输出电压造成不利影响.氧气作为空气阴极MFC唯一的电子受体[24],是影响电压输出的主要因素.MFC-4中阴极上方的10 mm水层减弱了电子与空气中氧气的反应,缺氧造成缺乏电子受体,限制了电池阴极半反应,使得输出电压较低,因此电压和阴极氧浓度具有相同的变化趋势[25],但是水层形成的相对稳定的阳极厌氧环境也使输出电压变化幅度较小.
2.1.2 功率密度曲线与极化曲线
为了比较各组土壤MFC电池性能,测定各实验组电池的功率密度曲线与极化曲线.由图3(a)可知,MFC-3的功率密度为4组中最高(电流密度I=0.144 A/m2时,Pmax=0.020 8 W/m2),其次是MFC-2,MFC-1(I=0.115 A/m2,Pmax=0.017 1 W/m2;I=0.105 A/m2,Pmax=0.013 5 W/m2),MFC-4的最低(I=0.037 4 A/m2,Pmax=0.005 8 W/m2).Song等[26]研究SMFC的平均电流与最大功率密度分别为0.22 mA,0.003 15 W/m2;Sajana等[27]研究SMFC的功率密度范围在107.3~242.1 μW/m2.由此表明,本实验中土壤MFC具有较好的电池性能.为了进一步分析电池的输出性能,测试了4组装置阴阳极极化特性.
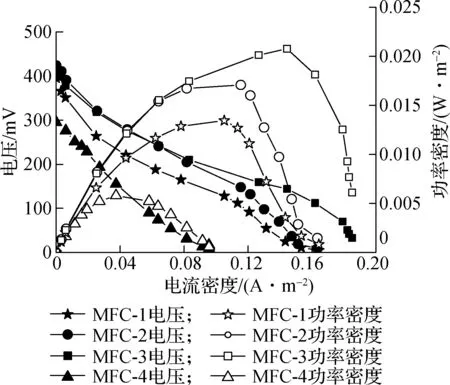
(a) 土壤MFC的功率密度曲线
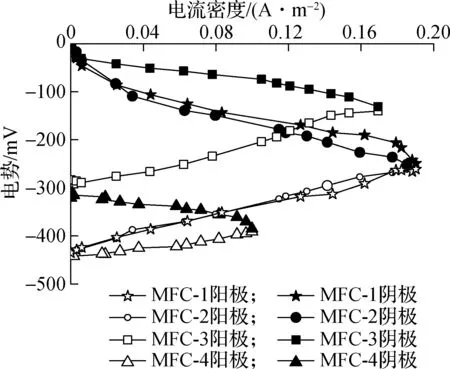
(b) 土壤MFC的极化曲线图3 土壤MFC的功率密度和极化曲线
如图3(b)所示,添加大颗粒活性炭介质MFC-3的阴极电势较高,且比MFC-2和MFC-1稳定,虽然阴极淹水MFC-4的极化现象较弱,但阴极电势最低.氧气作为阴极电子受体,其浓度和扩散速率是影响阴极极化的主要因素[28],因此MFC-4中阴极氧含量低造成阴极性能较差,产生较高的活化内阻;添加大粒径介质降低了阴极极化曲线的斜率,增强阴极抗极化能力,主要原因是活性炭表面具有微孔结构,其表面的含氧官能团与较强的吸附作用可以吸收更多的矿物元素增加阳离子交换量[29],促进质子在土壤中的传递,从而加快了阴极反应,使得阴极性能得以提高,且较大的粒径使得更多的离子在活性炭表面传递,因此阴极性能较好.
2.1.3 内阻
由测量得到的各装置电化学阻抗谱如图4所示,图中,Z″为阻抗,Z为容抗.对阻抗数据与等效电路进行拟合得到土壤MFC各部分内阻,如表2所示.由表可知,MFC-4的总内阻最高(1 054 Ω),MFC-1次之(890 Ω),其次是MFC-2(712 Ω),MFC-3最低(693 Ω).

图4 电化学阻抗谱图
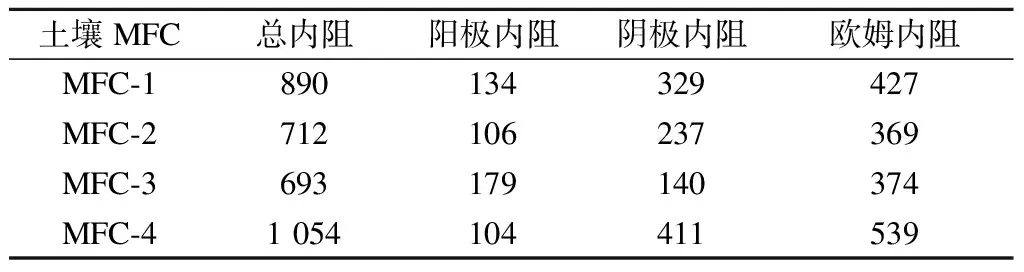
表2 土壤MFC的内阻 Ω
MFC的总内阻由扩散内阻、活化内阻和欧姆内阻构成.活化内阻和扩散内阻均产生于电极和电解质的两相界面上,因此表2中的阴、阳极内阻分别由活化内阻和扩散内阻构成[30],电池内部对电子、离子等传导的阻碍作用形成了欧姆内阻[31].设置水层的MFC-4的欧姆内阻最高,因为过多的水分使土壤间隙的电解液中电解质的浓度降低,土壤电导率减小,导致欧姆内阻增加;其次是添加二氧化硅的MFC-1,主要由于二氧化硅为绝缘体,增大了体系的欧姆内阻;而对于MFC-2和MFC-3其填充介质均为导体,与土壤混合后改变了土壤整体的电导率,降低了内阻.可见介质材料对土壤MFC系统的欧姆内阻影响较大.
活化内阻和扩散内阻主要受阳极底物和阴极电子受体的影响[31].由土壤MFC的极化曲线可知,阴极含氧量低的MFC-4其阴极性能最差,MFC-3的阴极性能较好,这与表2中所测MFC-4的阴极内阻最高、MFC-3的阴极内阻最低相符合;添加了活性炭的MFC-2和MFC-3的欧姆内阻虽相差不大,但粒径相对较小的MFC-2的阳极内阻比MFC-3要小.粒径小具有较大的比表面积,因此阳极附近可吸附大量的微生物,促进了阳极反应,降低了阳极活化内阻.
2.2 土壤MFC对阿特拉津降解的影响
每周对污染土壤中的阿特拉津浓度进行检测,浓度变化曲线如图5所示.测得的阿特拉津初始浓度为112 mg/kg.
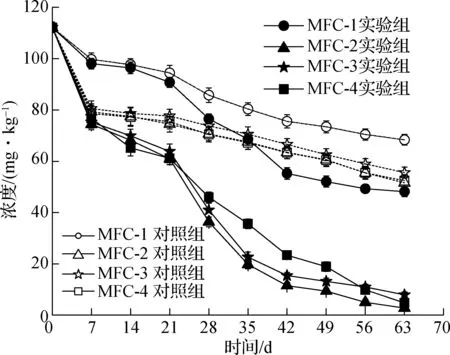
图5 阿特拉津的浓度变化曲线
实验开始前7天MFC-1实验组和对照组初始浓度由112 mg/kg分别降至98.05,99.75 mg/kg,而在MFC-2,MFC-3,MFC-4实验组及对照组浓度均降至80 mg/kg以下.反应至第7~21天阿特拉津在4组实验组中的降解速率均高于其对照组,MFC-1实验组及对照组浓度分别降至90.74,94.46 mg/kg,降解速率均低于MFC-2,MFC-3,MFC-4.MFC-1,MFC-2,MFC-3,MFC-4实验组中浓度分别由74.40,75.25,76.54 mg/kg降至60.95,63.84,61.13 mg/kg,而MFC-2,MFC-3,MFC-4对照组浓度分别由79.25,79.98,78.55 mg/kg降至74.47,77.67,75.45 mg/kg;从第21天开始,阿特拉津在4组对照组中依然维持较慢的降解速率,而MFC-1,MFC-2,MFC-3,MFC-4实验组降解速率较之前明显加快,浓度分别由90.74,60.95,63.84,61.13 mg/kg降至48.14,2.71,7.86,4.74 mg/kg.4组实验组及其对照组在前7天、第7~21天和第21~63天的降解率如图6所示.图中,MFC-1′,MFC-2′,MFC-3′,MFC-4′分别为相应的对照组.

图6 不同阶段阿特拉津的降解率
由图6可知,前7天在添加活性炭与二氧化硅的装置中阿特拉津的降解率具有明显的差异性,在添加活性炭的MFC-2,MFC-3,MFC-4及其对照组中降解率均在30%以上,而在添加二氧化硅的MFC-1及其对照组中降解率为10%左右,考虑到不同材料对阿特拉津有一定的吸附作用,实验测得小颗粒活性炭与大颗粒活性炭的吸附率分别为31.85%,28.56%,二氧化硅的吸附率仅为2.76%,因此MFC-1及其对照组中阿特拉津浓度的减小可能是由于阴极活性炭和阳极碳毡的吸附作用.通过对土壤MFC的输出电压分析可知,实验开始前20天为阳极产电菌的驯化阶段,第7~21天阿特拉津在各实验组中的降解率均高于其对照组,原因是电子在闭路装置中通过外电路运输发生反应,刺激微生物不断产生电子,从而促进了阿特拉津的降解;第20天后装置开始进行规律的产电,因此第21~63天为生物电化学作用阶段,相较于对照组,阿特拉津在闭路中具有较高的降解率.图7为各组在第21~63天的降解率和平均降解速率.平均降解率由大到小依次为MFC-2(51.91%,1.39 mg/(kg·d)),MFC-4(50.25%,1.34 mg/(kg·d)),MFC-3(49.89%,1.33 mg/(kg·d))和MFC-1(37.97%,1.01 mg/(kg·d)).
由阿特拉津在第21~63天降解率不同可知,生物电化学作用对土壤MFC中阿特拉津的降解具有一定影响.魏金枝等[8]采用电催化氧化技术降解废水中阿特拉津,发现反应30 min即可去除阿特拉津,因此土壤MFC中的微生物电化学作用可用于阿特拉津的降解,研究表明土壤MFC中六氯苯的降解主要依靠厌氧环境下的脱氯还原过程,反应所需电子通过产电菌分解底物获得[32],在本研究中阿特拉津的降解则主要依靠乙酸钠等底物分解产生的电子[21].

图7 第21~63天阿特拉津在实验组土壤MFC的降解率与平均降解速率
在MFC实验组中产生较高电流可获得更高的去除率[33],由上文对土壤MFC的电化学分析可知,4组MFC产生的平均电流密度由大到小依次为MFC-2(85.63 mA/m2),MFC-3(82.75 mA/m2),MFC-1(80.19 mA/m2)和MFC-4(65.47 mA/m2),因此阿特拉津在MFC-2中的降解速率最大,降解率最高;MFC-1与其他3组相比,降解效果较差,主要因为活性炭具有良好的导电性,有利于质子的传递,其较高的比表面积和多孔结构为产电菌提供了较大的附着繁殖生长区域,避免了生物淤积,从而产生了大量的电子用于阿特拉津的降解;MFC-4产生的平均电流密度较小,但对阿特拉津的去除效果比MFC-3好,原因有以下2个方面:① 输送到阴极的电子对阴极附近的阿特拉津有一定的降解作用,而氧气在阴极反应中作为电子受体与质子反应,与阴极的阿特拉津对电子的使用存在竞争关系,MFC-4的阴极氧含量较低,从而提高了整体对阿特拉津的降解率;② MFC-3和MFC-4所添加活性炭的粒径相同,而MFC-4中大量的水分提高了土壤的渗透系数有利于乙酸钠的扩散,使微生物获得充足的营养物质来产生电子,从而降解阿特拉津.研究表明,沉积物中有机物的含量越低,质量传递对MFC的阳极性能影响越大[34],因此第21天后随着阿特拉津浓度的降低,4组MFC实验组中阿特拉津的降解速率均逐渐减小.
根据式(5)计算得到的阿特拉津在土壤MFC中的半衰期如表3所示.阿特拉津的降解速率随环境的不同差异较大,自然条件下土壤中的半衰期长达57周[35],本文所构造的土壤MFC大幅度缩短了阿特拉津在土壤中的半衰期,MFC-2实验组中半衰期仅为62.34 d,因此土壤MFC中添加介质对阿特拉津的降解有促进作用.
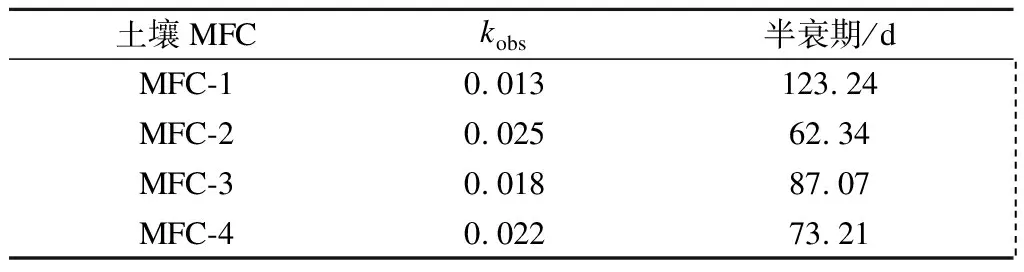
表3 土壤MFC中阿特拉津的降解速率常数和半衰期
3 结论
1) 土壤MFC中添加导体介质可以促进质子和离子在土壤中的传递,从而增强了电极的抗极化能力,使得欧姆内阻减小,获得的最低内阻仅为693 Ω,因此提高了电池的产电性能;阴极水层降低了土壤溶液的电导率使欧姆内阻增大,因此阴极氧含量限制了电压的输出.
2) 土壤MFC中添加介质对阿特拉津的降解具有明显的促进作用.在添加导体介质的装置中降解率相对较高,在MFC-2中取得的最短半衰期为62.34 d;阴极覆水有利于创造完全厌氧的阳极环境,促进了装置对阿特拉津的降解.
参考文献(References)
[1] Lima D L D, Silva C P, Schneider R J, et al. Development of an ELISA procedure to study sorption of atrazine onto a sewage sludge-amended luvisol soil[J].Talanta, 2011,85(3): 1494-1499. DOI:10.1016/j.talanta.2011.06.024.
[2] Friedmann A S. Atrazine inhibition of testosterone production in rat males following peripubertal exposure[J].ReproductiveToxicology, 2002,16(3): 275-279. DOI:10.1016/s0890-6238(02)00019-9.
[3] Logan B E, Hamelers B, Rozendal R, et al. Microbial fuel cells: methodology and technology[J].EnvironmentalScience&Technology, 2006,40(17):5181-5192. DOI:10.1021/es0605016.
[4] Yuan Y, Zhou S G, Zhuang L. A new approach to in situ sediment remediation based on air-cathode microbial fuel cells[J].JournalofSoilsandSediments, 2010,10(7): 1427-1433. DOI:10.1007/s11368-010-0276-5.
[5] Wang X, Cai Z, Zhou Q X, et al. Bioelectrochemical stimulation of petroleum hydrocarbon degradation in saline soil using U-tube microbial fuel cells[J].BiotechnolBioeng, 2012,109(2): 426-433. DOI:10.1002/bit.23351.
[6] Zhang Y Y, Wang X, Li X J, et al. Horizontal arrangement of anodes of microbial fuel cells enhances remediation of petroleum hydrocarbon-contaminated soil[J].EnvironmentalScience&PollutionResearchInternational, 2015,22(3): 2335-2341. DOI:10.1007/s11356-014-3539-7.
[7] Wang H, Yi S, Cao X, et al. Reductive dechlorination of hexachlorobenzene subjected to several conditions in a bioelectrochemical system[J].Ecotoxicology&EnvironmentalSafety, 2017,139:172-178. DOI:10.1016/j.ecoenv.2017.01.039.
[8] 魏金枝, 冯玉杰, 刘峻峰,等. 电催化氧化降解内分泌干扰物阿特拉津[J]. 哈尔滨工业大学学报, 2010, 42(12):1887-1891.
Wei Jinzhi, Feng Yujie, Liu Junfeng, et al. Degradation of endocrine disruptor atrazine by electrocatalytic oxidation[J].JournalofHarbinInstituteofTechnology, 2010,42(12):1887-1891.(in Chinese)
[9] An J, Kim B, Nam J, et al. Comparison in performance of sediment microbial fuel cells according to depth of embedded anode[J].BioresourceTechnology, 2013,127(1): 138-142. DOI:10.1016/j.biortech.2012.09.095.
[10] Wang H, Yi S, Cao X, et al. Reductive dechlorination of hexachlorobenzene subjected to several conditions in a bioelectrochemical system[J].Ecotoxicology&EnvironmentalSafety, 2017,139:172-178. DOI:10.1016/j.ecoenv.2017.01.039.
[11] 万芳,焦淑倩,刘琪,等.生物质活性炭纤维笼电极微生物燃料电池产电性能[J].环境工程学报,2016,10(10):5395-5399.DOI:10.12030/j.cjee.201602115.
Wan Fang, Jiao Shuqian, Liu Qi, et al. Electrochemical performance of MFC with cage-shaped cathode from the biomass-based activated carbon fiber[J].ChineseJournalofEnvironmentalEngineering, 2016,10(10):5395-5399. DOI:10.12030/j.cjee.201602115. (in Chinese)
[12] Rezaei F, Richard T L, Brennan R A, et al. Substrate-enhanced microbial fuel cells for improved remote power generation from sediment-based systems[J].EnvironmentalScience&Technology, 2007,41(11): 4053-4058. DOI:10.1021/es070426e.
[13] 邓欢, 薛洪婧, 姜允斌,等. 土壤微生物产电技术及其潜在应用研究进展[J]. 环境科学, 2015, 36(10):3926-3934. DOI:10.13227/j.hjkx.2015.10.050.
Deng Huan, Xue Hongjin, Jiang Yunbing, et al. Research progress electricity and its in technology of using soil microorganisms to generate potential applications[J].EnvironmentalScience, 2015,36(10):3926-3934. DOI:10.13227/j.hjkx.2015.10.050.(in Chinese)
[14] Li X J, Wang X, Zhang Y Y, et al. Salinity and conductivity amendment of soil enhanced the bioelectrochemical degradation of petroleum hydrocarbons[J].SciRep, 2016,6:32861. DOI:10.1038/srep32861.
[15] Kronenberg M, Trably E, Bernet N, et al. Biodegradation of polycyclic aromatic hydrocarbons: Using microbial bioelectrochemical systems to overcome an impasse[J].EnvironmentalPollution, 2017,231(Pt 1): 509-523. DOI:10.1016/j.envpol.2017.08.048.
[16] Li X J, Wang X, Zhang Y Y, et al. Extended petroleum hydrocarbon bioremediation in saline soil using Pt-free multianodes microbial fuel cells[J].RscAdvances, 2014,4(104):59803-59808.
[17] 赵亚楠, 李秀芬, 任月萍,等. 阳极添加三价铁离子对沉积型微生物燃料电池运行特性的影响[J]. 环境工程学报, 2015, 9(12):6073-6077.
Zhao Yanan, Li Xiufen, Ren Yueping, et al. Effect of Fe(Ⅲ) added into anode region on performance of sediment microbial fuel cell. [J].ChineseJournalofEnvironmentalEngineering, 2015,9(12):6073-6077. (in Chinese)
[18] Domínguez-Garay A, Berná A, Ortizbernad I, et al. Silica colloid formation enhances performance of sediment microbial fuel cells in a low conductivity soil[J].EnvironmentalScience&Technology, 2013,47(4):2117-2121. DOI:10.1021/es303436x.
[19] Li X, Wang X, Ren Z J, et al. Sand amendment enhances bioelectrochemical remediation of petroleum hydrocarbon contaminated soil[J].Chemosphere, 2015,141:62-70. DOI:10.1016/j.chemosphere.2015.06.025.
[20] Kumar A, Singh N. Atrazine and its metabolites degradation in mineral salts medium and soil using an enrichment culture[J].EnvironmentalMonitoring&Assessment, 2016,188(3):142-1-142-12. DOI:10.1007/s10661-016-5144-3.
[21] 张晶, 李茹莹, 季民. 沉积物性质对沉积物微生物燃料电池产电性能的影响[J]. 环境科学学报, 2015, 35(3):797-804. DOI:10.13671/j.hjkxxb.2014.0856.
Zhang Jing, Li Ruying, Ji Ming. Influence of sediment characteristics on the power generation capability[J].ActaScientiaeCircumstantiae, 2015,35(3):797-804. DOI:10.13671/j.hjkxxb.2014.0856. (in Chinese)
[22] Li X J, Wang X, Wan L L, et al. Enhanced biodegradation of aged petroleum hydrocarbons in soils by glucose addition in microbial fuel cells[J].JournalofChemicalTechnology&Biotechnology, 2015,91(1): 267-275. DOI:10.1002/jctb.4660.
[23] 冯玉杰, 王鑫, 李贺,等. 乙酸钠为基质的微生物燃料电池产电过程[J]. 哈尔滨工业大学学报, 2007, 39(12):1890-1894. DOI:10.3321/j.issn:0367-6234.2007.12.010.
Feng Yujie, Wang Xin, Li He, et al. Research on electricity generation process in microbial fuel cell Based on sodium acetate[J].JournalofHarbinIndustryofTechnology, 2007,39(12):1890-1894. DOI:10.3321/j.issn:0367-6234.2007.12.010. (in Chinese)
[24] Logan B E, Regan J M. Electricity-producing bacterial communities in microbial fuel cells[J].TrendsinMicrobiology, 2006,14(12): 512-518. DOI:10.1016/j.tim.2006.10.003.
[25] Hong S W, Kim H J, Choi Y S, et al. Field experiments on bioelectricity production from lake sediment using microbial fuel cell technology[J].Bulletin-KoreanChemicalSociety, 2008,29(11):2189-2194.
[26] Song T S, Yan Z S, Zhao Z W, et al. Removal of organic matter in freshwater sediment by microbial fuel cells at various external resistances[J].JournalofChemicalTechnology&Biotechnology, 2010,85(11):1489-1493. DOI:10.1002/jctb.2454.
[27] Sajana T K, Ghangrekar M M, Mitra A. Effect of presence of cellulose in the freshwater sediment on the performance of sediment microbial fuel cell[J].BioresourTechnol, 2014,155(155C):84-90. DOI:10.1016/j.biortech.2013.12.094.
[28] 宋天顺, 晏再生, 胡颖,等. 沉积物微生物燃料电池修复水体沉积物研究进展[J]. 现代化工, 2009, 29(11):15-19. DOI:10.3321/j.issn:0253-4320.2009.11.003.
Song Tianshun, Yan Zaisheng, Hu Yin, et al. Progress in aquatic sediment remediation by sediment microbial fuel cell[J].ModernChemicalIndustry, 2009,29(11):15-19. DOI:10.3321/j.issn:0253-4320.2009.11.003. (in Chinese)
[29] 张千丰,王光华. 生物炭理化性质及对土壤改良效果的研究进展[J].土壤与作物,2012,1(4) : 219-226.
Zhang Qianfeng, Wang Guanghua. Research progress of physiochemical properties of biochar and its effects as soil amendments [J].SoilandCrop, 2012,1(4) : 219-226. (in Chinese)
[30] Khan M J, Iqbal M T. Modelling and analysis of electro-chemical, thermal, and reactant flow dynamics for a PEM fuel cell system[J].FuelCells, 2005,5(4): 463-475.
[31] 杨芳, 李兆华, 肖本益. 微生物燃料电池内阻及其影响因素分析[J]. 微生物学通报, 2011, 38(7):1098-1105.
Yang Fang, Li Zhaohua, Xiao Benyi. Analysis of internal resistance and its influencing factors of MFC[J].MicrobiologyChina, 2011,38(7):1098-1105. (in Chinese)
[32] Hamdan H Z, Salam D A, Hari A R, et al. Assessment of the performance of SMFCs in the bioremediation of PAHs in contaminated marine sediments under different redox conditions and analysis of the associated microbial communities[J].ScienceoftheTotalEnvironment, 2017,575:1453-1461. DOI: 10.1016/j.scitotenv.2016.09.232.
[33] Cao X, Song H L, Yu C Y, et al. Simultaneous degradation of toxic refractory organic pesticide and bioelectricity generation using a soil microbial fuel cell[J].BioresourceTechnology, 2015,189:87-93.
[34] Chiou C T, Kile D E. Contaminant sorption by soil and bed sediment; is there a difference?[R]. US Geological Survey Fact Sheet 087-00, 2000.
[35] Houot S, Barriuso E, Bergheaud V. Modifications to atrazine degradation pathways in a loamy soil after addition of organic amendments[J].SoilBiology&Biochemistry, 1998,30(14):2147-2157.
