产脲节杆菌DnL1-1与小麦联合对阿特拉津降解的影响
2019-09-18杨凯BazhanovDmitry李红梅李玲李成云李纪顺扈进冬杨合同陈相峰
杨凯,Bazhanov Dmitry,2,李红梅,李玲,李成云,李纪顺,扈进冬,杨合同,陈相峰
(1.齐鲁工业大学(山东省科学院)生态研究所,山东省应用微生物重点实验室,山东 济南 250103;2.聊城大学农学院,山东 聊城 272000;3.齐鲁工业大学(山东省科学院)山东省分析测试中心,山东 济南 250014)
阿特拉津(2-氯-4-二乙胺基-6-异丙胺基-1,3,5-三嗪,Atraizne)是一种广泛用于阔叶杂草和一些禾本科杂草防除的三嗪类除草剂.由于玉米体内具有相应的解毒酶,对其具有很强的耐受能力,常用于玉米田杂草的防除[1].阿特拉津在土壤中半衰期较长,易对小麦等后茬敏感作物产生药害[2],尤其是在小麦-夏玉米-小麦的轮作制度下,阿特拉津的应用,残留及其污染土壤的修复受到了人们的广泛关注.
阿特拉津溶淋性好,迁移率高,持效期长,已造成了许多国家的土壤、地表水和地下水污染[3].在我国,由于阿特拉津的广泛使用及其水溶性强的特性,对于阿特拉津在水环境中的污染情况已有不少报道[4-6].土壤作为阿特拉津的重要储存介质,是将其传输给农产品的重要媒介,土壤中阿特拉津的残留直接影响着农产品产量及质量.而阿特拉津是一种潜在的致癌物和内分泌干扰物,且具有诱导肿瘤发生和减轻体重等慢性毒性,而有研究表明阿特拉津的脱烷基代谢产物的毒性与阿特拉津相当或更大[7-8].因此,如何对阿特拉津污染土壤进行有效修复,降低阿特拉津及其代谢产物在土壤中的残留,减少阿特拉津及其代谢产物汇入水介质的机会,从而减少其对人们带来的潜在威胁,是科学研究者的目标.
目前,众多科研人员致力于阿特拉津污染土壤的修复,尝试了各种的生物降解方法,包括植物、真菌以及细菌等[9].本课题组前期也筛选分离了大量的阿特拉津降解菌,如假单胞菌、诺卡氏菌、土壤杆菌以及节杆菌等[10].但微生物-植物联合对阿特拉津降解的报道较少,敏感作物小麦与微生物联合对阿特拉津降解的研究也是鲜有报道,而关于降解菌对于阿特拉津主要降解产物残留方面的研究则未见报道.本课题组前期研究表明,产脲节杆菌(Arthrobacterureafaciens)DnL1-1具有很好的阿特拉津降解能力,且能在作物根际有效定殖,并与小麦及紫花苜蓿联合作用对阿特拉津具有很好的降解效果[11].
因此,本研究在前期基础上研究考察了小麦对不同阿特拉津含量土壤中产脲节杆菌-DnL1-1种群分布的影响,DnL1-1-与小麦联合对阿特拉津的降解效果以及对其降解产物的影响,以期为阿特拉津污染土壤的修复提供参考.
1 材料与方法
1.1 材料
1.1.1 供试菌株和植物 产脲节杆菌-DnL1-1菌株为本实验室从山东省玉米田土壤中分离并保存于中国普通微生物菌种保藏管理中心(CGMCC),登记编号为CGMCC 9667.试验所用植物为‘济麦14号’,盆栽试验在光照培养箱中进行,温度昼25 ℃,夜18 ℃.
1.1.2 供试土壤 供试土壤于2017年5月17日采自山东省科学院生物中心试验基地,从未施用过阿特拉津,经PCR检测及富集培养,不含阿特拉津降解菌,自然风干后,过筛(5 mm)备用.
1.1.3 培养基及试剂 试验使用SM及SMY培养基[10].SM培养基:0.5 g K2HPO4、0.2 g MgSO4· 7H2O、0.1 g NaCl、0.02 g CaCl2、2 g 葡萄糖、10 mL阿特拉津原液(1 mL 吐温-80、5 g 阿特拉津原药、100 mL蒸馏水),5 mL ZnFe-citrate 原液(0.04 g ZnSO4· 7H2O、0.4 g FeSO4· 7H2O、10 g柠檬酸钠、100 mL蒸馏水,121°C灭菌30 min;SMY培养:基SM培养基中加入0.1 g/L酵母粉;试剂均为国产分析纯或色谱纯;阿特拉津原药,纯度为97%,由山东省潍坊科赛基农化工有限公司提供;5 mmol/L KH2PO4溶液(0.68 g KH2PO4、1000 mL蒸馏水),阿特拉津原液(1 mL 吐温-80、5 g 阿特拉津原药、100 mL蒸馏水).
1.2 方法
1.2.1 接种液制备 将产脲节杆菌DnL1-1菌种活化后,用接种环挑取单菌落接种于50 mL液体培养基中,于28 ℃、180 r/min摇床上培养24 h,之后按照不同比例稀释制成菌悬液,备用.
1.2.2 小麦-产脲节杆菌DnL1-1对不同浓度阿特拉津的降解影响 试验用容器为500 mL的塑料盆,每盆中添加供试土壤300 g,每盆加70 mL 5 mmol/L KH2PO4溶液,或阿特拉津质量浓度为25、2、0.5 μg/mL的5 mmol/L KH2PO4溶液.将催芽后的小麦种子分别在不同稀释倍数的菌悬液中浸种1 h,得到不同浓度的接种种子.选取长势一致、均匀饱满的小麦种子种植于盆内,非浸种的对照种子同样处理.设置3种阿特拉津添加浓度的土壤:1 750,140,35 μg/盆.对不同浓度阿特拉津污染土壤进行5种不同处理:①只种植小麦(小麦);②种植小麦+接菌(小麦+DnL1-1);③只接菌(DnL1-1);④对照,无小麦,未接菌;⑤对照,未培养.每个处理4个重复,每盆种植小麦10粒.之后锡箔纸包盆,模拟土壤黑暗环境,置于托盘上,放于光照培养箱中培养,期间定期浇水.28 d后收集土壤,对产脲节杆菌DnL1-1的定殖情况,以及土壤中阿特拉津及其降解产物的含量进行测定.
1.2.3 接种浓度及定殖浓度检测 浸种后,取10粒小麦种子于2 mL离心管中,分别用1 mL和2.5 mL SM盐缓冲液洗涤,在涡旋振荡器上最大速度震荡10 min,悬液为0稀释度,然后分别对悬液进行10倍梯度稀释,不同稀释度的菌悬液涂布到SM平板上,28 ℃培养4 d,对平板上产生降解圈的菌落进行计数[11-12].
28 d后收获,取每个重复3根小麦主根系及1 g非根际土,分别用3.5 mL和10 mL SM盐缓冲液洗涤,在涡旋振荡器上最大速度震荡10 min,悬液为0稀释度,然后分别对悬液进行10倍梯度稀释,不同稀释度的菌悬液涂布到SM平板上,28 ℃培养4 d,对平板上产生降解圈的菌落进行计数[11-12].
1.2.4 样品萃取与测定 土壤样品的前处理使用涡旋振荡的方法[13];使用优化后的高效液相色谱-质谱联用的方法对土壤中萃取的阿特拉津及其降解产物进行测试分析,高效液相色谱-质谱采用Utimate 3000 HPLC-Thermo TSQ-Vantage液相色谱/质谱联用仪[13],色谱条件:柱温28 ℃;流速0.6 mL/min;进样量10 μL;流动相:A甲醇,B水(0.1%甲酸);二元梯度分离,梯度顺序:0~6 min,95%B;6~20 min,10%B;20~25 min,10%B;25~25.1 min,95%B;25.1~30 min,95%B.质谱条件:电喷雾电离(ESI+)离子源;离子源温度:350°C;毛细管电压:3.5 kV;脱溶剂温度:350°C;脱溶剂气(氮气)气压:60 arb;辅助气(氮气)气压:30 arb;碰撞气压(氩气):0.2 Pa;多反应监测(MRM)模式.ATZ及其降解产物的质谱优化参数列于表1.阿特拉津及其降解产物羟基阿特拉津(HA)、脱乙基阿特拉津(DEA)、脱异丙基阿特拉津(DIA)和脱乙基脱异丙基阿特拉津(DAA)的标准品信息及测试分析方法参照文献[14].
1.3 数据处理
采用Microsoft Excel 2007和SPSS 19.0软件处理数据,并进行绘图、分析和统计,并采用Duncan法(新复极差法)进行显著性分析.

表1 阿特拉津及其降解产物的质谱优化条件
*定量离子 Quantitative ion.
2 结果与分析
2.1 产脲节杆菌DnL1-1在小麦根际的定殖效果
本试验对小麦与DnL1-1联合修复阿特拉津过程中DnL1-1的定殖情况进行了分析(表2).结果表明,不同接菌浓度处理,DnL1-1在小麦根际的定殖浓度均显著高于在非根际土里的定殖浓度.随着阿特拉津浓度的逐渐降低,小麦根际及非根际土中DnL1-1定殖浓度也逐渐降低,在阿特拉津浓度为5 833.3 μg/kg时定殖效果最好,而当接菌浓度相同时,阿特拉津浓度为466.7 μg/kg的处理中DnL1-1在土壤及小麦根际的种群密度均显著高于阿特拉津浓度为116.7 μg/kg的处理,说明阿特拉津作为DnL1-1的唯一氮源,对DnL1-1种群密度的增长影响显著.种植小麦土壤中DnL1-1数量明显高于未种植小麦土壤,均达到显著水平,说明小麦根系促进了DnL1-1的增殖,其原因可能与小麦生长过程中产生的根系分泌物有关.
当阿特拉津浓度为116.7 μg/kg时,小麦并不能显著促进DnL1-1的种群生长,但却能在接种DnL1-1一定浓度的前提下显著促进阿特拉津的降解.根据前期研究[14],在高浓度阿特拉津时,DnL1-1能快速建立种群,符合R策略的种群生长规律,而在低浓度阿特拉津或无阿特拉津时,DnL1-1的种群密度不能维持增长,甚至逐渐减退,说明阿特拉津对于DnL1-1的快速繁殖,建立优势种群密度是不可或缺的.因此,若要使DnL1-1形成优势种群,DnL1-1的接菌浓度必须足够高,以建立不低于105CFU/g根重的根际种群密度以及不低于104CFU/g土重的土壤种群密度,如此才能更好地发挥DnL1-1优势菌群的作用.
2.2 小麦对产脲节杆菌DnL1-1降解阿特拉津的影响
由图1可知,经HPLC-MS/MS分析,当阿特拉津浓度为5 833.3、466.7、116.7 μg/kg时,28 d后,DnL1-1与小麦协同对阿特拉津的降解率依次为98.4%、92.0%、75.5%和84.5%,均显著高于相应的DnL1-1单独使用对阿特拉津的降解率,降解率依次为93.0%、72.0%、64.3%和77.2%.随着阿特拉津浓度的逐渐降低,DnL1-1与小麦协同对阿特拉津的降解效率随之逐渐降低.阿特拉津浓度为116.7 μg/kg时,接菌浓度5.7 lg CFU/粒时,DnL1-1与DnL1-1+小麦两种处理对阿特拉津的降解率均显著高于接菌浓度为4.9 lg CFU/粒的处理(图1-C,1-D),说明小麦与DnL1-1协同明显有助于阿特拉津降解率的提高,同时DnL1-1接菌浓度的高低,也直接影响着对阿特拉津的降解率.
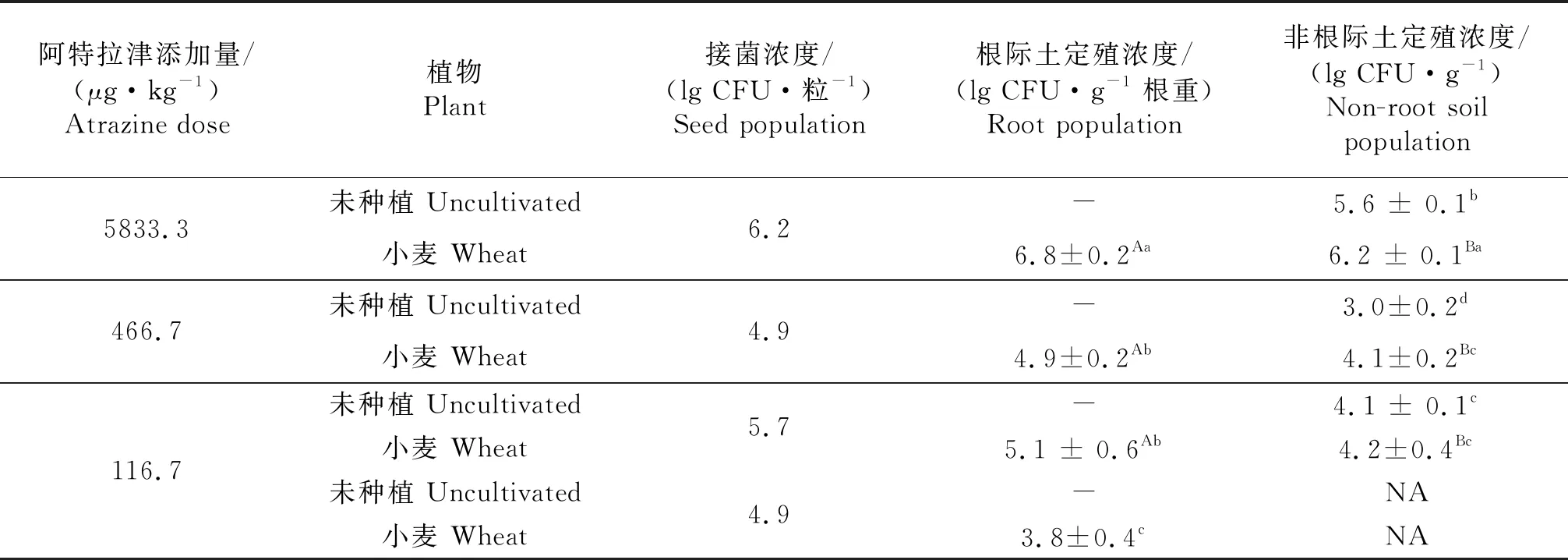
表2 产脲节杆菌DnL1-1在土壤及植物根际的种群密度
NA:未检测到;大写字母表示每行之间的比较,小写字母表示每列之间的比较,字母不同表示差异显著(P<0.05).
NA:Not analysed;The different capital letters mean significant difference in the same row (P<0.05);The different small letters mean significant difference in the same column(P<0.05).
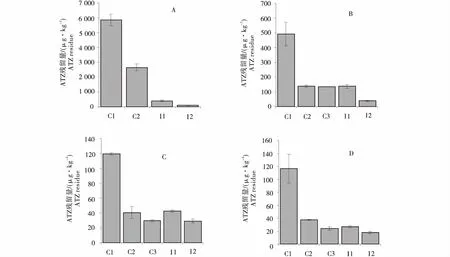
A~D:阿特拉津浓度依次为5 833.3、466.7、116.7、116.7 μg/kg;C、D:DnL1-1接菌浓度分别为4.9、5.7 lg CFU/粒;处理:未培养(C1),未接菌,无植物(C2),小麦(C3),DnL1-1(I1),DnL1-1+小麦(I2).The atrazine rate of A~D:5 833.3,466.7,116.7,116.7 μg/kg;The inoculum levels of C,D:4.9,5.7 lg CFU/seed;Treatments:not incubated pots (C1),not inoculated not planted pots (C2),wheat (C3),DnL1-1(I1),DnL1-1+wheat (I2)).图1 产脲节杆菌DnL1-1对小麦根部阿特拉津的降解效果Figure 1 Root-associated degradation of atrazine by A.ureafaciens DnL1-1
2.3 小麦-DnL1-1协同对阿特拉津及其代谢产物残留的影响
目前已有不少研究对土壤中阿特拉津的残留进行了报道[15-18],其中于晓斌[17]对吉林省不同玉米种植区阿特拉津的残留进行检测,其中阿特拉津最大残留量变化范围为169~295 μg/kg,该残留量对水稻、小麦、大白菜、黄瓜、番茄等均是不安全的,对后茬作物的种植存在着较高风险[18].本实验室在前期研究的基础上,选择阿特拉津浓度为116.7 μg/kg,DnL1-1接菌浓度为5.7 lg CFU/粒时对阿特拉津及其降解产物的残留积累量进行分析.由表3可知,未接菌、无植物的处理对阿特拉津的降解率可达67.9%.对阿特拉津降解产物的分析结果显示DEA是阿特拉津的主要代谢产物,HA、DIA、DAA则为次要代谢产物(图2).小麦与DnL1-1协同对阿特拉津的降解率可达84.5%,与未接菌、无植物的对照相比有效减少了其降解产物DEA、DAA、HA和DIA(61.6%、52.2%、9.7%和24.4%).与单独接菌DnL1-1的处理相比,DEA、DAA和DIA的积累量则减少46.3%、49.2%和15%,差异显著,而HA的积累量则变化不大.未接菌小麦处理与对照相比,阿特拉津降解产物DEA、DAA和DIA的残留积累量减少50.0%、59.7%和20.0%.在未接菌+无植物及未接菌+小麦的处理中,阿特拉津及其降解产物的总摩尔质量分别为0.07、0.04 μmol/kg,是空白土壤对照中总摩尔质量的64.2%、38.9%(图2,表3).而DnL1-1与小麦 + DnL1-1处理的总摩尔质量分别为0.05、0.03 μmol/kg,占起始总摩尔质量的48.6%、31.9%.以上数据表明,小麦+DnL1-1处理不仅能高效降解阿特拉津,还可以减少其降解产物HA、DEA、DAA等的积累,降低阿特拉津及其降解产物对小麦的药害,而未接菌+小麦处理对阿特拉津降解产物DEA、DAA和DIA残留积累量的降低同样效果显著,对HA效果不显著,因此对于小麦对阿特拉津及其降解产物的作用机制仍需进一步探索.
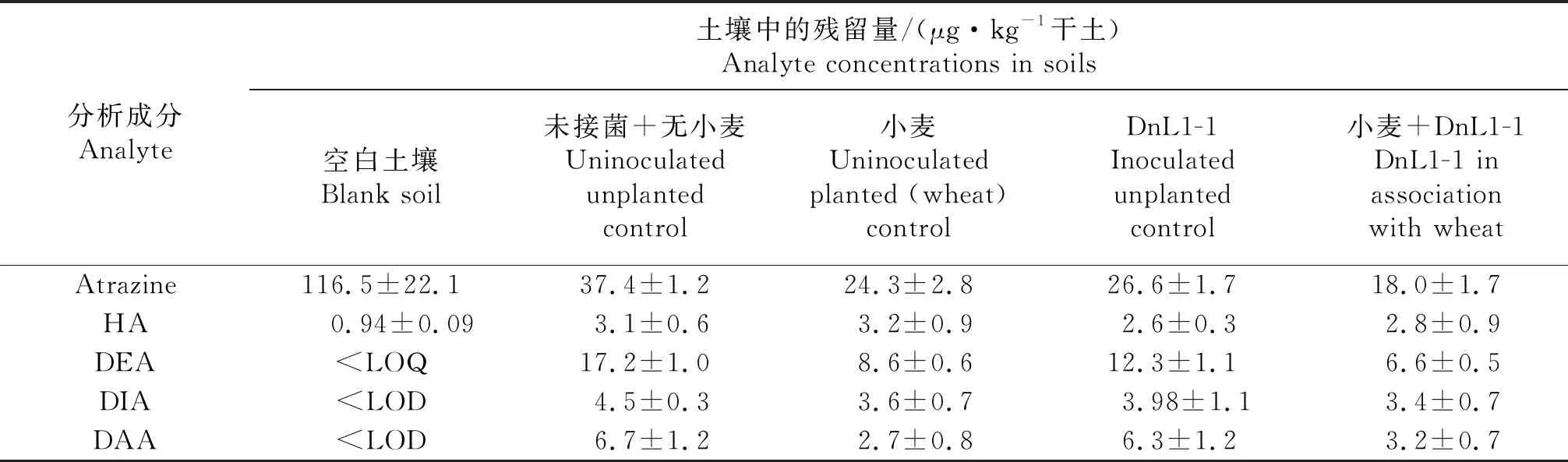
表3 土壤中阿特拉津及其降解产物的定量检测
LOD:检出限;LOQ:定量限.
LOD:Limit of detection;LOQ:Limit of quantity.
3 讨论
目前,关于植物对阿特拉津降解方面的研究已有相关报道.Lin等[19]研究发现,风倾草能够降解80%以上的阿特拉津.Merini等[20]研究了多花黑麦草对阿特拉津的植物降解作用及机制.Singh等[21]研究植物对阿特拉津的降解作用,结果显示狼尾草根际的分泌物可刺激阿特拉津的降解,同时植物的根系可帮助微生物在土壤中扩散,因此降解菌可进入深土层,可更好地加速阿特拉津的降解.陈建军等[22]研究发现皇竹草可促进土壤中阿特拉津的降解.王绘砖等[23]及斯华敏等[24]就转基因烟草对阿特拉津的生物降解进行了研究,且效果显著.但关于植物与微生物联合修复阿特拉津污染土壤研究报道的仍属少数.
植物对阿特拉津的降解主要是通过植物的吸收、累积及根际矿化作用等途径,而植物与微生物联合可通过植物改变微生物区系结构,增加其数量或提高其活性从而加快阿特拉津的降解[22].Kirk等[25]研究发现,黑麦草、紫花苜蓿的根系活动能提高根际环境中微生物的种类、数量,促进石油烃的降解.陈建军等[22]发现皇竹草能增加土壤中的细菌、放线菌的数量,促进对阿特拉津的降解.本研究中也发现小麦能够促进阿特拉津降解菌DnL1-1的种群数量,从而提高对阿特拉津的降解率,这些研究结果都说明可能是在植物-微生物系统中,小麦生长过程中释放的根系分泌物为DnL1-1生长提供了丰富的影响物质,而阿特拉津的存在则为DnL1-1提供了氮源物质,能促进DnL1-1的活性和生物转化作用.植物还可通过根系扩大微生物活动范围来增强微生物活性[26].Zhang等[27]研究表明,阿特拉津降解菌DNS10与狼尾草联合使用,30 d可降解土壤中98.1%的阿特拉津,修复效果显著.Gaskin等[28]研究表明在外部根际菌群与宿主植物松树共存时,对土壤中的阿特拉津其修复效率比单独的植物修复高3倍.这些结果都相互验证了植物-微生物联合可促进对阿特拉津的降解这一结果.因此,对于阿特拉津降解菌与植物的联合应用对提高阿特拉津的降解效果,减少阿特拉津及其降解产物的残留积累,实现阿特拉津污染土壤的原位修复,从而降低对作物的药害,提高作物产量和质量具有一定的实践指导意义.Ibrahim等[1]曾研究发现,与小麦相比,玉米对阿特拉津的耐受能力要高2 024倍.因玉米体内具有阿特拉津解毒酶,能有效地减少阿特拉津的积累,与玉米相比,小麦属于敏感作物.多项研究结果表明高浓度阿特拉津对小麦具有明显药害,但在本研究结果中当阿特拉津浓度为116.7 μg/kg时,小麦本身亦能有效地促进阿特拉津的降解,减少其降解产物的残留积累,因此对于低浓度阿特拉津时,小麦本身对阿特拉津的降解修复机制还有待进一步研究.
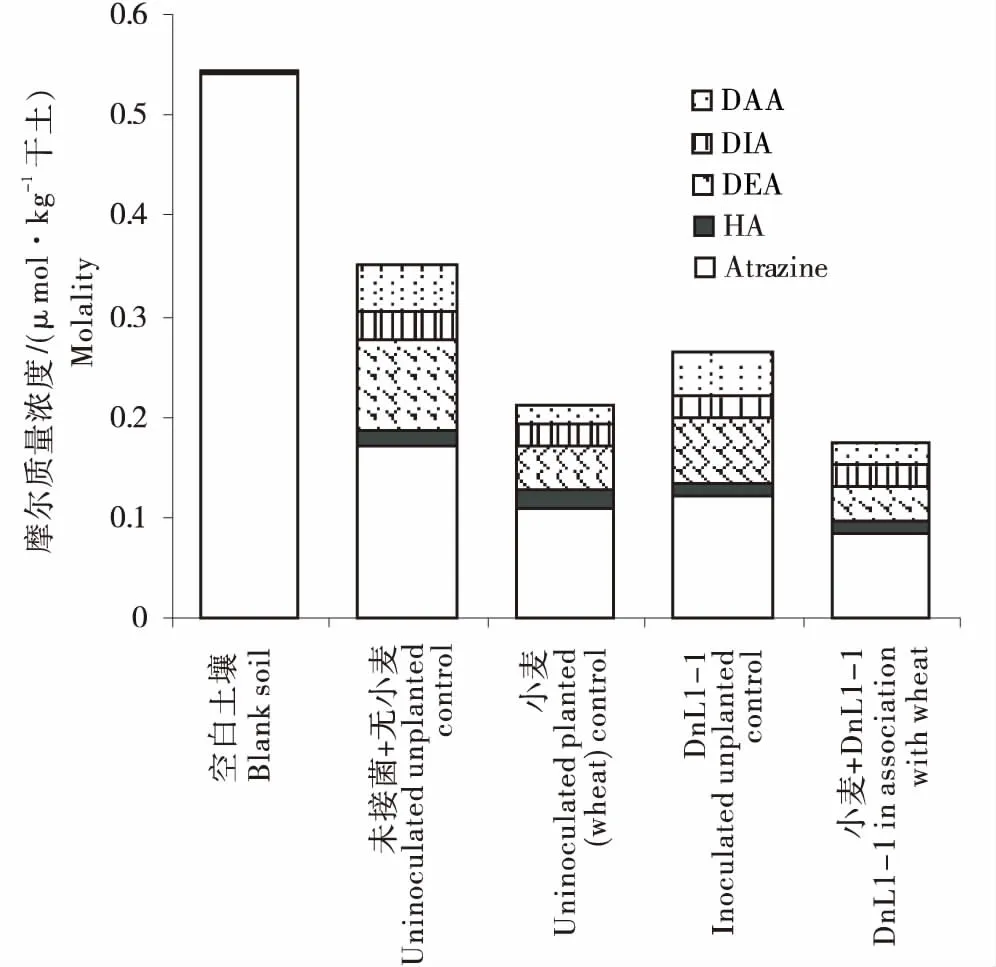
图2 阿特拉津浓度为116.7 μg/kg时,阿特拉津及其降解产物在土壤中的摩尔平衡质量Figure 2 Molar balance of atrazine and its degradation products in soil exposed to the 116.7 μg/kg dose of the herbicide
4 结论
1) 相同接菌浓度时,阿特拉津浓度越高,DnL1-1在土壤中的定殖效果越好,随着阿特拉津浓度的逐渐降低,DnL1-1在土壤中的定殖浓度逐渐降低;不同阿特拉津浓度处理,种植小麦土壤中DnL1-1的种群数量显著高于未种植小麦土壤,在小麦根际的定殖浓度显著高于非根际土.
2) 不同阿特拉津浓度处理(5 833.3、466.7、116.7μg/kg)下,小麦与DnL1-1协同对阿特拉津的降解率(98.4%、92.0%、84.5%)均显著高于DnL1-1单独作用(93.0%、72.0%、77.2%).
3) 阿特拉津浓度为116.7 μg/kg时,小麦与DnL1-1能够有效减少阿特拉津降解产物DEA、DAA、HA和DIA的残留积累量,依次减少61.6%、52.2%、9.7%和24.4%.
