多孔木霉色素的结构鉴定和合成基因簇分析
2018-06-12李大成王炳全董惠钧
洪 虹,岳 雪,李大成,王炳全,董惠钧
(1.聊城市人民医院肾内科,山东 聊城 252000;2.聊城大学 药学院,山东 聊城 252000;3.聊城大学 生物制药研究院,山东 聊城 252000)
环孢菌素是十一环肽的免疫抑制剂,是由丝状真菌多孔木霉(Tolypocladiuminflatum)合成的环肽次级代谢产物,主要用于器官移植免疫排斥和类风湿性关节炎、重症肌无力、系统性红斑狼疮、紫癜以及银屑病等自身免疫疾病的治疗[1]。随着临床研究的深入,环孢菌素A在膜性肾病、肾病综合征以及IgA肾病方面显示出良好的治疗效果[2-4]。
T.inflatum在分泌环孢菌素A过程中,会分泌一种色素,而且色素与环孢菌素A的合成相互影响,但其中的机制并不明了。通常,真菌分泌的色素主要是聚酮类和蒽醌类,都由聚酮合酶(PKS)催化合成[5-7]。研究最深入的真菌色素是红曲菌产生的红曲色素,其PKS合成基因簇已被克隆和鉴定[8-9]。谢娜娜等[10]研究发现:红曲菌的色素和毒素桔霉素分别由独立的PKS合成基因簇控制合成,而且两者的合成途径相互影响,将编码红曲色素的pksPT基因敲除后,红曲菌不再产生任何色素,而且桔霉素产量提高了2.8倍,推测桔霉素和色素的合成互相竞争小分子前体物。彭瑶等[11]发现不同的色素合成基因簇缺失对井冈霉素的合成有不同的影响,多巴类黑色素与井冈霉素的生物合成过程竞争共同前体酪氨酸,将多巴类黑色素基因簇敲除可以提高井冈霉素的产量。
本文旨在通过全基因组挖掘技术分析T.inflatumPKS基因合成基因簇,并进一步解析与色素合成相关的基因簇或基因,为研究T.inflatum中环孢菌素A和色素合成之间的相互作用关系提供理论支撑。
1 材料与方法
1.1 仪器与试剂
460型红外光谱仪,美国尼高力公司;UV3600 型紫外可见分光光度计,日本岛津公司;1100LC/MSD 型质谱仪、PrepHT制备型色谱柱 (21.5 mm×150 mm),美国安捷伦公司;Mercury Plus 400 型核磁共振波谱仪,美国瓦里安公司;PE2400 II 型元素分析仪,美国铂金埃尔默公司;P270 型制备型高效液相色谱仪,大连依利特公司。
甲醇、乙腈、乙醇及氯仿等试剂均为分析纯,汕头西陇化工公司;氘代水,上海金穗生物科技有限公司。
1.2 实验方法
1.2.1T.inflatum色素的分离纯化
按照前期工作提供的方法[12]从T.inflatum培养液中分离纯化色素,主要步骤分为固液分离、柱层析和高压制备液相。首先,收集T.inflatum培养液2 000 mL,减压过滤去除菌丝体,用体积分数30%乙醇淋洗滤饼2次,收集滤液上样弱极性大孔吸附树脂 X-5 层析柱,收集流出液。其次,减压浓缩除去乙醇,用低沸点石油醚(70~90 ℃)萃取2次,合并萃取相并经减压浓缩至干。用氯仿-甲醇-水混合流动相(体积比为50∶ 40∶ 10)溶解上述浓缩物,过滤除去不溶性杂质,上48~75 μm层析硅胶柱,观测红色素层析带的位移并收集红色素部分。最后,将收集的红色素溶液减压浓缩至干,再通过制备型高效液相色谱分离纯度大于99%的红色素。制备高效液相色谱流动相为氯仿-甲醇-水混合溶液(体积比为10∶ 70∶ 20),流速 5 mL/min,检测波长为 237 nm,收集高纯度流出液,60 ℃减压浓缩,40 ℃真空干燥获得色素纯品,色素的纯度由 HPLC 检测分析,由归一化法计算纯度,然后对制得的红色素粉末进行结构鉴定。
1.2.2T.inflatum色素的分析鉴定
参照文献[12]的方法对高度纯化的T.inflatum分泌的色素进行紫外、红外光谱、质谱、元素分析和核磁共振分析。
1.2.3 PKS基因簇预测分析
采用在线分析软件antiSMASH(http://antismash.secondarymetabolites.org)对T.inflatum的全基因组(ID:AOHE00000000)进行分析,解析其次级代谢基因簇。
1.2.4 色素合成基因簇相关基因分析
首先使用NCBI蛋白结构在线数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对预测的各开放阅读框(ORF)进行蛋白保守结构域分析;再用在线保守功能域搜索工具Motif Scan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)验证结构域分析结果。最后采用BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析,预测基因功能。
采用ExPASy(http://www.expasy.org/)在线数据分析系统分析蛋白性质。使用ProtParam(http://web.expasy.org/protparam/)在线软件计算蛋白质的大小、等电点(PI)和氨基酸组成等理化性质。
2 结果与讨论
2.1 T. inflatum色素的分离纯化结果
T.inflatum色素是在环孢菌素A生产过程中产生的一种胞外次级代谢产物,使发酵液呈浅红至红棕色。在前期的工作中,笔者所在课题组建立了固液分离、柱层析和高压制备液相色谱分离红色素的方法和工艺[12]。笔者在前期工艺的基础上,对柱层析工艺和高压制备液相的流动相进行了优化和调整。硅胶柱层析的流动相由乙酸乙酯-石油醚(体积比为46∶ 54)变为氯仿-甲醇-水混合流动相(体积比为50∶ 40∶ 10),高压制备液相流动相由甲醇-乙腈-水(体积比为42∶ 33∶ 35)变为氯仿-甲醇-水(体积比为10∶ 70∶ 20),使用改进的流动相分离色素,结果如图1所示。由图1可知,色素的纯度达到99.1%,能够达到结构鉴定的要求。
2.2 T. inflatum色素的结构鉴定
在前期的工作中,我们通过紫外和红外光谱分析初步确定,T.inflatum色素可能为蒽醌类物质[12]。本文中,笔者进一步通过电喷雾电离质谱(ESI-MS)来分析色素,结果见图2。由图2可知:色素在m/z为271 处有强吸收的分子离子峰,色素的分子量应为270。
元素分析测定结果发现:色素中的C元素为 66.4%,H元素为 3.5%,O元素为 29.6%,没有N、S 和 P元素,初步推断色素分子式为 C15H10O5,不饱和度为11,应为含有苯环结构的物质。
进一步采用核磁共振碳谱和氢谱以及二维谱图对色素进行解析,结果见图3。由图3可知:除化学位移δ40附近的溶剂峰外,具有不同化学位移的碳原子共有15个,分别是192.4、182.1、162.5、162.2、154.6、138.2、134.0、133.8、125.2、121.5、120.2、117.9、116.6、115.1和62.9,并且绝大部分类型的碳原子处于化学位移δ100~200的较低场和最低场,因此可判定色素的碳原子数目为15,而且主要为苯环上多取代的无氢碳原子。

图2 色素的ESI-MS分析Fig.2 Analysis of purified pigment by ESI-MS
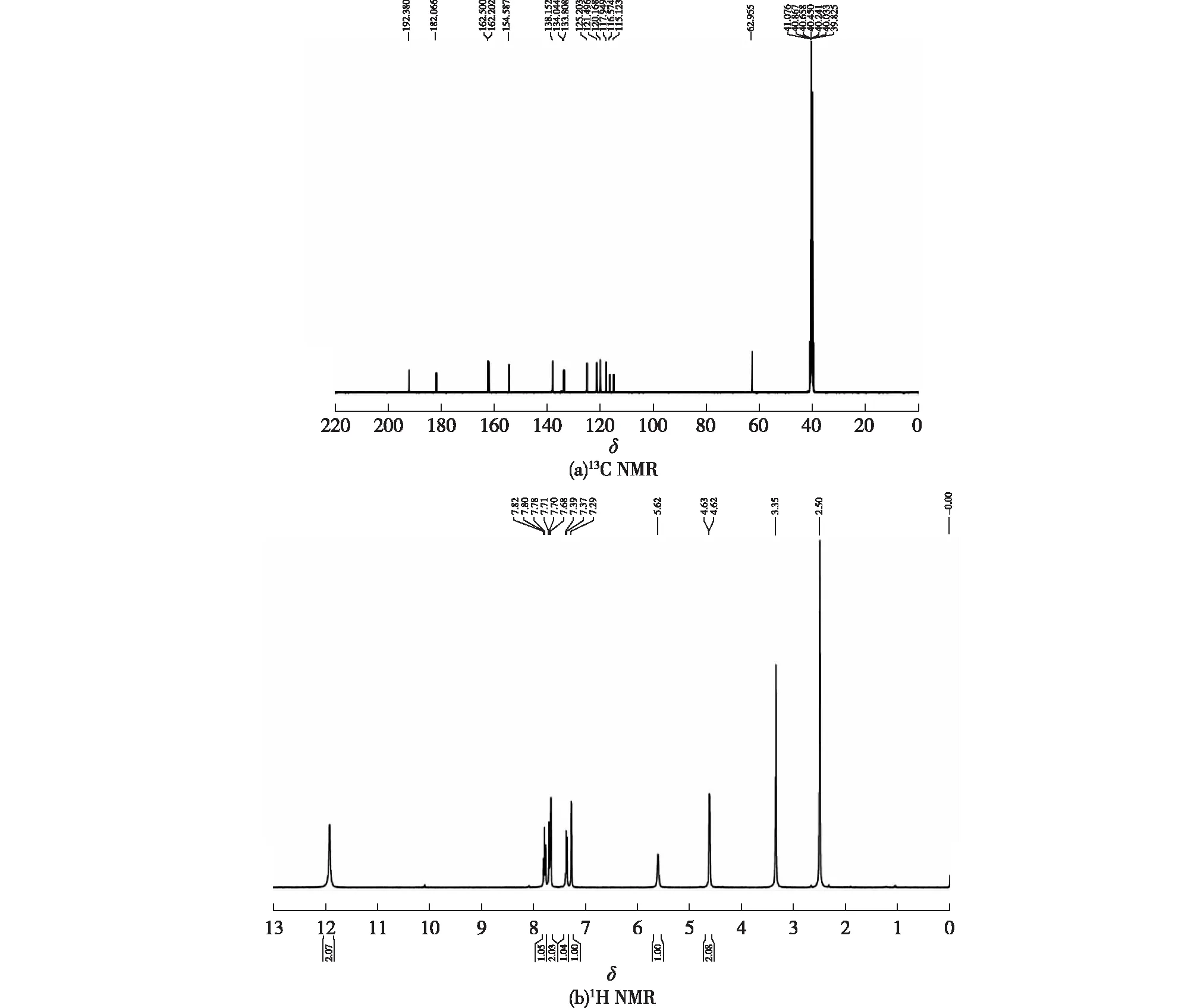
图3 色素纯品的13C NMR和1H NMR图谱Fig.3 13C NMR and 1H NMR graphs of purified pigment
通过无畸变极化转移技术(distortionless enhancement by polarization transfer,DEPT)对核磁共振谱图进行二次数据处理,辨别碳谱中的伯碳、仲碳、叔碳和季碳。DEPT90谱图只显示次甲基向上的峰,DEPT135谱图则显示甲基、次甲基的峰向上,亚甲基峰向下(信号为负)。利用无畸变极化转移技术对来源于T.inflatum的色素进行DEPT90和DEPT135分析,结果见图4。由图4可知:色素中含有5个—CH官能团和1个—CH2官能团。结合氢谱的结果:在位移低场11.94处应为酚羟基氢,数目为2,其余氢谱位移分别为7.80(t,J=8.0 Hz,1H),7.68~7.71 (m,2H),7.39 (d,J=8.0 Hz,1H),7.29 (s,1H),5.62 (brs,1H),4.63 (d,J=4.0 Hz,2H)。

图4 DEPT90和DEPT135分析Fig.4 Analysis of purified pigment by DEPT90 and DEPT135
综上分析,T.inflatum色素的化学结构是含有3个酚羟基和2个酮基的蒽醌类物质(图5),经检索对比,T.inflatum色素与芦荟大黄素的结构类似。芦荟大黄素是一种具有抗菌、抗肿瘤和免疫抑制活性的物质,因此,我们推测T.inflatum色素也具有生理活性,下一步我们将对其生物活性开展相关研究。
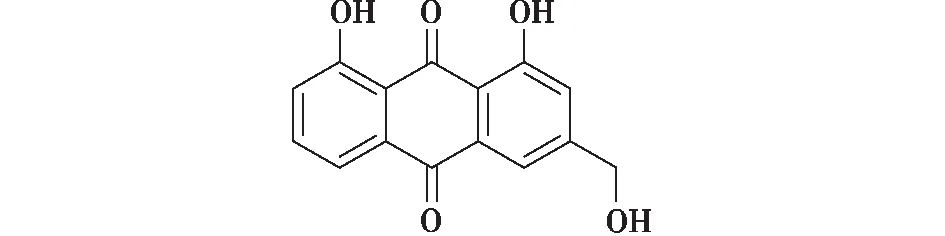
图5 T. inflatum色素化学结构式Fig.5 Chemical structure of T. inflatum pigment
2.3 T. inflatum PKS次级代谢基因簇分析
T.inflatum的次级代谢产物丰富,在已测序的基因组中发现含有丰富的非核糖体肽合成酶基因簇(NRPS)和聚酮合酶基因簇(PKS)[13],其中环孢菌素A就是由非核糖体肽合成酶基因簇合成。在培养T.inflatum的过程中发现,菌株会在分泌环孢菌素A的同时耦合生成一种红色素,而且环孢菌素A产量与红色素产量呈负相关关系[12],表明环孢菌素A与红色素合成途径之间有相互作用,但红色素的生物合成途径以及与环孢菌素A合成之间的相互作用机制不清楚。
采用antiSMASH在线软件对T.inflatum的次级代谢产物进行分析,结果表明:T.inflatum共有43个次级代谢合成基因簇,其中,有13个与非核糖体多肽合成途径(NRPS)相关,15个与Ⅰ型聚酮合酶(T1PKS)途径相关,7个与NRPS-T1PKS途径相关,3个与萜类(terpene)途径相关以及5个未知功能的基因簇。在15个T1PKS基因簇中,可能的次级代谢产物有白灰制菌素、镰刀菌红素、密挤青霉酸和吡里哌若平(表1)。
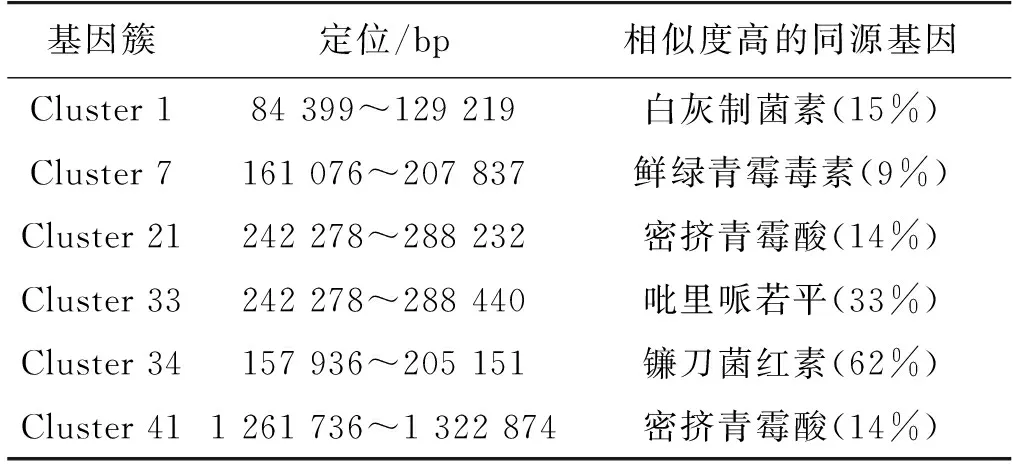
表1 T. inflatum中Ⅰ型PKS合成基因簇的功能预测
2.4 色素合成基因簇相关基因分析
通过antiSMASH预测的T.inflatum色素合成基因簇,结果见图6。由图6可知:该色素的合成基因簇中共有19个开放阅读框(ORFs),长度为47.2 kb,其中核心合成基因为编码甲基转移酶的ORF59和编码聚酮合酶的ORF60。除了核心基因外,该基因簇还含有氧甲基转移酶、丁酰辅酶A还原酶、乙醇脱氢酶和短链脱氢酶等酶促基因,还有转运蛋白和转录调控基因,具体分析结果见表2。

图6 T. inflatum可能的色素合成基因簇Fig.6 Putative biosynthetic gene cluster of T. inflatum pigment

表2 T. inflatum色素合成基因簇中可能的基因功能
2.5 色素PKS合成基因KS保守结构域的进化
PKS合成基因簇中通常由AT和KS结构域组成,其中KS结构域的保守性最强。以T.inflatum色素合成基因簇KS结构域为对象,采用Mega6.0软件构建了KS结构域系统发育树,结果见图7。由图7可知:预测的色素合成基因簇中KS结构域与T.ophioglossoides的孢子黄色素合成基因蔟处在相同的进化分支,相似度最高;另外,该KS结构域与镰刀菌红素以及其他真菌的孢子色素合成基因簇同源性亦很高。
再将预测的色素合成基因簇与3种同源性较高的色素合成PKS基因结构进行对比分析,结果见图8和表3。由图8可知,T.inflatum色素与镰刀菌红色素以及孢子黄色素的PKS合酶的保守结构域类似,都有PKSD结构域,而且T.inflatum色素和镰刀菌红素的分子结构类似,但PKS合酶的大小差异较大,T.inflatum色素的PKS合酶由1 997个氨基酸组成,等电点为5.97,而镰刀菌红素的PKS合酶的大小为3 733个氨基酸,等电点为5.32(表3)。通过上述生物信息学方法预测的T.inflatum色素可能的合成基因簇仍需通过实验进一步验证。

图7 真菌色素KS结构域系统发育树Fig.7 Phylogenetic tree of conserved KS domain from fungus

图8 高同源性的色素PKS合成酶保守功能域Fig.8 Conserved domains of hiher homologous PKS enzymes

色素种类PKS合成酶氨基酸长度(aa)等电点(PI)不稳定系数产物结构孢子黄色素2 2796.1238.6(stable)镰刀菌红素3 7335.3241.89(unstable)多孔木霉色素1 9975.9740.21(unstable)
3 结论
通过分离纯化方法获得了T.inflatum色素纯品,并鉴定了其化学分子结构,该色素是一种蒽醌类物质,分子式为C15H10O5。通过生物信息学方法进一步分析,初步确定了T.inflatum合成的基因簇,该基因簇长度大约为47.2 kb,编码43个ORFs,核心基因为PKS合成酶基因,而且PKS合成酶与镰刀菌红素的同源性非常高,二者合成的目标产物的结构类似。在下一步中研究中,我们将结合本研究所解析的T.inflatum色素合成途径,以阐明该色素与环孢菌素A合成之间的相互关系。
参考文献:
[1] 刘阳,肖庚富.环孢菌素A的研究进展及应用[J].生物技术通报,2006(2):21-24.
[2] 雷鸣,张虹.环孢菌素联合科素亚对IgA肾病疗效观察[J].深圳中西医结合杂志,2016,26(7):75-76.
[3] 朱玉娴,张玉强,孙丽君,等.环孢素A与吗替麦考酚酯治疗难治性肾病综合征疗效对比[J].中国中西医结合肾病杂志,2010,11(11):970-973.
[4] 张丹.环磷酰胺与环孢菌素A治疗膜性肾病的临床疗效研究[J].保健医学研究与实践,2016,13(4):50-51.
[5] TULI H S,CHAUDHARY P,BENIWAL V,et al.Microbial pigments as natural color sources:current trends and future perspectives[J].J Food Sci Technol,2014,52(8):4669-4678.
[6] CHEN Y,FENG P,SHANG Y,et al.Biosynthesis of non-melanin pigment by a divergent polyketide synthase inMetarhiziumrobertsii[J].Fungal Genet Biol,2015,81:142-149.
[7] YANG Y,LIU B,DU X J,et al.Complete genome sequence and transcriptomics analyses reveal pigment biosynthesis and regulatory mechanisms in an industrial strain,MonascuspurpureusYY-1[J].Sci Rep,2015,5:8331-8341.
[8] XIE N,LIU Q,CHEN F.Deletion ofpigRgene inMonascusruberleads to loss of pigment production[J].Biotechnol Lett,2013,35(9):1425-1432.
[9] BALAKRISHNANA B,KARKI S,CHIU S H,et al.Genetic localization and in vivo characterization of aMonascusazaphilonepigment biosynthetic gene cluster[J].Appl Microbiol Biotechnol,2013,97(14):6337-6345.
[10] 谢娜娜,张乙平,陈福生.红色红曲菌M7中色素聚酮合酶基因敲除突变体的鉴定[J].微生物学报,2015,55(7):863-872.
[11] 彭瑶,芦晨阳,白林泉.吸水链霉菌井冈变种的色素合成基因缺失对井冈霉素产量的影响[J].微生物学报,2016,56(11):1719-1729.
[12] BUSHLEY K E,RAJA R,JAISWAL P,et al.The genome ofTolypocladiuminflatum:evolution,organization,and expression of the cyclosporine biosynthetic gene cluster[J].PLoS Genet,2013,9(6):e1003496.
[13] 董惠钧,张彤鑫,昌大莉.多孔木霉中红色素的初步鉴定及其与环孢菌素A对底物缬氨酸的竞争[J].微生物学通报,2014,41(10):2076-2081.
