高产3-羟基丁酮解淀粉芽孢杆菌的选育及发酵优化
2018-06-11王诗卉罗秋玲刘佳刘立明陈修来
王诗卉,罗秋玲,刘佳,刘立明,陈修来
1 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122
2 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
3 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122
3-羟基丁酮 (Acetoin) 具有特殊的奶油香气,天然存在于可可、干酪、香蕉、葡萄、玉米等许多食品中,是一种广泛使用的食品级香料[1]。同时,3-羟基丁酮作为一种重要的四碳平台化合物,被美国能源部列为30种优先开发利用的平台化合物之一[2],具有高附加值,可广泛应用于手性药物和化学中间体的合成[3]。
目前,3-羟基丁酮的生产方法主要有化学合成、酶转化和微生物发酵法[4]。相较于其他方法,微生物发酵法具有高效、稳定、低碳等明显优势,能实现大规模工业化生产,从而逐渐成为人们关注的焦点。Zhang等筛得一株高产 3-羟基丁酮的多粘类芽孢杆菌,通过连续性统计学实验对发酵培养基成分进行优化,并利用两阶段搅拌转速控制策略得到3-羟基丁酮55.3 g/L[5]。Sun等经过发酵优化,采用两阶段溶氧控制策略,使得一株粘质沙雷氏菌的3-羟基丁酮产量达到75.2 g/L[6]。Li等通过代谢工程改造,弱化一株地衣芽孢杆菌的 2,3-丁二醇脱氢酶,并利用三阶段搅拌转速控制及pH控制的发酵策略得到3-羟基丁酮78.79 g/L,为目前报道以微生物发酵法生产 3-羟基丁酮的最高产量[7]。但是上述发酵法生产3-羟基丁酮的研究主要集中于发酵工艺的优化,大部分产量也相对较低。
3-羟基丁酮高产菌株的选育多是通过传统诱变 (如物理诱变和化学诱变) 或简单筛选 (VP试验) 而获得[8]。然而,相较于传统单一诱变方法的低突变率和操作安全性不足等问题,整合了多种诱变方法的复合诱变具有协调效应,因其突变率高逐渐成为应用热点。Jia等通过紫外线和硫酸二乙酯 (DES) 复合诱变筛得一株耐热的高产 3-羟基丁酮的枯草芽孢杆菌突变株,通过优化发酵温度,以玉米纤维进行同步糖化发酵,得到3-羟基丁酮22.76 g/L,且产率达0.46 g/g (玉米秸秆)[9]。ARTP能够均匀发射等离子体作用于微生物细胞,有效造成 DNA多样性的损伤,利用胞内启动的错配修复机制形成遗传稳定、种类丰富的突变体,突变率高,操作简便、安全[10-11]。60Co γ射线辐照能够直接引起细胞染色体损伤、断裂以及DNA中碱基的变化,产生染色体突变和基因突变,具有突变率高、不易发生回复突变等优势[12]。因此,本实验采用ARTP和60Co γ射线复合诱变的方式,对产 3-羟基丁酮解淀粉芽孢杆菌[13]进行复合诱变筛选,以期提高突变率[14],并获得3-羟基丁酮高产菌株。
1 材料与方法
1.1 材料
1.1.1 菌株
解淀粉芽孢杆菌Bacillus amylolique faciensFMME088由本实验室保藏[14]。
1.1.2 主要试剂
Acetoin、(R,R)-(-)-2,3-Butanediol购自上海阿拉丁生化科技股份有限公司;其他化学试剂购自国药集团化学试剂有限公司。
1.1.3 培养基
固体培养基 (g/L):葡萄糖20,酵母粉10,大豆蛋白胨10,氯化钠5,琼脂粉20,pH 7.0。
固体筛选培养基 (g/L):3-羟基丁酮(0、40、45、50、55、60或65),葡萄糖20,酵母粉10,大豆蛋白胨10,氯化钠5,琼脂粉20,pH 6.5。固体培养基冷却至 60 ℃,加入不同浓度的 3-羟基丁酮溶液 (无菌水溶解、0.22 μm无机滤膜过滤除菌),混合均匀倒平板。
液体筛选培养基 (g/L):葡萄糖180,酵母粉15,大豆蛋白胨 15,MgSO4·7H2O 0.4,K2HPO43,KH2PO43。
种子培养基 (g/L):葡萄糖60,酵母粉10,蛋白胨10,牛肉膏10,氯化钠0.5。
发酵优化培养基 (g/L):葡萄糖 (180、200、210或 220),酵母粉 15,大豆蛋白胨 15,MgSO4·7H2O 0.4, K2HPO43, KH2PO43,CH3COONa (0、0.25、0.5 或 1.0)。
发酵培养基 (g/L):葡萄糖210,酵母粉15,大豆蛋白胨 15,MgSO4·7H2O 0.4,K2HPO43,KH2PO43,CH3COONa 0.5。
1.1.4 主要仪器
Ultimate 3000高效液相色谱仪购自美国戴安公司;ARTP育种机来自思源清生物科技有限公司;60Co γ射线辐照设备由苏州大学提供;5 L发酵罐购自上海保兴生物设备工程有限公司;30 L发酵罐购自瑞士伊浮森生物技术有限公司。
1.2 菌株培养条件
种子培养条件:从甘油管保藏的B. amyloliquefaciensFMME088取 200 μL 接种于装有50 mL无菌种子培养基的500 mL三角瓶中,37 ℃、200 r/min培养12 h。
摇瓶发酵条件:取种子培养物接种于装有70 mL无菌液体筛选培养基的750 mL具挡板三角瓶中,接种量为10% (V/V),37 ℃、200 r/min发酵培养48 h 。
5 L发酵罐发酵条件:5 L发酵罐的发酵优化培养基的装液量为 2.5 L,接种量 10% (V/V),37 ℃,通气比1.0 vvm,发酵过程中pH维持6.5,发酵周期为52 h,搅拌转速0–36 h为350 r/min,36–52 h 为 500 r/min。
30 L发酵罐发酵条件:30 L发酵罐的发酵培养基的装液量为18 L,接种量10% (V/V),37 ℃,通气比1.0 vvm,发酵过程中pH维持6.5,发酵周期为 52 h,搅拌转速 0–36 h为450 r/min,36–52 h为600 r/min。
1.3 复合诱变
1.3.1 菌悬液的制备
从甘油管保藏的B. amyloliquefaciensFMME088取200 μL接种于装有50 mL无菌种子培养基的500 mL三角瓶中,37 ℃、200 r/min培养12 h至对数中后期,将菌液4 ℃、6 000 r/min离心5 min,弃去培养基,菌体用PBS溶液洗涤3次,再用生理盐水重悬,将菌悬液OD600调至3.0。
1.3.2 ARTP诱变及首轮摇瓶筛选
吸取10 μL上述菌悬液滴在灭菌后的金属载片中央,并置于ARTP育种机中诱变,诱变条件详见表1。将诱变处理后的载片放入装有990 μL种子培养基的1.5 mL离心管中,用涡旋振荡仪振荡菌体至少100 s,彻底洗脱菌液,而后转入装有50 mL种子培养基的 500 mL摇瓶中,37 ℃、200 r/min培养12 h,适当稀释后取100 μL涂布于固体培养基,置于37 ℃恒温培养12–36 h。
从含有不同浓度3-羟基丁酮的平板上分别挑取新长出的单菌落于装有 50 mL种子培养基的500 mL三角瓶中,37 ℃、200 r/min培养12 h,以10% (V/V) 的接种量接入装有70 mL发酵培养基的750 mL具挡板三角瓶中,37 ℃、200 r/min发酵48 h,将3-羟基丁酮生产能力较出发菌株优良的突变株再次进行摇瓶发酵验证,筛得 1株3-羟基丁酮生产能力最优的突变株。

表1 ARTP处理条件Table 1 Treatment conditions of ARTP
1.3.3 60Co γ射线辐照处理及二轮摇瓶筛选
将由ARTP筛得的突变株制备菌悬液分置于4支试管中,每管10 mL,直接进行γ射线处理,辐照剂量分别为0、0.6、0.8和0.9 kGy,适当稀释辐照处理后的菌悬液,取100 μL涂布于固体筛选培养基,置于37 ℃恒温培养12–36 h后同1.3.2进行摇瓶发酵验证,所得发酵液进行3-羟基丁酮产量的分析检测,产量最高的菌株即为筛得的最佳突变株。
1.3.4 突变株遗传稳定性分析
将经复合诱变筛得的最优突变株B. amyloliquefaciensH-5进行4–8代的传代培养,分析3-羟基丁酮产量变化。
1.4 5 L发酵罐上培养条件的优化
在5 L发酵罐中按照1.2中培养条件对突变株B. amyloliquefaciensH-5进行发酵培养,发酵24 h时流加不同浓度的葡萄糖,继续发酵至52 h,所得发酵液进行3-羟基丁酮产量的分析检测,确定最优葡萄糖流加浓度。
在上述流加一定浓度葡萄糖的基础上,向发酵优化培养基中添加不同浓度的乙酸钠,按照1.2中培养条件发酵至52 h,所得发酵液进行3-羟基丁酮产量的分析检测,确定最优乙酸钠添加量。
1.5 30 L发酵罐上放大培养
在30 L发酵罐中对突变株B. amyloliquefaciensH-5进行放大培养,按照1.2中优化后的发酵培养基及培养条件发酵至52 h,HPLC检测发酵液中3-羟基丁酮含量。
1.6 分析方法
1.6.1 高效液相色谱 (HPLC) 检测法
取发酵液10 000 r/min离心10 min,收集上清液,并以 3-羟基丁酮、2,3-丁二醇、无水葡萄糖作为标准品,配制不同浓度的标准溶液。将上清液与标准溶液经0.45 μm微孔滤膜过滤后,用高效液相色谱测定 3-羟基丁酮、2,3-丁二醇及葡萄糖的含量。
HPLC检测条件:色谱柱:Aminex HPX-87H;流动相:5 mmol/L稀硫酸;柱温:60 ℃;检测器:示差折光检测器;进样量:10 μL;流速:0.6 mL/min。
1.6.2 紫外分光光度计检测法
取发酵液适当稀释,使用紫外分光光度计在波长为600 nm的条件下测定OD600。
1.6.3 正突变率计算
突变株的正突变率[15]的计算以发酵生产3-羟基丁酮的产量为准。3-羟基丁酮产量较出发菌株提高的突变株定义为正突变株,正突变率(%)=3-羟基丁酮产量提高的诱变菌株数/总诱变菌株数。
2 结果与分析
2.1 ARTP诱变筛选3-羟基丁酮高产菌株
首先对ARTP诱变的处理时间进行优化,如图1所示,正突变株主要集中出现在经ARTP处理120 s和150 s的突变株中,可知该处理时间为本研究中ARTP诱变的最适条件。在此基础上,以B. amyloliquefaciensFMME088为出发菌株进行ARTP诱变,根据3-羟基丁酮产量,对筛选平板上长出的140株ARTP突变株进行首轮筛选,获得39株突变株,其中27株的3-羟基丁酮产量高于出发菌株,正突变率达19.3%。
将初筛得到的正突变株进行首轮复筛,全部突变株的3-羟基丁酮产量均高于出发菌株,其中产量较出发菌株提高 10%以上的突变株见表 2。突变株A-21和A-35较出发菌株的3-羟基丁酮产量分别提高了 24.74%和 26.84%,产率较出发菌株均提高了18.92%,生产强度分别提高了24.79%和 26.44%。突变株 A-21的副产物 2,3-丁二醇为9.42 g/L略高于A-35,发酵后期转化为3-羟基丁酮的潜能更大,且由于 A-21的 3-羟基丁酮产量较A-35稳定。因此,选择A-21作为后续60Co γ射线辐照的出发菌株。

图1 ARTP诱变首轮初筛结果Fig. 1 Preliminary screening results of the first round for mutants with ARTP mutagenesis.
目前报道中,为获得高的正突变率,建立了利用多孔板培养的高通量筛选方法[16],实现快速高效筛选。本研究中出发菌株B. amyloliquefaciensFMME088及诱变获得的突变株发酵生产 3-羟基丁酮均为高好氧发酵,孔板培养不利于菌体的生长及生产,因此,我们通过优化诱变条件,以期提高正突变率,并确定了最适APTR处理时间为120 s和150 s,在此基础上进行后续诱变。
2.2 60Co γ射线诱变强化3-羟基丁酮产量
首先,对60Co γ射线诱变的辐照剂量进行优化,得到最适辐照剂量为0.8 kGy。在此基础上,以A-21为出发菌株进行60Co γ射线诱变,根据3-羟基丁酮产量,对筛选平板上长出的250株60Co γ射线突变株进行二轮筛选,获得136株突变株,其中 62株的 3-羟基丁酮产量高于出发菌株(图2A),正突变率为 24.8%。将全部正突变株进行二轮复筛,其中23株正突变株的3-羟基丁酮产量较高 (图 2B)。其中,突变株 H-5的 3-羟基丁酮产量提高最显著,摇瓶水平达到 68.2 g/L,比B. amyloliquefaciensFMME088提高30.4%。
由上述两种诱变方法计算获得的正突变率可以表明,诱变条件的优化能够实现对正突变率的提高。摇瓶水平的发酵法虽然能够用于高产3-羟基丁酮B. amyloliquefaciens的筛选,但工作量大,效率较低,若进一步改善筛选效率及正突变率仍需建立高效的筛选方法。
2.3 突变株B. amyloliquefaciens H-5遗传稳定性分析
将复筛获得的突变株B. amyloliquefaciensH-5进行传代发酵验证,并分析其遗传稳定性(表3)。以摇瓶水平发酵获得3-羟基丁酮的产量为检验指标,由表 3可知经复合诱变筛选获得的B. amyloliquefaciensH-5的3-羟基丁酮产量不仅优于出发菌株且产量变化幅度小。该结果表明,突变株B. amyloliquefaciensH-5具有良好的遗传稳定性。

表2 正突变株的首轮筛选结果Table 2 Preliminary screening results of positive mutant strains

表3 H-5突变株的遗传稳定性Table 3 Stability of mutant H-5

图2 复合诱变二轮初筛 (A) 及复筛 (B) 结果(虚线代表出发菌株的3-羟基丁酮产量,星号代表3-羟基丁酮产量最优突变株)Fig. 2 Preliminary (A) and secondary screening (B) results of second round for mutants with compound mutagenesis.The dashed line represents the acetoin production of the original strain, the asterisk represents the optimal mutant for acetoin yield.
2.4 突变株B. amyloliquefaciens H-5发酵条件优化
为进一步提高 3-羟基丁酮的产量和改善发酵过程中细胞的生长,首先在5 L发酵罐上探究了发酵过程中葡萄糖流加浓度对乙偶姻生产的影响。如图3A所示,发酵24 h时流加20 g/L和30 g/L葡萄糖,3-羟基丁酮产量分别为 70.71 g/L和 76.6 g/L(表 4),较未流加葡萄糖时分别提高了 4.72%和13.45%。但是,产率及生产强度并没有得到提升,可能原因在于当流加葡萄糖时,细胞生长已经进入稳定期,此时细胞糖耗速率相对减小,导致发酵周期延长。当葡萄糖流加浓度增大到40 g/L时,3-羟基丁酮产量下降,与未流加葡萄糖时无显著差异,可能是由于发酵体系中葡萄糖的浓度过高,对菌体造成渗透压胁迫[13]。因此,选择30 g/L为葡萄糖最适流加浓度,后续优化以此为基础进行。
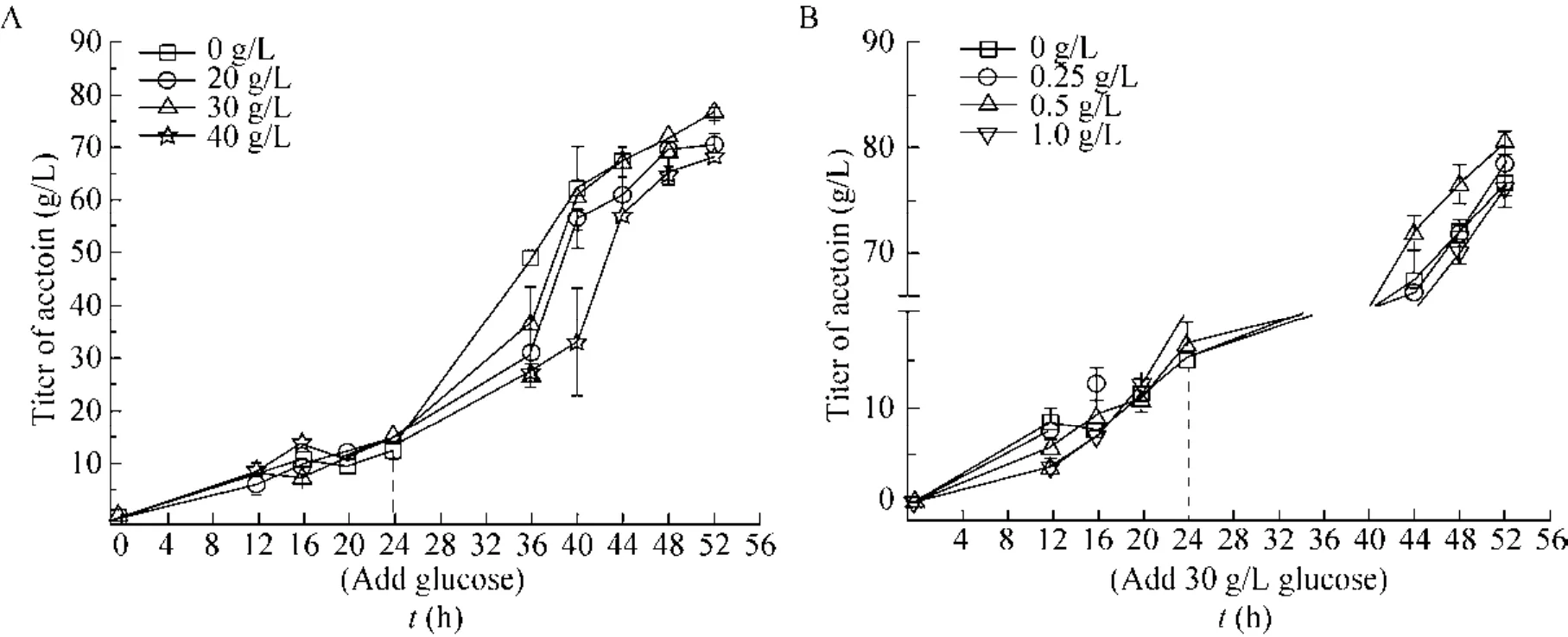
图3 葡萄糖的流加浓度 (A) 及乙酸钠添加量 (B) 对3-羟基丁酮产量的影响 (虚线代表流加葡萄糖的时间节点)Fig. 3 Effects of different glucose additive amount (A) and sodium acetate concentrations (B) on the titer of acetoin.The dashed line represents the time node where glucose is added.
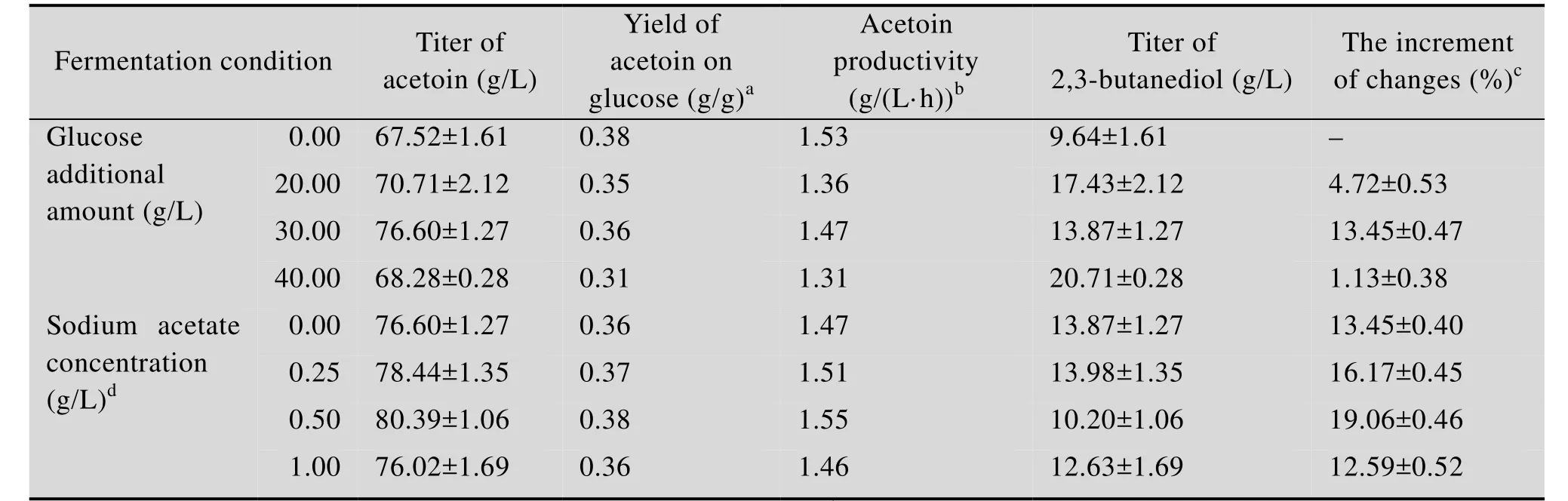
表4 葡萄糖流加浓度及乙酸钠添加量对突变株发酵的影响Table 4 Comparisons of acetoin production from different glucose additive amount and sodium acetate concentrations
较低浓度的乙酸在低 pH条件下能够诱导调控子 AlsR的表达[17],从而正向调控 3-羟基丁酮合成路径中两个关键酶——α-乙酰乳酸合酶(ALS) 和乙酰乳酸脱氢酶 (ALDC) 的表达,以促进 3-羟基丁酮的合成[18]。因此,在发酵过程中流加30 g/L葡萄糖的基础上,考察了添加乙酸钠对突变株B. amyloliquefaciensH-5发酵生产3-羟基丁酮的影响。如图3B所示,乙酸钠的添加对3-羟基丁酮发酵影响较小,当添加0.25 g/L和0.5 g/L乙酸钠时,3-羟基丁酮产量提高至78.44 g/L和80.39 g/L,较未添加乙酸钠时仅仅提高了2.40%和4.95%。另外,当添加0.5 g/L乙酸钠时,副产物2,3-丁二醇的生成量相对减少,而当添加量增加到1.0 g/L时,3-羟基丁酮产量与未添加乙酸钠时产量无明显差异。因此,选择0.5 g/L为乙酸钠最适添加量。
经上述培养条件优化,突变株B. amyloliquefaciensH-5在5 L发酵罐上发酵52 h时3-羟基丁酮产量为80.39 g/L,较优化之前产量提高了19.06%。
2.5 突变株B. amyloliquefaciens H-5 30 L发酵罐扩大培养
采用上述优化后的培养条件对突变株B.amyloliquefaciensH-5进行30 L发酵罐的扩大培养。如图4所示,B. amyloliquefaciensH-5在30 L发酵罐发酵0–12 h时,菌体生长迅速,溶氧急剧下降至1.6%;发酵12–24 h时,细胞生长进入稳定期,2,3-丁二醇大量产生,并在流加30 g/L葡萄糖后继续缓慢积累;发酵36 h时,葡萄糖基本耗尽,此时提高搅拌速度,使 2,3-丁二醇转化为3-羟基丁酮;发酵52 h时,3-羟基丁酮的最大产量为85.24 g/L。由表5可知,在30 L发酵罐上,3-羟基丁酮的产率及生产强度较5 L发酵罐上分别提高了7.89%和5.81%。另外,在30 L发酵罐上单位细胞的 3-羟基丁酮产量比 5 L发酵罐上提高了 6.03%,可能是由于发酵后期主要通过2,3-丁二醇脱氢酶催化 2,3-丁二醇转化为 3-羟基丁酮。因此,当菌体量较低时,间接使得发酵过程中 2,3-丁二醇积累量增加,但是后期转化并不彻底,从而降低了3-羟基丁酮的产量。

图4 突变株B. amyloliquefaciens H-5发酵生产3-羟基丁酮过程曲线Fig. 4 Time course of acetoin fermentation by the mutant B. amyloliquefaciens H-5.

表5 突变株B. amyloliquefaciens H-5发酵生产3-羟基丁酮过程参数Table 5 Parameters of acetoin fermentation by the mutant B. amyloliquefaciens H-5
3 结论
本研究以B. amyloliquefaciensFMME088为出发菌株,通过ARTP和60Co γ射线复合诱变,筛选获得一株高产 3-羟基丁酮的解淀粉芽孢杆菌,并命名为B. amyloliquefaciensH-5。最终,在30 L发酵罐上进行放大培养,3-羟基丁酮产量达到85.24 g/L,是目前以微生物发酵法生产3-羟基丁酮的最高产量。
[1]Zhang B, Li XL, Fu J, et al. Production of acetoin through simultaneous utilization of glucose, xylose,and arabinose by engineeredBacillus Subtilis. PLoS ONE, 2016, 11(7): e0159298.
[2]Zhang X, Zhang RZ, Bao T, et al. The rebalanced pathway significantly enhances acetoin production by disruption of acetoin reductase gene and moderate-expression of a new water-forming NADH oxidase inBacillus subtilis. Metab Eng, 2014, 23: 34–41.
[3]Xiao ZJ, Lu JR. Strategies for enhancing fermentative production of acetoin: a review. Biotechnol Adv,2014, 32(2): 492–503.
[4]Yang TW, Rao ZM, Zhang X, et al. Metabolic engineering strategies for acetoin and 2, 3-butanediol production: advances and prospects. Crit Rev Biotechnol, 2017, 37(8): 990–1005.
[5]Zhang LY, Chen S, Xie HB, et al. Efficient acetoin production by optimization of medium components and oxygen supply control using a newly isolatedPaenibacillus polymyxaCS107. J Chem Technol Biotechnol, 2012, 87(11): 1551–1557.
[6]Sun JA, Zhang LY, Rao B, et al. Enhanced acetoin production bySerratia marcescensH32 with expression of a water-forming NADH oxidase.Bioresour Technol, 2012, 119: 94–98.
[7]Li L, Wei XT, Yu WP, et al. Enhancement of acetoin production fromBacillus licheniformisby 2, 3-butanediol conversion strategy: metabolic engineering and fermentation control. Process Biochem, 2017, 57: 35–42.
[8]Liu XF, Fu J, Huo GX, et al. Latest advances of microbial production of platform chemical acetoin.Chin Biotechnol, 2015, 35(10): 91–99 (in Chinese).刘晓霏, 付晶, 霍广鑫, 等. 生物法制备平台化合物乙偶姻的最新研究进展. 中国生物工程杂志,2015, 35(10): 91–99.
[9]Jia XJ, Liu Y, Han YJ. A thermophilic cell-free cascade enzymatic reaction for acetoin synthesis from pyruvate. Sci Rep, 2017, 7(1): 4333.
[10]Wang LY, Huang ZL, Li G, et al. Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma. J Appl Microbiol, 2010, 108(3): 851–858.
[11]Zhang X, Zhang XF, Li HP, et al. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool. Appl Microbiol Biotechnol, 2014,98(12): 5387–5396.
[12]Kurowska M, Labocha-Pawlowska A, Gnizda D, et al. Molecular analysis of point mutations in a barley genome exposed to MNU and gamma rays. Mutat Res, 2012, 738–739: 52–70.
[13]Luo QL, Wu J, Wu MC. Enhanced acetoin production byBacillus amyloli quefaciensthrough improved acetoin tolerance. Process Biochem, 2014, 49(8):1223–1230.
[14]Li HP, Li G, Sun WT, et al. Radio-frequency,atmospheric-pressure glow discharges: producing methods, characteristics and applications in bio-medical fields. AIP Conf Proc, 2008, 982:584–591.
[15]Jin LH, Fang MY, Zhang C, et al. Operating conditions for the rapid mutation of the oleaginous yeast by atmospheric and room temperature plasmas and the characteristics of the mutants. Chin J Biotech,2011, 27(3): 461–467 (in Chinese).金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性. 生物工程学报, 2011, 27(3): 461–467.
[16]Guo T, Tang Y, Zhang QY, et al.Clostridium beijerinckiimutant with high inhibitor tolerance obtained by low-energy ion implantation. J Ind Microbiol Biotechnol, 2012, 39(3): 401–407.
[17]Moons P, Van Houdt R, Vivijs B, et al. Integrated regulation of acetoin fermentation by quorum sensing and pH inSerratia plymuthicaRVH1. Appl Environ Microbiol, 2011, 77(10): 3422–3427.
[18]Liu D, Chen Y, Ding FY, et al. Simultaneous production of butanol and acetoin by metabolically engineeredClostridium acetobutylicum. Metab Eng,2015, 27: 107–114.
