高产吡咯喹啉醌扭脱甲基杆菌的高通量选育
2018-06-11李红月曾伟主周景文
李红月,曾伟主,周景文
1 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
2 江南大学 生物工程学院,江苏 无锡 214122
吡咯喹啉醌 (Pyrroloquinoline quinone, PQQ)是许多细菌中脱氢酶 (包括甲醇脱氢酶、葡萄糖脱氢酶和甘油脱氢酶等) 的辅酶[1-2]。研究发现能合成PQQ的菌株中绝大部分是革兰氏阴性菌[3],如肺炎克雷伯氏菌Klebsiella pneumonie、扭脱甲基杆菌Methylobacterium extorquens[4]、氧化葡糖杆菌Gluconobacter oxydans[5]、甲基营养菌Methylotrophic bacteria[6]等。甲醇脱氢酶中的PQQ接受来自甲醇的自由电子转变为PQQH2,之后再将电子传递至细胞色素c,此时PQQH2又被氧化成 PQQ[7-8]。PQQ具有提高细菌对毒性和辐射等极端条件耐受性[9-10]、防护肝损伤、促进机体生长[11-14]、调节机体自由基水平[15-16]、促进神经生长因子合成[17]等重要的生理功能。目前PQQ生产以化学法为主,由于化学法合成步骤复杂、提纯步骤多,导致成本较高。发酵法由于培养基成分简单、利于产物提取、反应温和、能降低成本等优点,因此有很大的产业化前景。目前为止,PQQ整个生物合成途径及其调控机制仍未完全阐明。研究发现,在M. extorquensAM1中PQQ的合成需要pqqA–G 7个基因[18]。敲除pqqA基因导致PQQ的合成量大幅度降低但依然有合成[19]。Postma等将K. pneumonia的PQQ基因簇与高拷贝载体pUC19构建质粒,转化大肠杆菌Escherichia coli后只能产微量的PQQ[20]。王朝绚等将PQQ合成基因和信号肽基因pelB在大肠杆菌Escherichia coliBL21(DE3) 中融合表达,PQQ的产量与不加信号肽的对照菌相比提高了24%[21]。
高通量筛选可通过单细胞研究快速获得有关克隆相关性、克隆内差异和延续突变的信息[22]。此前,获得状态良好的单细胞比较困难,而流式细胞仪的发展和应用能解决这一问题[23-24]。流式细胞术 (Flow cytometry,FCM) 可以从细胞群中高速分选出被指定的细胞并将其分选至试管或细胞培养板中,分选时间短,分选到的细胞活性良好,方便后续实验[25-26]。MoFlo XDP分选型流式细胞仪是目前高端流式细胞仪之一,具有高度一体化的电子系统、高速的电子系统计算速度及上样分选速度、自动调节和优化液滴成像、自动调节分选参数维持分选、完全程序化控制的上样系统、高度智能的分选模式。本文采用常压室温等离子体诱变 (Atmospheric and room temperature plasma,简称ARTP) 以及流式细胞术分选单细胞的高通量筛选方法获得高产PQQ的M. extorquens菌株,并通过传代检测突变菌株遗传稳定性。目前,将流式细胞术与高通量筛选结合来提高PQQ产量的方法还没有相关报道。
1 材料与方法
1.1 材料
1.1.1 菌种
M. extorquensI-F2由本研究室诱变筛选得到。
1.1.2 培养基
固体培养基:酵母抽提物4.5 g/L,蛋白胨5 g/L,玉米浆干粉 0.75 g/L,CoCl2·6H2O 5 mg/L,MgSO4·7H2O 0.1 g/L , CaCl2·2H2O 10 mg/L ,FeSO4·7H2O 10 mg/L,MnSO4·7H2O 0.5 mg/L,Na2MoO4·2H2O 0.5 mg/L,固体培养基添加2%琼脂粉,pH调至7.0,121 ℃灭菌15 min。
筛选培养基:甲醇30 mL/L,硫酸铵3 g/L,KH2PO41.0 g/L,K2HPO42.12 g/L,MgSO4·7H2O 0.1 g/L , CaCl2·2H2O 10 mg/L , FeSO4·7H2O 10 mg/L,MnSO4·7H2O 0.5 mg/L,Na2MoO4·2H2O 0.5 mg/L,pH调至7.0,121 ℃灭菌15 min。
1.1.3 主要试剂和仪器
酵母抽提物和蛋白胨,购自 Oxoid公司;PQQ,购自Sigma-Aldrich公司;其余化学试剂,购自国药集团化学试剂有限公司。常压室温等离子体诱变育种仪,购自无锡思清源生物科技有限公司;FE20K pH计,购自瑞士Mettler-Toledo公司;FREEDOM EVO移液工作站,购自瑞士Tecan公司;MoFlo XDP流式细胞仪,购自美国Beckman公司;Cytation3酶标仪,购自美国BioTek公司;Eppendorf 5424高速离心机,购自美国Eppendorf公司。
1.1.4 摇瓶培养条件
种子液的制备:将保藏于–80 ℃条件下的甘油管中的菌液接种在固体培养基平板上,30 ℃恒温培养箱中培养4 d使其活化后,从平板上刮取单菌落接种于含有25 mL筛选培养基的250 mL锥形瓶中,在30 ℃、220 r/min条件下培养72 h,即为种子液。
1.2 方法
1.2.1 制备荧光标记样品
本研究采用碘化丙啶 (Propidiumiodide,简称PI) 作为样品的荧光标记染料。确定 PI浓度:将0.5 mL已制备好的菌悬液分别与0.5 mL 10、20、50 μg/mL的PI混合,避光4 ℃染色10 min,过滤转移至试管中,上机检测。确定染色的温度:将0.5 mL已制备好的菌悬液与0.5 mL PI (20 μg/mL)混合,分别避光在4 ℃、室温、30 ℃下染色10 min,过滤转移至试管中,上机检测。确定染色时间:将0.5 mL已制备好的菌悬液与0.5 mL PI (20 μg/mL)混合,分别避光4 ℃静置10 min、30 min、2 h染色,过滤转移至试管中,上机检测。
1.2.2 ARTP诱变
本研究采用常压室温等离子体诱变对M. extorquensI-F2进行处理,将菌株进行活化并制备得到种子液 (OD600约为3)。取1 mL菌悬液于1.5 mL EP管中,8 000 r/min 离心3 min,弃去上清液。用PBS溶液洗涤2次后,稀释制成菌体浓度在106–107之间的菌悬液,取10 μL菌悬液均匀涂布于无菌的载片表面。然后将载片置于ARTP诱变育种系统的载台上,在入射功率为100 W、氦气流量为10 SLM条件下,分别照射15、30、45、60、75、90、105、120 s。样品处理完毕,用镊子将载片转移到装有1 mL 5%甘油的EP管中,持续充分振荡1 min,将附着在载片上的菌体充分洗脱形成菌悬液,对照组为同样的条件照射0 s后,将载片转移至装有1 mL 5%甘油的EP管中,持续充分振荡1 min制备成菌悬液。
1.2.3 流式细胞仪分选
首先进行光路调节,先粗调液流,再精确校准,优化所有信号,自动优化断点并确定液滴延迟,调节分选参数。对M. extorquens细胞进行染色,PI不能穿透完整细胞膜,但能穿透凋亡晚期细胞和死细胞的破损细胞膜,嵌入双链 DNA后使细胞核染色产生荧光,通过流式细胞仪可以分析计数死细胞或活细胞占所有细胞的比例,分选活细胞至96孔板中,其中致死率方程:
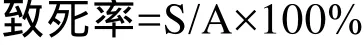
S是 ARTP处理后流式细胞检测出的有荧光细胞数即死细胞数,A是流式细胞检测出的所有细胞数。
1.2.4 高通量筛选
将活细胞分选于含有100 μL固体培养基的96孔深孔板中,30 ℃条件下培养 4 d后,加入800 μL液体筛选培养基在30 ℃、900 r/min条件下培养3 d,以10%的接种量转接于含有2 mL液体筛选培养基的48孔深孔板中,在30 ℃、900 r/min条件下培养 5 d,4 000 r/min 离心 15 min,取 200 μL上清液至96孔浅孔板中,用酶标仪检测249 nm处的吸光值,PQQ含量越高吸光值越高,复筛验证,将筛选到的菌株再次进行ARTP诱变,分选于多孔板中初筛、复筛验证,连续多次传代检测突变菌株的遗传稳定性。
1.2.5 PQQ含量检测
光谱法检测PQQ含量是将样品转移至96孔浅孔板中用酶标仪检测OD326与OD400的差值,同时将筛选培养基以同样的条件处理和检测,从而扣除培养基吸光值[27]。计算结果取3个平行发酵实验的平均值。
2 结果与分析
2.1 样品染色条件的优化
流式细胞术是通过激光激发高速流动的细胞或微粒所携带的荧光染料或荧光素,并检测由此产生的微粒的各种光信号,如散射光、自发荧光、特异性荧光的强弱,来反映各项待检测指标[28]。染色分选后,30 ℃培养5 d至能清晰看见孔内的单菌落,生长状态良好,计数每块孔板中分选的单细胞克隆形成个数即克隆形成率。对染色条件进行优化,结果如表1所示。随着PI浓度增大,克隆形成率降低,可能由于PI本身具有猝灭作用的缔合分子或产生内滤光效应,说明合适的染料浓度才能保证染色做到染料分子数与被染的某种参量成一定的量效关系。短时存放 (10 min、30 min) 的克隆形成率高于长时存放 (2 h),说明样品染色后应尽快上机检测。染色时温度对克隆形成率有影响,温度升高可造成溶液粘滞性增加,溶剂和 PI分子动力加大,使荧光猝灭可能性加大,荧光量减弱,所以应保持较低温度。流式细胞术检测样品时染色相对较好的条件是 PI浓度为10 μg/mL、避光在室温条件下放置30 min。
2.2 流式细胞仪分选参数调校
样品制备后,MoFlo XDP流式细胞仪检测,PI染色,在488 nm激发光、620 nm发射光条件下进行优化,获得最佳调校值参数为:液流在光路中央且聚焦清楚,液流打入废液收集管正中央,光斑位于孔中央且最亮,液流分叉稳定,喷嘴型号为100 μm,鞘液压力为30.00 psi,Drop Delay值为40.00,分选模式为Purify mode。在此条件下,目的细胞群如R6区域所示 (图1A)。对于未进行热处理的样品,PI无法对细菌染色,细菌的荧光信号全部处于阴性区间,结果如图1B所示;而经过热处理 (100 ℃沸水浴 10 min) 的样品,PI能穿过破损的细胞膜染色DNA,细菌的荧光信号均显示为阳性,结果如图 1C所示。参数调校以单细胞得率高、损伤少为目的,要避免出现鞘液压力太大、不合适的鞘液或培养基、分选时间太长以及高电压等情况[29]。
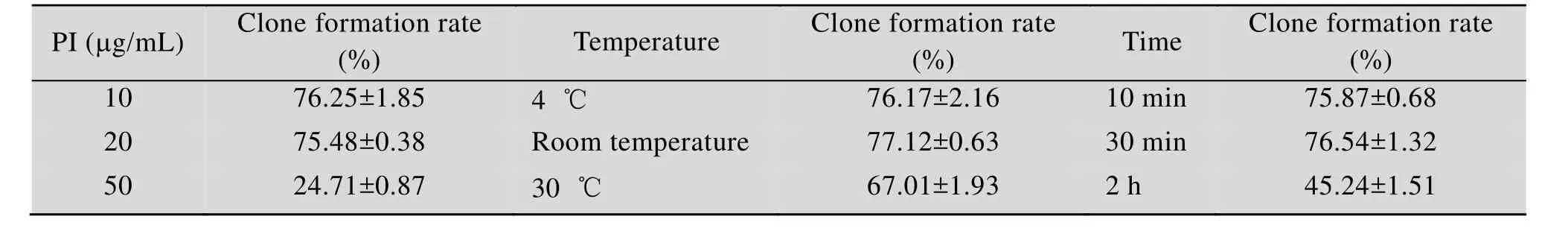
表1 样品染色条件优化Table 1 Optimization of sample dyeing conditions
2.3 ARTP诱变致死率曲线
ARTP诱变通过控制等离子体强度破坏其DNA结构,进而改变其生物特性,较高的致死率能获得有效的突变率,研究表明致死率90%以上效果较佳[30]。ARTP处理30 s后,I-F2菌体致死率达到 93%以上,但随后 45 s后的处理时间出现致死率下降的现象,在 45–90 s这段处理时间内虽然致死率呈上升趋势,但均低于90%,直到处理时间为105 s时致死率达到95% (图2)。ARTP诱变对微生物细胞和 DNA具有显著的影响,细胞暴露在大量高活性等离子体下会导致细胞普遍死亡,但同时过程中会有少量细胞通过自我修复形成新的突变存活下来,分析出现致死率曲线折点的原因可能是菌株自身存在的修复机制产生回复突变,使存活的菌株增加,所以本研究将诱变时间选在100–110 s。
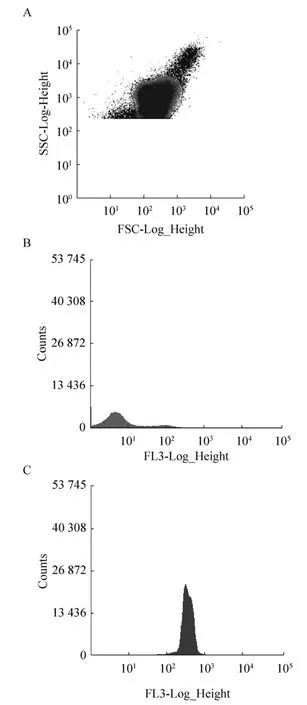
图1 流式分选 (A:目标细胞群;B:阴性;C:阳性)Fig. 1 Flow sorting. (A) Target cell population. (B)Negative. (C) Positive.
2.4 高通量检测方法
目前,PQQ检测方法包括高效液相色谱法、重组酶法及非酶法 (氧化还原法)。高效液相色谱法检测精准性高、范围广,但并不适用于高通量筛选检测。重组酶法和非酶法都适于大量样品的检测,但重组酶法中的DCIP (2,6-二氯靛酚钠) 和PMS (吩嗪硫酸甲脂) 配成检测溶液后会产生颜色变化影响吸光值的检测,非酶法中的NBT (四唑硝基蓝) 是一种极易被氧化的物质,暴露在空气中很短时间内即可被氧化,影响吸光值的测定,所以重组酶法和非酶法这两种检测方法存在准确度不高和重复性较差的问题。PQQ分别在250 nm和330 nm左右有特征吸收峰,光谱扫描结果见图3A。本研究采用光谱法检测PQQ,用酶标仪检测OD249值,如图3B所示,PQQ浓度与OD249关系为y=32.34x–7.99 (R2=0.997)。
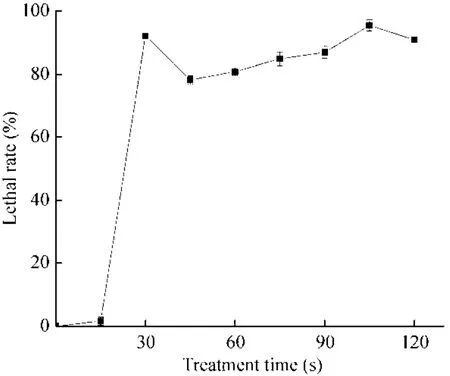
图2 致死率曲线Fig. 2 The lethality curve.

图3 高通量筛选方法建立Fig. 3 High-throughput screening method.
2.5 高通量筛选
流式分选和移液工作站应用于高通量筛选策略可实现高效率的大批量转移,具有准确、快速、灵敏、高通量和多参数同时分析等优点。本研究通过ARTP诱变处理菌株后将筛选到的菌株再次进行ARTP诱变处理共4次,用PI染色后结合流式细胞仪分选出9 677株活细胞,最后采用建立的高通量检测方法检测9 677株诱变菌株PQQ产量。结果如图4A所示,294株菌株的OD249比出发菌株高。对这294株菌摇瓶发酵来进行复筛,以 10%接种量转接至含有 20 mL筛选培养基的250 mL锥形瓶中,30 ℃、220 r/min条件下培养180 h后检测PQQ产量。如图4B所示,复筛中有7株PQQ产量提升较高的菌株,分别是3-B9、2-B3、3-H8、3-A9、1-C6、2-D3、8-D9,它们的PQQ产量较出发菌株提高了 80.09%、85.2%、73.3%、74.9%、98.02%、90.11%、94.19%。对这7株菌进行传代培养6代,检测PQQ产量,如表2所示,其中6株菌株2-B3、3-H8、3-A9、1-C6、2-D3、8-D9基本保持稳定,而菌株3-B9则明显降低。
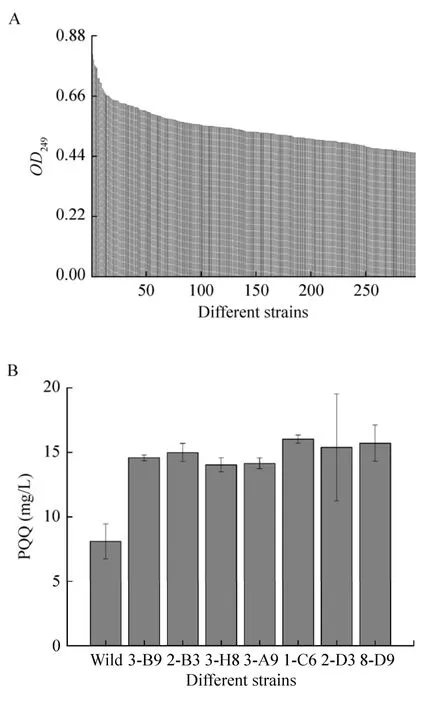
图4 高通量筛选结果 (A:初筛;B:复筛)Fig. 4 High-throughput screening results. (A) Primary screening. (B) Secondary screening.
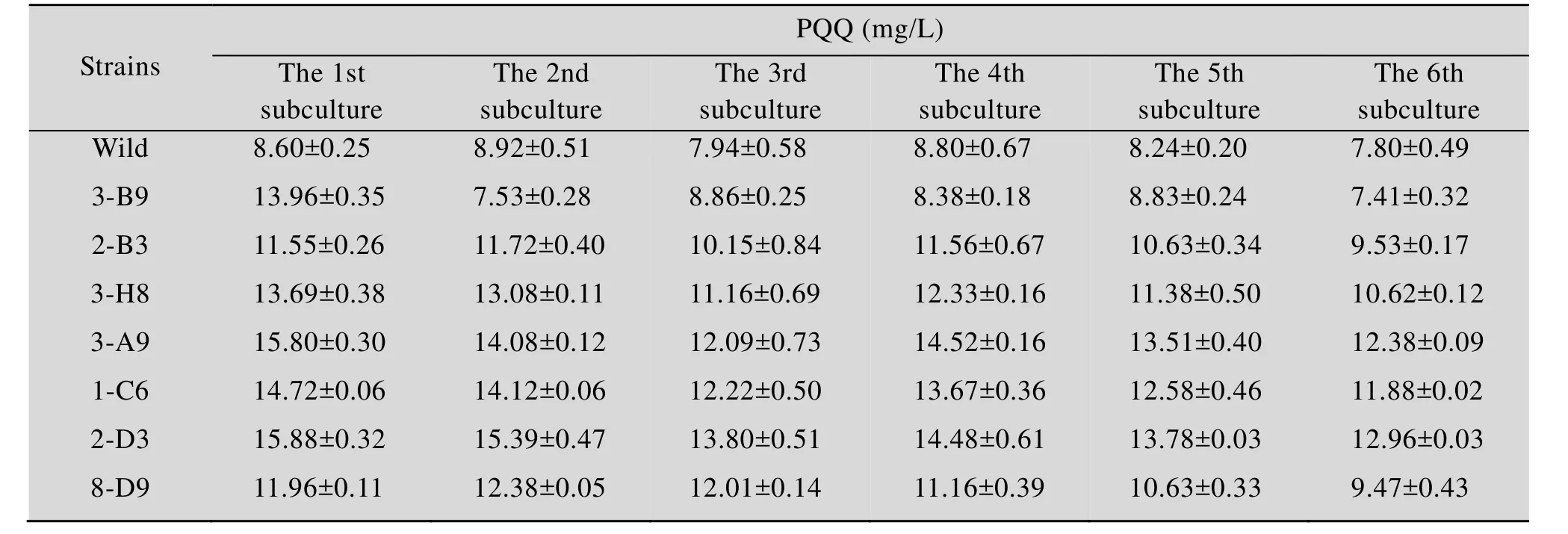
表2 突变菌株遗传稳定性Table 2 The genetic stability of mutant strains
3 讨论
本研究从9 677株菌中复筛到6株PQQ产量提高的菌株 2-B3、3-H8、3-A9、1-C6、2-D3、8-D9,PQQ产量分别较出发菌株提高了85.2%、73.3%、74.9%、98.02%、90.11%、94.19%,其中1-C6突变株 PQQ产量最高为 16.02 mg/L。目前野生菌PQQ 产量最多为2 mg/L或更低[31],Urakami等筛选到一株生丝微菌 TK0441 (Hyphomicrobiumsp.TK0441),摇瓶水平PQQ产量为0.3–0.9 mg/L[32]。尹芳等对生丝微菌TH205进行培养,10 L罐上发酵后PQQ产量为26.6 μg/mL[33]。为提高产量,诱变是比较常用的育种方法。钟杉杉等对假单胞菌PS0813 (Pseudomonassp. 0813) 进行多种诱变,获得PM1、PM2两株高产菌,产量与对照相比提高1.63倍和1.56倍[34]。王朝绚等对K.pneumonia进行紫外线和氯化锂诱变,得到 U2、L1两株高产菌,产量与对照相比提高6倍和5倍[35]。韩月梅等对甲基营养菌MP688进行转座诱变,筛选到几乎不产PQQ的突变株,并对其进行了突变基因鉴定[36]。通过对诱变获得的PQQ缺陷型菌株进行分析,为从基因水平阐释PQQ生物合成过程提供了重要线索。由于目前PQQ生产菌株的筛选大多使用平板筛菌,人工挑选存在效率低、耗时长等问题。
本文提供了一种新的高通量筛选 PQQ高产菌株的研究方法,流式细胞术结合高通量筛选的方法能更加简单、快速地获得高产突变菌株。相比于基因工程改造和传统筛选方法,具有提升效果明显、自动化、灵敏快速检测等优势,流式细胞仪、全自动移液工作站等的应用为高通量筛选开拓了新道路。
[1]Duine JA, Jzn JF, van Zeeland JK. Glucose dehydrogenase fromAcinetobacter calcoaceticus: A‘quinoprotein’. Febs Lett, 1979, 108(2): 443–446.
[2]Salisbury SA, Forrest HS, Cruse WBT, et al. A novel coenzyme from bacterial primary alcohol dehydrogenases. Nature, 1979, 280(5725): 843–844.
[3]Misra HS, Rajpurohit YS, Khairnar NP.Pyrroloquinoline-quinone and its versatile roles in biological processes. Biosci, 2012, 37(2): 313–325.
[4]Li HZ, Kang Z, Li JH, et al. Mutagenesis ofMethylobacterium extorquensAM1 for increasing pyrroloquinoline quinone production by atmospheric and room temperature plasma. Chin J Biotech, 2016,32(8): 1145–1149 (in Chinese).李慧芝, 康振, 李江华, 等. 常压室温等离子体诱变扭脱甲基杆菌 AM1高产吡咯喹啉醌. 生物工程学报,2016, 32(8): 1145–1149.
[5]Hölscher T, Görisch H. Knockout and overexpression of pyrroloquinoline quinone biosynthetic genes inGluconobacter oxydans621H. J Bacteriol, 2006,188(21): 7668–7676.
[6]Wang WX, Ge X, Han YM, et al. Isolation and characterization of glucose dehydrogenase gene inMethylovorussp. MP688. Lett Biotechnol, 2013, 24(6):805–809 (in Chinese).王文溪, 葛欣, 韩月梅, 等. 甲基营养菌 MP688葡萄糖脱氢酶基因分离鉴定及性质研究. 生物技术通讯,2013, 24(6): 805–809.
[7]Brazeau BJ, Johnson BJ, Wilmot CM.Copper-containing amine oxidases. Biogenesis and catalysis; a structural perspective. Arch Biochem Biophys, 2004, 428(1): 22–31.
[8]Davidson VL. Electron transfer in quinoproteins. Arch Biochem Biophys, 2004, 428(1): 32–40.
[9]Johnson HA, Tebo BM.In vitrostudies indicate a quinone is involved in bacterial Mn(II) oxidation. Arch Microbiol, 2008, 189(1): 59–69.
[10]Trček J, Jernejc K, Matsushita K. The highly tolerant acetic acid bacteriumGluconacetobacter europaeusadapts to the presence of acetic acid by changes in lipid composition, morphological properties and PQQ-dependent ADH expression. Extremophiles, 2007,11(4): 627–635.
[11]Kim J, Kobayashi M, Fukuda M, et al. Pyrroloquinoline quinone inhibits the fibrillation of amyloid proteins.Prion, 2010, 4(1): 26–31.
[12]Kobayashi M, Kim J, Kobayashi N, et al.Pyrroloquinoline quinone (PQQ) prevents fibril formation of alpha-synuclein. Biochem Biophys Res Commun, 2006, 349(3): 1139–1144.
[13]Scanlon JM, Aizenman E, Reynolds IJ. Effects of pyrroloquinoline quinone on glutamate-induced production of reactive oxygen species in neurons. Eur J Pharmacol, 1997, 326(1): 67–74.
[14]Sode K, Sano H. Glu742 substitution to Lys enhances the EDTA tolerance ofEscherichia coliPQQ glucose dehydrogenase. Biotechnol Lett, 1994, 16(5): 455–460.
[15]He K, Nukada H, Urakami T, et al. Antioxidant and pro-oxidant properties of pyrroloquinoline quinone(PQQ): implications for its function in biological systems. Biochem Pharmacol, 2003, 65(1): 67–74.
[16]Zhang Q, Ding M, Cao Z, et al. Pyrroloquinoline quinine protects rat brain cortex against acute glutamate-induced neurotoxicity. Neurochem Res, 2013,38(8): 1661–1671.
[17]Liu SQ, Li HH, Ouyang JP, et al. Enhanced rat sciatic nerve regeneration through silicon tubes filled with pyrroloquinoline quinone. Microsurgery, 2005, 25(4):329–337.
[18]Toyama H, Chistoserdova L, Lidstrom ME. Sequenceanalysisofpqqgenes required for biosynthesis of pyrroloquinoline quinone inMethylobacterium extorquensAM1 and the purification of a biosynthetic intermediate. Microbiology, 1997, 143(2): 595–602.
[19]Toyama H, Lidstrom ME.pqqAis not required for biosynthesis of pyrroloquinoline quinone inMethylobacterium extorquensAM1. Microbiology, 1998,144(1): 183–191.
[20]Meulenberg JJM, Sellink E, Loenen WAM, et al.Cloning ofKlebsiella pneumoniaepqq genes and PQQ biosynthesis inEscherichia coli. Fems Microbiol Lett,1990, 71(3): 337–343.
[21]Wang ZX, Ge XZ, Tian PF. Enhanced production of pyrroloquinoline quinone expressed fromEscherichia colivia adding signal peptide. J Beijing Univ Chem Technol: Nat Sci Ed, 2013, 40(S1): 32–35 (in Chinese).王朝绚, 葛喜珍, 田平芳. 大肠杆菌中插入表达信号肽提高吡咯喹啉醌产量的研究. 北京化工大学学报:自然科学版, 2013, 40(S1): 32–35.
[22]Rinke C, Lee J, Nath N, et al. Obtaining genomes from uncultivated environmental microorganisms using FACS-based single-cell genomics. Nat Prot, 2014, 9(5):1038–1048.
[23]Magbanua MJM, Park JW. Isolation of circulating tumor cells by immunomagnetic enrichment and fluorescence-activated cell sorting (IE/FACS) for molecular profiling. Methods, 2013, 64(2): 114–118.
[24]Haroon MF, Skennerton CT, Steen JA, et al. In-solution fluorescencein situhybridization and fluorescenceactivated cell sorting for single cell and population genome recovery. Methods Enzymol, 2013, 531: 3–19.
[25]Manome A, Zhang H, Tani Y, et al. Application of gel microdroplet and flow cytometry techniques to selective enrichment of non-growing bacterial cells. FEMS Microbiol Lett, 2001, 197(1): 29–33.
[26]Morono Y, Terada T, Kallmeyer J, et al. An improved cell separation technique for marine subsurface sediments: applications for high-throughput analysis using flow cytometry and cell sorting. Environ Microbiol, 2013, 15(10): 2841–2849.
[27]Yang YX, Xiong XH, You S, et al. Comparing three kinds of pyrroloquinoline quinone detection methods.Lett Biotechnol, 2011, 22(4): 544–547 (in Chinese).杨延新, 熊向华, 游松, 等. 3种检测吡咯喹啉醌的方法比较. 生物技术通讯, 2011, 22(4): 544–547.
[28]Yang R, Zou MQ. New advances in developing flow cytometery. J Instr Anal, 2004, 23(6): 124–128.杨蕊, 邹明强. 流式细胞术的最新进展. 分析测试学报, 2004, 23(6): 124–128 (in Chinese).
[29]Zuo LF, Liu HX, Lin YZ, et al. A method for preparing the suspended cell sample of mono-spreading for flow cytometry. J Hebei Med Univ, 1987, 8(3): 139–143.左连富, 刘洪祥, 林元珠, 等. 流式细胞术单分散细胞悬液样品的制备方法. 河北医学院学报, 1987, 8(3):139–143 (in Chinese).
[30]Schubert WW, Beaudet RA. Determination of lethality rate constants and D-values for heat-resistantBacillusspores ATCC 29669 exposed to dry heat from 125 ℃to 200 ℃. Astrobiology, 2011, 11(3): 213–223.
[31]Van Kleef MAG, Duine JA. Factors relevant in bacterial pyrroloquinoline quinone production. Appl Environ Microbiol, 1989, 55(5): 1209–1213.
[32]Urakami T, Yashima K, Kobayashi H, et al. Production of pyrroloquinoline quinone by using methanol-utilizing bacteria. Appl Environ Microbiol, 1992, 58(12): 3970–3976.
[33]Yin F, Lu B, Chen GH, et al. Study on the production of pyrroloquinoline quinone by using methanol-utilizing bacteria. J East China Univ Sci Technol, 2004, 30(2):227–229, 233 (in Chinese).尹芳, 陆兵, 陈国豪, 等. 甲醇利用型细菌发酵生产吡咯喹啉醌的培养条件. 华东理工大学学报, 2004,30(2): 227–229, 233.
[34]Zhong SS. Screening, mutant, fermentation and gene cloning of pyrroloquinoline quinone-producing strain[D].Beijing: Beijing University of Chemical Technology,2013 (in Chinese).钟杉杉. 吡咯喹啉醌高产菌的筛选、诱变、发酵及基因克隆[D]. 北京: 北京化工大学, 2013.
[35]Wang ZX, Li HY, Wang S, et al. Mutation breeding of high pyrroloquinoline quinine-producing strain by UV and LiCl. J Anhui Agricul Sci, 2013, 41(34):13103–13105, 13122 (in Chinese).王朝绚, 李会玉, 王爽, 等. 紫外线-氯化锂诱变选育吡咯喹啉醌高产菌. 安徽农业科学, 2013, 41(34):13103–13105, 13122.
[36]Han YM, Ge X, Wang H, et al. Screening of PQQ-deficient mutants by transposition mutagenesis.Lett Biotechnol, 2014, 25(5): 628–631 (in Chinese).韩月梅, 葛欣, 王鹤, 等. 通过转座诱变筛选甲基营养菌吡咯喹啉醌合成缺陷突变株. 生物技术通讯,2014, 25(5): 628–631.
