HPLC法检测蛇足石杉内生真菌胶胞炭疽发酵液中石杉碱甲和石杉碱乙的含量
2018-06-11胡莉琴康信聪沈鹏原陈田张家银刘东波
胡莉琴,康信聪,沈鹏原,陈田,张家银,刘东波,3,4
1 湖南农业大学 园艺园林学院,湖南 长沙 410128
2 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128
3 湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128
4 湖南省植物功能成分利用协同创新中心,湖南 长沙 410128
石杉碱甲 (Huperzine A,简称Hup A) 是一种我国自主研发的高效、低毒、可逆且高选择性抑制乙酰胆碱酯酶的石松类生物碱,常用于老年痴呆症、记忆障碍、重症肌无力的治疗[1-2]。在老年痴呆症的治疗中,与美国FDA批准的同类药物他克林、多奈哌齐、利斯的明及加兰他敏相比,Hup A的抗胆碱酯酶活性更高,作用持续时间更长,口服生物利用度更高,毒性作用更小[3-5]。石杉碱乙(HuperzineB,简称Hup B) 抑制活性为石杉碱甲的1/10,但Hup B具有更长的活性持续时间[6]。
显著的疗效与巨大的商业价值使得Hup A的价格节节攀升,纯度为98%的Hup A出口价格已从2012年的200万元/kg增至400多万元/kg。虽然Hup A、Hup B在植株内含量很低 (最高含量分别为0.090 0%、0.018 3%),但目前Hup A、Hup B仍主要从野生蛇足石杉 (Huperzia se rrateT.) 等石松类石杉科石杉属植物中直接提取。蛇足石杉生长条件苛刻、生长周期长[7-8],过度开采导致该物种濒临灭绝,组织培养尚未成功;Hup A人工全合成步骤繁琐、价格昂贵,无法获得纯光学活性合成物质,Hup A至今未能实现产业化[9],无法满足市场用药需求,制约了Hup A、Hup B的临床发展。
自Stierle等首次从短叶红豆杉Taxus brevifoliaN.的树皮中分离到一种产紫杉醇的内生真菌——安德紫杉菌Taxomyces andreanae[10]以来,内生真菌合成与宿主植物相同或相似的次生代谢产物受到了极大的关注,为解决资源短缺、产量极低的药物开发提供了新的思路。迄今,有关蛇足石杉内生真菌的研究已有不少报道,2005年石玮等[11]从采自安徽青阳的H.se rrata中分离出4株内生真菌,分别属于顶孢霉属、单轴霉属、酵母和青霉属;韩文霞等[12-13]从浙江衢州乌巨山的H.serrate中分离出产Hup A的青霉菌与镰孢菌。本实验室从福建南平H.serrate中分离出具有合成Hup A、Hup B能力的内生真菌胶胞炭疽tanju (Colletotrichum gloeosporioidesP. tanju)。目前,Hup A、HupB的HPLC方法学考察主要集中于石杉科植物H.serrate[6,14],对内生真菌发酵液中的Hup A、HupB HPLC检测方法的考察未见报道。本文建立了内生真菌tanju发酵液中Hup A、Hup B的HPLC测定方法,并以此方法检测了 tanju菌发酵过程中次生代谢产物Hup A、Hup B的积累过程。Hup A、Hup B HPLC快速检测方法的建立为后期内生真菌胶胞炭疽合成Hup A、Hup B的机制研究奠定基础,从而有利于药物新资源的开发。
1 材料与方法
1.1 材料与仪器
蛇足石杉 (采自福建南平);内生真菌胶胞炭疽 (本实验室分离);Hup A 标准品 (Aladdin);Hup B标准品 (上海源叶生物科技有限公司);甲醇为色谱纯,醋酸铵、氯仿均为分析纯 (国药集团化学试剂有限公司);Mettler Toledo pH计 (上海梅特勒-托利多仪器有限公司)。
主要仪器和设备:Agilent-1260 Infinity高效液相色谱;Mettler Toledo XS205型电子分析天平(上海梅特勒-托利多仪器有限公司);旋转蒸发仪(上海雅荣生化仪器设备有限公司)。
1.2 方法
1.2.1 培养基的配制
马铃薯葡萄糖肉汤 (Potato dextrose broth,PDB) 培养基:去皮马铃薯200 g,葡萄糖20 g,加蒸馏水定容至1 L。
PDB加富培养基:去皮马铃薯200 g,葡萄糖20 g,酵母粉2 g,蛋白胨2 g,KH2PO41.5 g,MgSO40.5 g,NaCl 0.3 g,加蒸馏水定容至1 L后调节pH至6.5。
1.2.2 诱导子的制备
将新鲜的蛇足石杉去除根部,用自来水冲去泥土、腐叶,用超纯水洗净,吹干水分称重,然后切碎。加入少许水将叶片打成浆汁,用8层纱布过滤,最后用超纯水按1∶10的质量体积比定容至一定体积,分装121 ℃高压蒸汽灭菌30 min,–20 ℃冰箱冻存备用。
1.2.3 内生真菌tanju发酵培养和发酵液中Hup A、Hup B提取
内生真菌炭疽 tanju置 PDB培养基中活化3 d,取1 mL菌丝于PDB加富培养基中培养5 d使菌丝量达到最高,加入诱导子5 mL后继续培养 (空白对照:PDB+5 mL诱导子)。加入诱导子培养至一定时间后采用真空泵分离菌液和菌丝,将分离的100 mL菌液用旋转蒸发仪减压浓缩至体积为30 mL,加等体积30 mL氯仿萃取1次,再体积减半氯仿再次萃取1次,合并滤液,挥干后加入2 mL色谱甲醇溶解,超声10 min,混匀后过0.22 μm的微孔滤膜,滤液样品待测。
1.2.4 HPLC检测条件
Agilent Eclipse plus-C18色谱柱 (250 mm×4.6 mm, 5 μm),流动相 0.015 mol/L 乙酸铵-甲醇溶液 (70∶30),流速1 mL/min,柱温35 ℃,进样量10 μL。在波长选择上,Hup A在308–310 nm均有很好的紫外吸收,而Hup B在308 nm上有良好的紫外吸收,故波长选用308 nm。在此色谱条件下,样品中的Hup A、Hup B与其他峰能达到基线分离。
1.2.5 对照品制备
Hup A对照品:精密称取Hup A对照品2.40 mg于25 mL容量瓶中以甲醇溶解并定容,得浓度为0.096 mg/mL对照品溶液,再分别稀释成 48.0、24.0、12.0、6.0、3.0、1.5 μg/mL 的对照品供试液,待测。
Hup B对照品:精密称取 Hup B对照品2.50 mg于25 mL容量瓶中以甲醇溶解并定容,得浓度为0.1 mg/mL对照品溶液,再分别稀释成7.50、5.00、2.50、1.00、0.50、0.25 μg/mL 的对照品供试液,待测。
1.2.6 仪器精密性、样品稳定性、检测限(LOD)、定量限 (LOQ) 和样品加标回收率检测方法
仪器精密:取制备好的Hup A和Hup B标准品,分别以进样量10 μL连续进样6次,计算其相对标准偏差 (RSD)。样品稳定性、LOD、LOQ:取供试样品1份,将样品于0、2、4、6、8、12 h进样10 μL,按“1.2.4” HPLC条件测定峰面积,LOD和LOQ的测定是根据响应的标准偏差以及标准曲线的校准曲线所得到的斜率[15],LOD和LOQ分别表示为3.3a/S和10a/S(a表示响应的标准偏差,S表示回归线的斜率)。样品加标回收率:取已测Hup A样品加入0.4 mL Hup A对照品溶液 (浓度16.5 μg/mL)、取Hup B样品加入0.4 mL Hup B对照品溶液 (浓度5.5 μg/mL),得供试品样液,微孔滤膜滤过,得加样回收液,进样10 μL,测定峰面积,回收率计算公式如下:

1.2.7 内生真菌tanju发酵特性研究
在内生真菌tanju菌株培养稳定期 (菌培养至第5 天) 加入诱导子5 mL,连续检测内生真菌发酵液中第6–15天次生代谢产物Hup A、Hup B的含量,每天3个平行;同时检测诱导子中Hup A、Hup B的含量。内生真菌 tanju菌诱导后 Hup A/Hup B的含量=发酵液中总Hup A/Hup B含量–诱导子中Hup A/Hup B含量。
将从发酵液分离出的菌丝60 ℃干燥至恒重,冷却称重为干重,重复3次取平均值即为其生物量,菌液测定其pH。
2 结果与分析
2.1 线性关系的考察
将已制备的Hup A和Hup B对照品按“1.2.4”色谱条件测定,以进样浓度对峰面积进行回归,得标准曲线方程为:
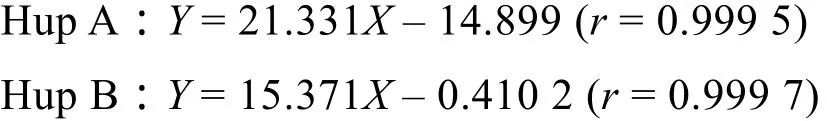
其校准图的相关系数r大于0.998 5[16-17],可知当进样量位于 1.50−48.00 μg/mL、0.25−7.50 μg/mL之间时,Hup A、Hup B的进样量与峰面积呈良好线性关系。
2.2 仪器精密性、样品稳定性、LOD、LOQ和样品加标回收率结果
Hup A、Hup B标准品分别连续进样6次,其中Hup A标准品的峰面积RSD为0.31%,Hup B标准品的峰面积RSD为1.01%,结果表明仪器精密性良好。样品按“1.2.6”测定峰面积,Hup A的峰面积RSD为1.23%;Hup B的峰面积RSD为2.40%,结果表明,供试品溶液在12 h内稳定。同时,Hup A的检测限和定量限分别为0.42 μg/mL、0.81 μg/mL;Hup B 的检测限和定量限分别为0.30 μg/mL、0.62 μg/mL。加样回收率试验结果见表1,结果表明Hup A的平均回收率为106.83%(RSD=3.34%,n=3)、Hup B的平均回收率为108.06% (RSD=3.60%,n=3)。
2.3 样品中Hup A、Hup B检测结果
将已制备好的样品按“1.2.4”色谱条件重复分析3次,测得Hup A标准品的保留时间22.517 min(图1A),Hup B的保留时间10.413 min (图1B),内生真菌发酵液中 Hup A、Hup B的保留时间分别为22.513 min、10.312 min (图1C),空白对照中Hup A、Hup B的保留时间分别为22.430 min、10.308 min (图1D),结果显示发酵液和空白对照中Hup A、Hup B的保留时间和其对应的标准品的保留时间基本一致。通过标准曲线计算诱导子和发酵液提取物中Hup A、Hup B的含量,测得发酵液中 Hup A、Hup B的平均浓度分别为19.248 9 μg/mL、6.442 4 μg /mL,诱导子中 Hup A、Hup B平均浓度分别为5.771 0 μg/mL、2.161 0 μg/mL,因此,胶胞炭疽合成Hup A、Hup B产量分别为13.477 9 μg/mL、4.281 4 μg /mL。
2.4 诱导子作用时间对内生真菌tanju发酵液中Hup A、Hup B含量影响曲线
在前期研究中发现在生长稳定期加入诱导子,其次生代谢产物Hup A、Hup B的含量更高,所以本试验在tanju菌生长至第5天加入诱导子。结果如图2所示,内生真菌tanju发酵液中Hup A、Hup B的含量在诱导子加入后均有明显提高,其含量均先增加后减少,随后又升高继而再继续减少,发酵液中 Hup A含量在第 14天达到最高(12.417 0 μg/mL),Hup B 在第 8天达到最高(4.660 3 μg/mL)。
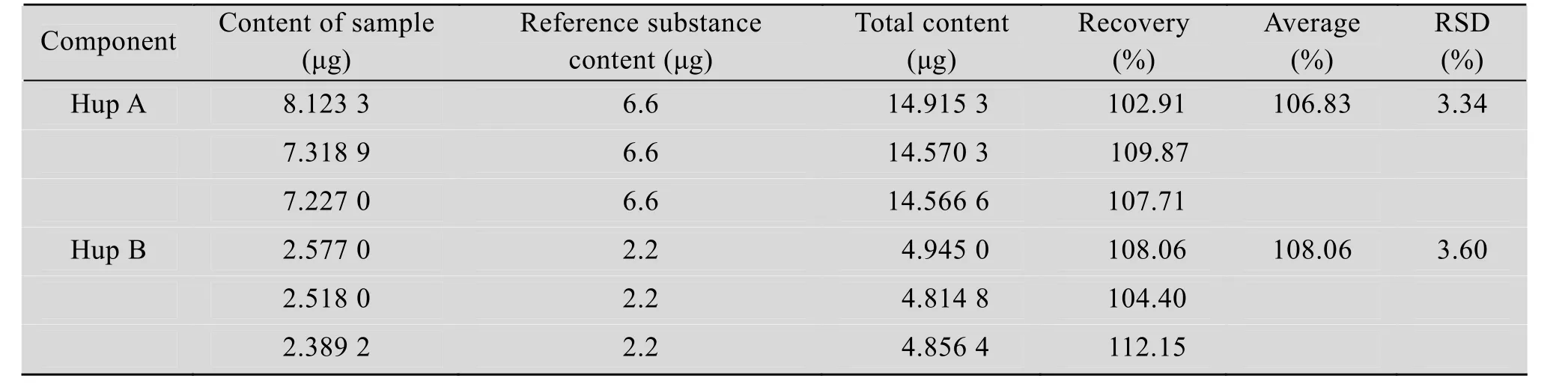
表1 Hup A和Hup B加样回收率试验结果Table 1 Recoveries of Hup A and Hup B in samples
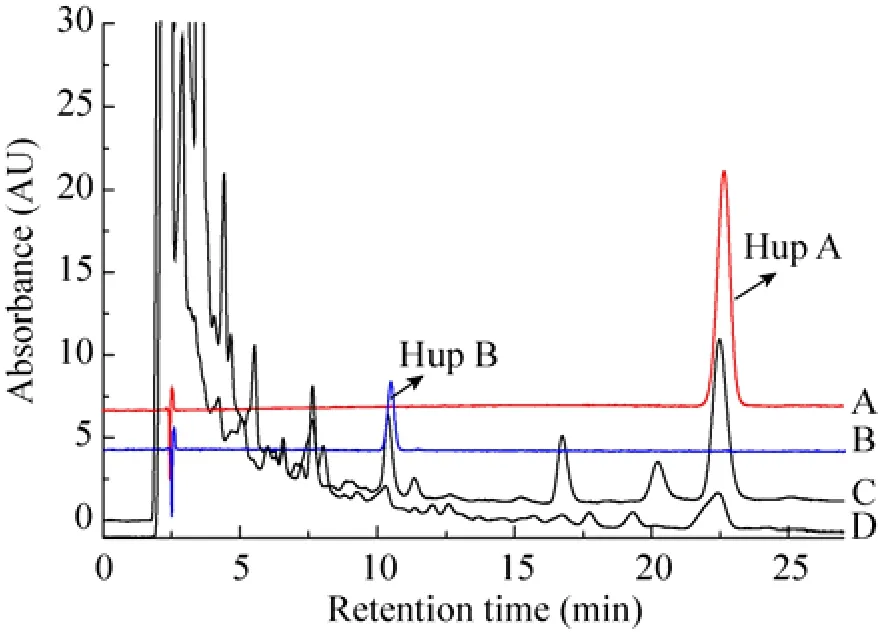
图1 Hup A标准品 (A)、Hup B标准品 (B)、内生真菌 tanju发酵液提取物 (C) 和诱导子提取物 (D)的HPLC图Fig. 1 The HPLC chromatograms of the Hup A standard (A), the Hup B standard (B), sample extracted from endophytic fungi tanju (C) and sample extracted from elicitor (D). The standard content of Hup A is 24.0 μg/mL, and that of Hup B is 5.0 μg/mL.
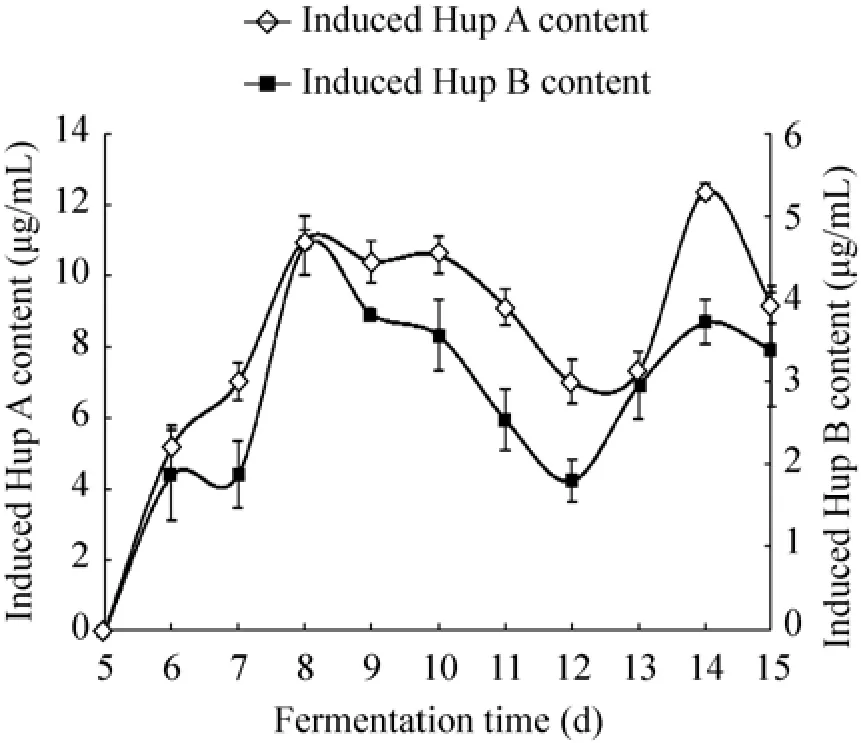
图2 内生真菌tanju发酵液中Hup A、Hup B含量的变化Fig. 2 Effects of Hup A and Hup B contents in fermentation broth of endophytic fungus tanju.
2.5 内生真菌tanju发酵培养特性研究
从图3可以看出,菌株从第1天开始进入对数生长期,第4天生物量达到最大值,随后进入稳定生长期,第8天后菌株进入衰亡期。在对数生长前期,随着菌丝量的迅速增加,对营养物质的消耗和胞外降解导致发酵液pH值由6.50降至4.69,在酸性条件下,内生真菌tanju生长状况良好。随后由于次生代谢产物的积累,发酵液 pH值回升,在菌丝生物量达到最高时,发酵液酸碱度趋于中性,进入衰亡后期培养液 pH值继续缓慢上升,Hup A、Hup B积累期间培养液呈弱碱性(图 3)。
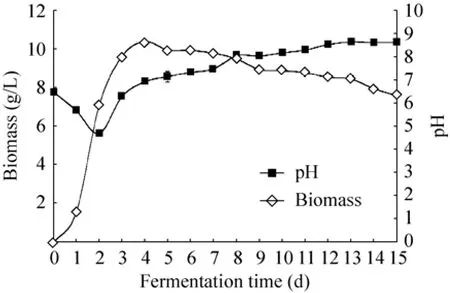
图3 内生真菌tanju发酵生长曲线Fig. 3 Fermentation curves of endophytic fungi tanju.
3 讨论
本文建立了HPLC测定内生真菌tanju发酵液中Hup A、Hup B含量的方法。本课题组曾采用Agilent ZORBAX SB-C18进行Hup A、Hup B的检测,但受色谱柱残余硅羟基的影响,Agilent ZORBAX SB-C18对分析物产生强烈吸附而造成色谱峰严重拖尾。虽然本实验室在流动相乙酸铵中加入 1%–3%的三乙胺 (pH 4–5),可减少 Hup A、Hup B和残余硅羟基的相互作用,峰形更尖锐、对称性更高,有效减轻了色谱峰的拖尾现象,但保留时间大大减少,不利于各组分的分离,且易对色谱柱造成不可逆的损伤。因此,本实验室选用了适合生物碱分离的Agilent Eclipse plus-C18色谱柱,该色谱柱改进了硅胶制造和键合技术,对于难分离的碱性化合物可获得出色的峰形。本试验证明该色谱柱在分离Hup A、Hup B时,峰对称性良好,且与其他物质能达到很好的基线分离。
本试验所分离的内生真菌 tanju在分离初期即使未诱导也可合成Hup A和Hup B,但随着菌株保存时间的延长、传代次数的增加,tanju菌在未添加诱导子的情况下,发酵液中检测不到 Hup A与Hup B。本课题组在内生真菌tanju发酵的第5天 (生长稳定期) 添加诱导子,较生长初期添加诱导子Hup A、Hup B含量高。这可能是由于在早期添加诱导子,诱导子被用于合成初级代谢产物,或者生长早期细胞还没有合成太多功能酶,诱导子的利用率较低,而在生长稳定期添加,生物量有了一定的积累,受诱导子刺激后,即可合成次级代谢产物[18]。然而,Ballica等[19]曾提出诱导子在达指数生长期之前加入效果最好,可见添加诱导子因种属不同而有所差别。另外,诱导子的种类、添加时间及浓度对内生真菌次生代谢产物产量均有影响[20-22]。
相比直接从H.serrata等石松类植物提取获得Hup A、Hup B,能够合成Hup A、Hup B的内生真菌具有更大的发展潜力,因为内生真菌培养简单、周期短,可进一步优化培养条件[23]。此外,还可通过多种手段改造、提高菌种性能,例如诱变育种、深入研究Hup A合成关键酶、构建Hup A高产工程菌[24-26]。通过内生真菌发酵合成Hup A、Hup B是解决濒危植物药物开发的有效途径。
[1]Xu HB, Wang XP, Liu GL. Pharmacological studies and clinical application of huperzine A. World Clin Drugs,2014, 35(1): 60–63 (in Chinese).徐红冰, 王晓平, 刘皋林. 石杉碱甲的药理研究及临床应用. 世界临床药物, 2014, 35(1): 60–63.
[2]Yu HY, Sun YM, Yang YJ. Advances in studies onHuperzia serrata. Chin Tradit Herb Drugs, 2001, 32(3):279–281 (in Chinese).余红英, 孙远明, 杨跃进. 草药蛇足石杉的研究进展.中草药, 2001, 32(3): 279–281.
[3]Zhu D, Wang J, Zeng Q, et al. A novel endophytic Huperzine A-producing fungus,Shiraiasp. Slf14,isolated fromHuperzia serrata. J Appl Microbiol, 2010,109(4): 1469–1478.
[4]Damar U, Gersner R, Johnstone JT, et al. Huperzine A: a promising anticonvulsant, disease modifying, and memory enhancing treatment option in Alzheimer’s disease. Med Hypotheses, 2017, 99: 57–62.
[5]Yang GY, Wang YY, Tian JZ, et al. Huperzine a for Alzheimer’s disease: a systematic review and meta-analysis of randomized clinical trials. PLoS ONE,2013, 8(9): e74916.
[6]Zhou XL, Yuan JQ, Wang S, et al. Determination of huperzine A and huperzine B inHuperzia s erratacollected at diffefent collecting times by HPLC. China J Tradit Chin Med Pharm, 2013, 28(2): 504–506 (in Chinese).周小雷, 袁经权, 王硕, 等. HPLC法测定不同季节千层塔中石杉碱甲和石杉碱乙含量. 中华中医药杂志,2013, 28(2): 504–506.
[7]Yuan JQ, Zhou XL, Wang S, et al. Simultaneous determination of huperzine A and huperzine B in different parts ofHuperzia s erratafrom different habitats by HPLC. Chin J Pharm Anal, 2012, 32(9):1541–1544, 1549 (in Chinese).袁经权, 周小雷, 王硕, 等. HPLC测定不同产地与不同部位千层塔中石杉碱甲和石杉碱乙含量. 药物分析杂志, 2012, 32(9): 1541–1544, 1549.
[8]Ma XQ, Gang DR.In vitroproduction of Huperzine A, a promising drug candidate for Alzheimer’s disease.Phytochemistry, 2008, 69(10): 2022–2028.
[9]Ma XQ, Tan CH, Zhu DY, et al. A survey of potential huperzine A natural resources in China: the Huperziaceae. J Ethnopharmacol, 2006, 104(1/2):54–67.
[10]Stierle A, Strobel G, Stierle D. Taxol and taxane production byTaxomyces a ndreanae, an endophytic fungus of Pacific yew. Science, 1993, 260(5105):214–216.
[11]Shi W, Luo JP, Ding ZH, et al. Isolation and identification of endophytic fungi ofHuperzia serrata.Chin Tradit Herb Drugs, 2005, 36(2): 281–283 (in Chinese).石玮, 罗建平, 丁振华, 等. 千层塔内生真菌分离鉴定的初步研究. 中草药, 2005, 36(2): 281–283.
[12]Han WX, Song T, Yang SZ, et al. Identification of alkaloids and huperzine A-producing endophytic fungi isolated from wildHuperzia serrata. J Int Pharm Res,2015, 42(4): 507–512 (in Chinese).韩文霞, 宋涛, 杨时珍, 等. 野生蛇足石杉产生物碱和石杉碱甲内生真菌分离鉴定. 国际药学研究杂志,2015, 42(4): 507–512.
[13]Han WX, Li WZ, Li XF, et al. Detection and identification of high producing Huperzine A by an endophytic fungus fromHuperzia serrata. J Int Pharm Res, 2016, 43(6): 1112–1116 (in Chinese).韩文霞, 李伟泽, 李小峰, 等. 蛇足石杉内生真菌产石杉碱甲含量检测及真菌的鉴定. 国际药学研究杂志,2016, 43(6): 1112–1116.
[14]Zhang JC, Wei J, Zhong HM, et al. Determination of Huperzine A in the extract ofHuperzia serrataby high performance liquid chromatography. Chin J Chromatogr,2013, 31(1): 79–82 (in Chinese).张敬彩, 魏杰, 钟虹敏, 等. 高效液相色谱法定量测定中药千层塔提取物中的石杉碱甲. 色谱, 2013,31(1): 79–82.
[15]Francisco MLD, Resurreccion AVA. Development of a reversed-phase high performance liquid chromatography(RP-HPLC) procedure for the simultaneous determination of phenolic compounds in peanut skin extracts. Food Chem, 2009, 117(2): 356–363.
[16]Li CC, Farn SS, Yeh YH, et al. Development and validation of an anion-exchange HPLC method for the determination of fluoride content and radiochemical purity in [18F]NaF. Nucl Med Biol, 2011, 38(4):605–612.
[17]Ji M, Li Q, Ji H, et al. Investigation of the distribution and season regularity of resveratrol inVitis amur ensisvia HPLC-DAD-MS/MS. Food Chem, 2014, 142: 61–65.
[18]Li JR, Liu MX, Cao MD, et al. Effects ofPenicillum citrinumelicitor on the biosynthesis of taxol in suspension cell cultures ofTaxus chinensis. Bull Bot Res,1998, 18(1): 78–82 (in Chinese).李家儒, 刘曼西, 曹孟德, 等. 桔青霉诱导子对红豆杉培养细胞中紫杉醇生物合成的影响. 植物研究,1998, 18(1): 78–82.
[19]Ballica R, Ryu DDY. Effects of rheological properties and mass transfer on plant cell bioreactor performance:production of tropane alkaloids. Biotechnol Bioeng,1993, 42(10): 1181–1189.
[20]Wang C, Tan YY, Yang SW, et al. Effects of different inducers on endophytic fungi ofCinnamomum longepaniculatum. J Anhui Agri Sci, 2017, 45(20):14–17, 45 (in Chinese).汪超, 谭韵雅, 杨胜伟, 等. 不同诱导子对油樟内生菌次生代谢产物的影响. 安徽农业科学, 2017, 45(20):14–17, 45.
[21]Chen YQ, Zhu WH, Wu YQ, et al. Effects of fungus elicitors on taxol production in suspension cells ofTaxus yunnanensis. Chin J Biotech, 1999, 15(4): 522–524 (in Chinese).陈永勤, 朱蔚华, 吴蕴祺, 等. 几种真菌诱导子对云南红豆杉细胞产生紫杉醇的影响. 生物工程学报,1999, 15(4): 522–524.
[22]Li Y, Zhao L, Cui L, et al. Effects of elicitors on growth of adventitious roots and contents of secondary metabolites inTripterygium wilfor diiHook. f. Chin J Biotech, 2015, 31(5): 734–743 (in Chinese).李琰, 赵磊, 崔蕾, 等. 诱导子对雷公藤不定根生长和次生代谢产物含量的影响. 生物工程学报, 2015,31(5): 734–743.
[23]Ji ZD, Tu YS, Chen M, et al. Conditional optimization and kinetic research on producing huperzine A usingHuperzia serratain vitro. Chin Tradit Herb Drugs, 2016,47(3): 488–492 (in Chinese).吉枝单, 涂艺声, 陈曼, 等. 蛇足石杉离体培养产石杉碱甲的条件优化及动力学研究. 中草药, 2016,47(3): 488–492.
[24]Zhang XM, Wang ZQ, Jan S, et al. Expression and functional analysis of the lysine decarboxylase and copper amine oxidase genes from the endophytic fungusColletotrichum gloeosporioidesES026. Sci Rep, 2017,7(1): 2766.
[25]Yang MQ, You WJ, Wu SW, et al. Global transcriptome analysis ofHuperzia serrateand identification of critical genes involved in the biosynthesis of huperzine A. BMC Genomics, 2017, 18(1): 245.
[26]Du C, Li J, Tang YT, et al. Cloning, prokaryotic expression and characterization of lysine decarboxylase gene fromHuperzia serrata. Chin J Biotech, 2014, 30(8):1299−1307 (in Chinese).杜次, 李菁, 唐云涛, 等. 蛇足石杉赖氨酸脱羧酶基因的克隆、原核表达及其功能分析. 生物工程学报,2014, 30(8): 1299−1307.
