肌注异体脂肪间充质干细胞对离心运动后大鼠骨骼肌调节因子的影响
2018-06-06刘秀娟张念云
刘秀娟,张念云,孙 飙,王 斌,徐 妍
肌注异体脂肪间充质干细胞对离心运动后大鼠骨骼肌调节因子的影响
刘秀娟1,张念云1,孙 飙1,王 斌1,徐 妍2
1. 南京体育学院 运动健康科学系, 江苏 南京 210014; 2. 南京市再生医学工程技术研究中心, 江苏 南京 210000
目的:通过肌肉注射异体脂肪间充质干细胞(ASCs),观察其对一次性离心运动后不同时间点大鼠骨骼肌调节因子的影响,探讨ASCs注射对离心运动后骨骼肌损伤修复的机制。方法:8周龄雄性SD大鼠一次性离心运动后,在左腿腓肠肌注射生理盐水(PBS),右腿腓肠肌注射ASCs,然后,随机分为运动后1天组(D1)、运动后3天组(D3)、运动后7天组(W1)和运动后14天组(W2)。透射电镜观察骨骼肌的超微结构变化;测定血清IGF1、GDF8的含量及骨骼肌调节基因的表达。结果:与PBS相比,ASCs注射明显促进肌纤维的修复。与D1组比较,W1组血清IGF1水平显著降低(<0.05),GDF8水平显著降低(<0.05),W2组血清GDF8水平显著升高(<0.05)。与PBS组相比,ASCs组IGF1 mRNA在W2显著升高(<0.05);GDF8 mRNA在D3显著降低(<0.05),在W2极显著降低(<0.01);Atrogin1 mRNA在D3显著降低(<0.05),在W1时间点极显著降低(<0.01)。PBS组IGF1 mRNA与血清IGF1含量、GDF8 mRNA与血清GDF8含量均显著性正相关(<0.05);骨骼肌总的PCNA mRNA与总的IGF1 mRNA显著性正相关(<0.05)。结论:离心运动后,肌注异体ASCs可以增加骨骼肌IGF1 mRNA的表达,降低GDF8和Atrogin1的mRNA表达。肌注异体ASCs可能不影响细胞因子IGF1和GDF8的分泌,而是通过影响局部基因表达来改善离心运动后肌肉的再生修复。
离心运动;间充质干细胞;骨骼肌;IGF1;GDF8
运动过程,尤其是急性运动,经常会引起运动损伤,其中以肌肉的损伤最为常见[3]。如何快速修复运动损伤成为人们关心的热点问题之一。在肌肉修复过程中,很多因子被分泌出来。胰岛素样生长因子(IGFs)可以促进肌细胞的增殖和分化,在肌肉再生和肥大过程中发挥关键作用[26]。而近年来有研究报道,肌肉生长抑制素(myostatin,也叫GDF8或MSTN),一个骨骼肌生长负调控因子,也影响骨骼肌的再生修复[8,11,19]。目前以干细胞为基础的细胞疗法正成为再生修复医学研究领域中的热点和前沿。
骨骼肌干细胞——卫星细胞可以促进肌肉损伤后修复[12]。肌肉的再生能力随卫星细胞数量和功能的下降逐渐降低,卫星细胞是直接导致肌肉修复的细胞。卫星细胞通过调节MyoD1促进成肌细胞的分化[21]。由于卫星细胞随年龄的增长逐渐减少并且不便于提取获得,故多用间充质干细胞进行研究。间充质干细胞可以改善肌肉组织再生[17]。脂肪来源的间充质干细胞可以分化为骨骼肌卫星细胞[14]。遇到刺激,如外伤或运动,卫星细胞被激活并表达生肌调节因子(MRFs),如转录因子Myf5、MyoD1、Myogenin和MRF4等,增殖并分化为肌纤维。在离心运动引起的肌肉损伤修复过程中,局部注射间充质干细胞是否可以改善肌肉损伤的修复?在此过程中,其对生肌调节因子和骨骼肌调节因子IGF1和GDF8有无影响,尚不清楚。本研究通过肌注异体脂肪间充质干细胞,观察离心运动后恢复期骨骼肌调节因子的变化,探讨其在离心运动后肌肉损伤修复中的作用。
1 实验材料与方法
1.1 材料
1.1.1 实验动物与分组
8周龄SPF级SD雄性大鼠44只,购自南京医科大学实验动物中心,适应性饲养1周,自由进食进水,光照比为12 h:12 h。然后进行一次性离心运动,运动后随机分为4组,分别是运动后1天组(D1)、运动后2天组(D2)、运动后7天组(W1)和运动后14天组(W2),每组11只。
1.1.2 运动方案
进行一次性跑台运动,跑台坡度为-20°,速度为 20 m/min,运动时间为90 min。实验开始前,为适应运动,首先让大鼠从静止慢慢加速到20 m/min,这个渐进加速过程在5 min内完成,等速度增加至20 m/min时,开始计算时间,并且之后一直保持在这个速度,持续90 min。运动结束后30 min,在大鼠的左腿腓肠肌外侧头注射100 µL生理盐水,右腿腓肠肌外侧头注射100 µL含间充质干细胞数量为5×105的生理盐水(脂肪间充质干细胞从280~300 g雌性大鼠腹部脂肪组织分离得到),分别在注射后24 h,72 h,7天,14天后将大鼠麻醉处死,收集血液,血液经3 000 r/min,4 ℃离心后,分离血清置于-80 ℃超低温冰箱保存;分别收集左右两腿的腓肠肌,部分用戊二醛和锇酸固定,用于组织学研究,部分置于液氮速冻,后转入-80 ℃超低温冰箱冻存备用。
1.1.3 主要仪器设备与试剂
全自动酶标仪(TECAN M200pro)、实时荧光定量PCR仪(ABI Step One Plus,AppliedBiosystems公司)。GDF8 Elisa检测试剂盒(DGDF80, R&D Systems, USA),IGF1 Elisa检测试剂盒(ELR-IGF1,Rio-Biotech, USA),购自南京福麦斯生物技术有限公司。提取组织RNA及PCR相关试剂Trizol(Invitrogen Life Technology),反转录试剂盒(TAKARA BIOINC, Japan),购自上海皓佳生物技术有限公司。
1.2 方法
1.2.1 脂肪间充质干细胞(ASC)的制备
取280~300 g雌性SD大鼠的腹部脂肪组织,进行清洗剪碎,洗涤,加入胶原酶混匀后转移到温育摇床内,37 ℃恒温消化30~40 min,消化为糜状后,1 000 r/min,离心3 min,去掉上层糜状脂肪,添加10~20 mL消化终止液,混匀终止消化;用孔径为100 µm的细胞筛网过滤,保留滤液。将滤液 1 200 r/min离心8 min,重复洗涤3次,制成细胞悬液后进行计数,按照直径每100 mm培养皿5×106~2×107个细胞接种,原代培养24~48 h后,根据细胞的生长状态进行细胞换液,鉴定,传代,收集第3代脂肪间充质干细胞进行实验,本实验脂肪间充质干细胞由南京瑞吉科生物技术有限公司制备并提供。
1.2.2 腓肠肌组织超微结构观察
取腓肠肌组织样,用戊二醛和锇酸固定,送去南京医科大学透射电镜实验室包埋,切片,电镜(JEM—1010)观察并拍照。
1.2.3 血清IGF1、GDF8的测定
血清IGF1和GDF8 的检测严格按照Elisa试剂盒说明书进行测定。
1.2.4 基因检测
腓肠肌总RNA用Trizol试剂盒提取。提取的总RNA用Nano Drop分光光度计(ND-2000)测定总RNA浓度和纯度(OD260/OD280 = 1.8~2.0)。用琼脂糖-甲醛变性凝胶电泳验证RNA的完整性。检测合格后,进行RT,获得各样品RNA的cDNA。RT产物经验证无基因组DNA污染后,保存在-20℃用于PCR检测。根据GenBank上大鼠的相关cDNA序列采用Primer 5设计目的基因和内参GAPDH的引物,引物由上海捷瑞生物技术有限公司合成,详细序列见表1。实验采用实时荧光定量PCR,以GAPDH为内参,对目的基因的表达进行相对定量,用2-ΔΔCT法对有效性数据进行统计分析。
1.2.5 统计方法


表1 实验大鼠基因上下游引物序列
2 研究结果
2.1 注射干细胞与注射生理盐水后腓肠肌形态结构变化
由图1可以看出,注射干细胞组在D1、D3、W1、W2任一时间点,肌纤维排列均比相应时间点注射生理盐水组整齐,表明间充质干细胞注射有助于离心运动后骨骼肌的损伤修复。从时间上来看,一次性离心运动3天后,肌纤维排列最不规则,随着时间的延长,逐渐恢复,从两组的4个时间点比较可以看出,间充质干细胞注射有助于一次性离心运动后肌纤维结构的损伤恢复。

图1 注射干细胞与注射生理盐水后不同时间点腓肠肌形态结构变化
Figure1. Morphological Changes of Gastrocnemius Muscle after Injection of Stem Cells and Saline Injection at Different Times
2.2 不同时间点大鼠血清IGF1和GDF8的浓度变化
由图2可以看出,与D1组相比,W1组IGF1水平显著降低(<0.05),W1组GDF8水平显著降低(<0.05),W2组GDF8水平显著升高(<0.05),与D3组相比,W2组GDF8水平显著升高(<0.05)。

图2 不同时间点大鼠血清IGF1和GDF8的水平变化
Figure2. Changes in Serum IGF1 and GDF8 Levels of Different Time Points
注:*表示与D1组比,<0.05;#表示与D3组比,<0.05。
2.3 注射干细胞后不同时间点大鼠腓肠肌基因表达的变化
由图3可以看出,与PBS组相比,ASC组IGF1mRNA相对表达量在时间点W2显著升高(<0.05);GDF8 mRNA相对表达量在时间点D3显著降低(<0.05),在W2时间点极显著降低(<0.01);Atrogin1 mRNA相对表达量在时间点D3显著降低(<0.05),在W1时间点极显著降低(<0.01);MyoD1、Myf5、Pax7、PCNA、MuRFmRNA相对表达量与PBS组相比在4个时间点均无统计学差异显著性(>0.05)。
2.4 IGF1、GDF8及PCNA相关性分析
如图4所示,血清IGF1含量与GDF8含量无相关性(=0.593,图4A);PBS组IGF1 mRNA的表达与血清IGF1含量显著性正相关(=0.011,图4B);ASC组IGF1 mRNA的表达与血清IGF1含量无相关性(=0.729,图4C);PBS组GDF8 mRNA的表达与血清GDF8含量显著性正相关(=0.006,4D);ASC组GDF8 mRNA的表达与血清GDF8含量无相关性(=0.627,图4E);PBS组PCNA mRNA的表达与PBS组IGF1 mRNA的表达显著性正相关(=0.031,图4F);ASC组PCNA mRNA的表达与ASC组IGF1mRNA的表达显著性正相关(=0.043,图4G);骨骼肌总的PCNA mRNA的表达与总的IGF1mRNA的表达显著性正相关(=0.025,图4H)。
3 分析与讨论
骨骼肌是主要的运动器官,其生长发育及损伤修复状况直接影响机体的运动能力。在运动过程中,肌肉损伤占所有运动型损伤的35%~55%。如何快速地进行损伤修复,不影响人们的日常生活,越来越受到关注。目前以干细胞为基础的细胞疗法正成为再生修复医学研究领域中的热点和前沿。干细胞具有自我更新、高度增殖和分化的能力,并可以大量移植,所以其被用于临床组织再生的治疗[4]。卫星细胞是一种介导骨骼肌生长和再生的干细胞。离心运动有助于间充质干细胞在骨骼肌中出现[22]。骨髓间充质干细胞有助于离心运动后卫星细胞的扩张,对肌肉再生修复有益。数据表明,Laminin-111补充提高骨骼肌干细胞的数量或功能,有利于离心运动损伤后骨骼肌的再生反应[27]。这与我们的结果相似,注射干细胞后在任一时间点,肌纤维排列均比相应时间点注射生理盐水组整齐,表明间充质干细胞注射有助于一次性离心运动后肌纤维结构的损伤恢复。研究报道,骨髓间充质干细胞在肌肉收缩后自然积聚,可增强对运动的适应性反应[28],这与我们的结果类似。
已有研究显示,间充质干细胞可以促进肌肉的再生修复。人骨髓间充质干细胞对小鼠骨骼肌的再生有长期的影响[1]。骨髓间充质干细胞有助于离心运动后骨骼肌血管的生成[7]。体外研究显示,间充质干细胞可以促进皮肤损伤后的再生[16]。成年大鼠骨髓间充质干细胞治疗可以延缓失神经肌肉的萎缩[9]。进一步研究发现,间充质干细胞干预通过影响生肌相关基因的表达,促进骨骼肌的修复。骨髓间充质干细胞可以促进体外成肌细胞表达肌间线蛋白(desmin),肌细胞增强因子2(MEF2),肌球蛋白重链2(MHC2)和α-横纹肌肌动蛋白(α-SCA)等,使其分化为肌肉组织[24]。LO等报道,间充质干细胞能够增加肌源性标记物Pax7,MyoD的表达[15]。VU等也发现,同种异体间充质干细胞移植可以显著增加MyoD和Myf5的表达[23],促进肌肉再生修复。LIU等发现,自体脂肪间充质干细胞移植能增加PCNA的表达,显著改善肝脏的再生能力[13]。HU等也发现,人脂肪源性间充质干细胞可以增加成纤维细胞PCNA的表达,促进细胞增殖,增加胶原蛋白的合成[5]。本研究中我们也检测了相关基因的表达,发现离心运动后注射异体脂肪间充质干细胞,显著增加IGF1 mRNA的表达,这一结果与KIM等的研究报道相符[10];显著降低了MSTN和atrogin1的mRNA表达,GEHMERT等的报道脂肪源性间充质干细胞分泌IGF1可以保护成肌细胞对抗MSTN的负面效应[2],可以很好地解释这一结果。但脂肪间充质干细胞注射对骨骼肌MyoD1、Myf5、Pax7、PCNA、MuRF的mRNA表达均没有显著影响,这与以上间充质干细胞的研究报道不符,可能是受离心运动模型的影响,也可能受研究的组织、物种及在体离体等因素的影响。由我们的结果分析,在离心运动后,骨骼肌修复过程中,脂肪间充质干细胞注射,主要通过影响骨骼肌IGF1、MSTN和atrogin1的mRNA表达来发挥作用,其深层次的机制,尚需进一步研究。
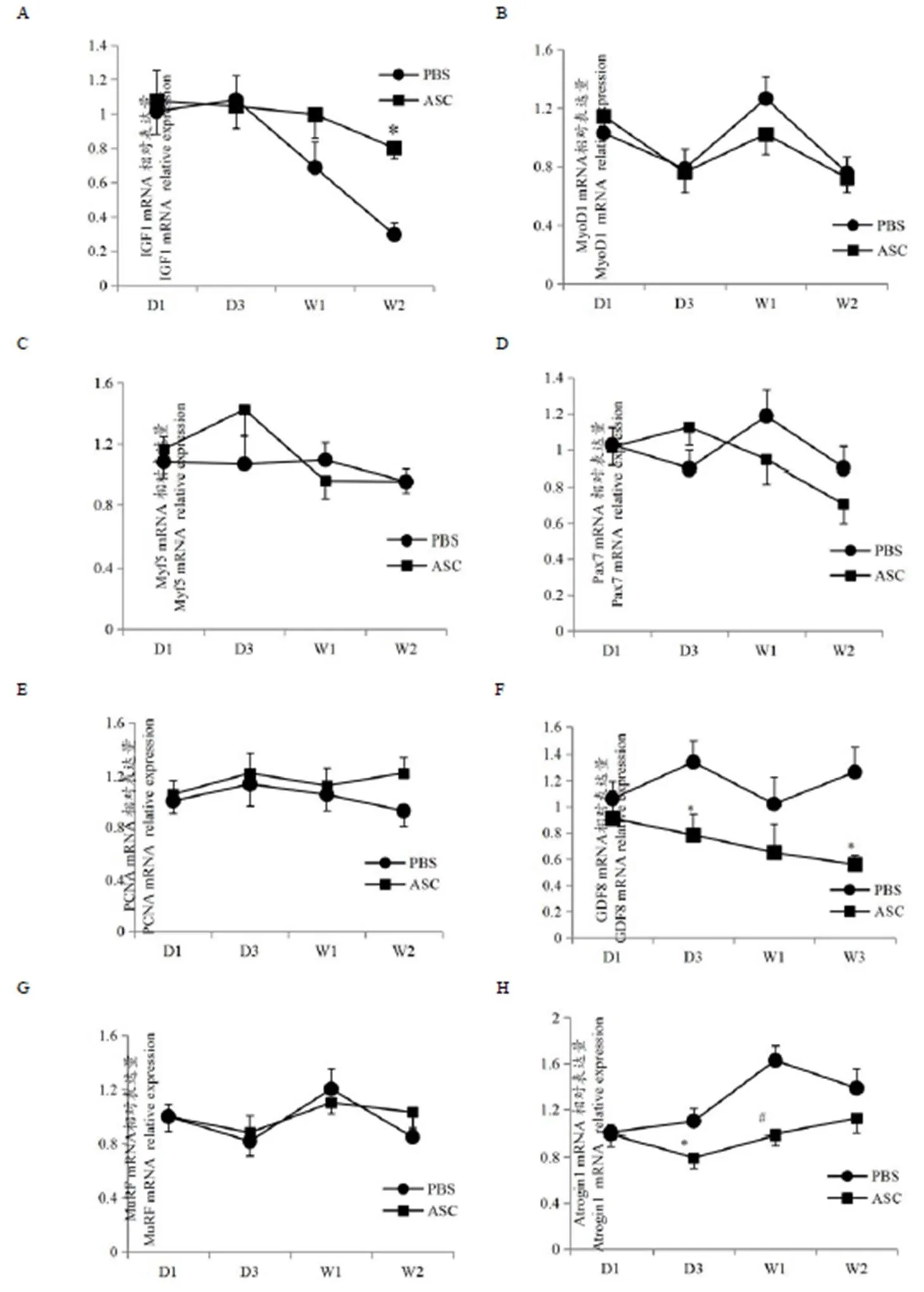
图3 注射干细胞后不同时间点大鼠腓肠肌基因mRNA相对表达量
Figure3. Relative Expression of mRNA Gene in Gastrocnemius Muscle of Rats at Different Time Points after Injection of Mesenchymal Stem Cells
注:A: IGF1 mRNA; B: MyoD1 mRNA; C: Myf5 mRNA; D: Pax7mRNA; E: PCNA mRNA; F:GDF8 mRNA; G:MuRF mRNA; H:Atrogin1 Mrna; *表示与PBS组比,<0.05;#表示与PBS组比,<0.01。

图4 IGF1、GDF8及PCNA相关性
Figure4. Correlation between IGF1, GDF8&PCNA
注:A:血清IGF1与血清GDF8相关性(n=32,=0.593);B:PBS组IGF1mRNA与血清IGF1相关性(n=32,=0.011);C:ASC组IGF1 mRNA与血清IGF1相关性(n=32,=0.729);D:PBS组GDF8 mRNA与血清GDF8相关性(n=32,=0.006);E:ASC组GDF8 mRNA与血清GDF8相关性(n=32,=0.627);F:PBS组IGF1 mRNA与PCNA mRNA相关性(n=32,=0.031);G:ASC组IGF1 mRNA与PCNA mRNA相关性(n=32,=0.043);H:总的IGF1mRNA与PCNA mRNA相关性(n=64,=0.025)。
间充质干细胞除通过影响骨骼肌相关基因的表达促进损伤修复外,许多研究表明,其还可以通过影响细胞的分泌功能改变肌肉的再生修复。KIM等研究报道,脂肪源性间充质干细胞可能通过胰岛素样生长因子1(IGF-1)信号通路影响肩袖肌肉的再生[10]。此外,用重组生长因子IGF-1和间充质干细胞刺激能显著提高肌肉祖细胞对旁分泌的影响。PUMBERGER等在一个临床的损伤模型中发现,间充质干细胞的旁分泌信号明显改善肌肉的重塑能力[18]。此外,在除骨骼肌以外的其他组织也发现间充质干细胞影响细胞的增殖和分泌功能。HUAT等发现,在骨髓间充质干细胞向神经前体细胞分化的过程中,IGF-1促进细胞的增殖和存活[6]。XIAN等报道,在骨重建过程中,骨基质释放IGF-1通过激活mTOR,刺激从间充质干细胞招募的成骨细胞分化,从而保持适当的骨微结构和质量[25]。对营养不良的小鼠,IGF-1注入连同间充质干细胞治疗可明显降低肌肉炎症和纤维化,并显著提高肌肉力量。IGF1和骨髓间充质干细胞联合治疗增强肌肉的修复效率[20]。本研究中,离心运动后肌肉注射异体脂肪间充质干细胞,未发现排异反应和炎性反应,血清IGF1水平在1周后显著降低,两周后恢复;GDF8在离心运动1周后显著降低,2周后显著升高。与骨骼肌中相应的mRNA表达的相关性分析发现,无论是IGF1还是GDF8的水平,均与注射生理盐水组的相应的IGF1和GDF8 mRNA表达呈显著相关,而与注射间充质干细胞组的IGF1和GDF8 mRNA表达无显著相关,而血清中IGF1的水平与两组骨骼肌中PCNA mRNA表达均呈显著相关。推测,在离心运动后骨骼肌损伤修复过程中,间充质干细胞局部注射可能不影响细胞因子IGF1和GDF8的分泌,而只是在注射局部起作用,在腓肠肌其对PCNA影响不大,推测,间充质干细胞可能通过影响骨骼肌调节因子IGF1、GDF8和Atrogin1的表达发挥作用。间充质干细胞干预可以促进离心运动后骨骼肌的损伤修复,其详细机制仍需进一步研究。
4 小结
1. 离心运动后,肌注异体脂肪间充质干细胞可以增加骨骼肌IGF1mRNA的表达,降低GDF8和Atrogin1的mRNA表达。
2. 肌注异体脂肪间充质干细胞可能不影响细胞因子IGF1和GDF8的分泌,而是通过影响局部基因表达来改善离心运动后肌肉的再生修复。
[1] DELG A S, VAND V I,BOERSMA H,. Long-term contribution of human bone marrow mesenchymal stromal cells to skeletal muscle regeneration in mice[J]. Cell Transplant, 2011, 20(2): 217-231.
[2] GEHMERT S, WENZEL C, LOIBL M,. Adipose tissue-derived stem cell secreted IGF-1 protects myoblasts from the negative effect of myostatin[J]. Biomed Res Int, 2014, 2014: 129048.
[3] GURRIARAN-RODRIGUEZ U, SANTOS-ZAS I, GONZALEZ-SANCHEZ J,. Action of obestatin in skeletal muscle repair: stem cell expansion, muscle growth, and microenvironment remodeling[J]. Mol Ther, 2015, 23(6): 1003-1021.
[4] HU F, WANG X, LIANG G,. Effects of epidermal growth factor and basic fibroblast growth factor on the proliferation and osteogenic and neural differentiation of adipose-derived stem cells[J]. Cell Reprogram, 2013, 15(3): 224-232.
[5] HU L, WANG J, ZHOU X,. Exosomes derived from human adipose mensenchymal stem cells accelerates cutaneous wound healing via optimizing the characteristics of fibroblasts[J]. Sci Rep, 2016, 6: 32993.
[6] HUAT T J, KHAN A A, PATI S,. IGF-1 enhances cell proliferation and survival during early differentiation of mesench-ymal stem cells to neural progenitor-like cells[J]. BMC Neurosci, 2014, 15: 91.
[7] HUNTSMAN H D, ZACHWIEJA N, ZOU K,. Mesenchymal stem cells contribute to vascular growth in skeletal muscle in response to eccentric exercise[J]. Am J Physiol Heart Circ Physiol, 2013, 304(1): H72-H81.
[8] JEONG J, CONBOY M J, CONBOY I M. Pharmacological inhibition of myostatin/TGF-beta receptor/pSmad3 signaling rescues muscle regenerative responses in mouse model of type 1 diabetes[J]. Acta Pharmacol Sin, 2013, 34(8): 1052-1060.
[9] JIANG J, YAO P, GU Y,. Adult rat mesenchymal stem cells delay denervated muscle atrophy[J]. Cell Mol Neurobiol, 2012, 32(8): 1287-1298.
[10] KIM S H, CHUNG S W, OH J H. Expression of insulin-like growth factor type 1 receptor and myosin heavy chain in rabbit's rotator cuff muscle after injection of adipose-derived stem cell[J]. Knee Surg Sports Traumatol Arthrosc, 2014, 22(11): 2867-2873.
[11] KNIPE D W, FRASER A, LAWLOR D A,. Is interpregnan-cy interval associated with cardiovascular risk factors in later life? A cohort study[J]. BMJ Open, 2014, 4(3): e4173.
[12] LEG F, GRIFONE R, MOURIKIS P,. Six1 regulates stem cell repair potential and self-renewal during skeletal muscle regeneration[J]. J Cell Biol, 2012, 198(5): 815-832.
[13] LIU T, MU H, SHEN Z,. Autologous adipose tissuederived mesenchymal stem cells are involved in rat liver regeneration following repeat partial hepatectomy[J]. Mol Med Rep, 2016, 13(3): 2053-2059.
[14] LIU Y, YAN X, SUN Z,. Flk-1+ adipose-derived mesenchymal stem cells differentiate into skeletal muscle satellite cells and ameliorate muscular dystrophy in mdx mice[J]. Stem Cells Dev, 2007, 16(5): 695-706.
[15] LO S C, REVERBERI D, BALBI C,. Mesenchymal Stem cell-derived extracellular vesicles as mediators of anti-Inflamma-tory effects: Endorsement of macrophage polarization[J]. Stem Cells Transl Med, 2017, 6(3): 1018-1028.
[16] PARK S, CHOI Y, JUNG N,. Myogenic differentiation potential of human tonsil-derived mesenchymal stem cells and their potential for use to promote skeletal muscle regeneration[J]. Int J Mol Med, 2016, 37(5): 1209-1220.
[17] PINHEIRO C H, DE QUEIROZ J C, GUIMARAES-FERREIRA L,. Local injections of adipose-derived mesenchymal stem cells modulate inflammation and increase angiogenesis ameliorat-ing the dystrophic phenotype in dystrophin-deficient skeletal muscle[J]. Stem Cell Rev, 2012, 8(2): 363-374.
[18] PUMBERGER M, QAZI T H, EHRENTRAUT M C,. Synthetic niche to modulate regenerative potential of MSCs and enhance skeletal muscle regeneration[J]. Biomaterials, 2016, 99: 95-108.
[19] ROSSI G, ANTONINI S, BONFANTI C,. Nfix regulates temporal progression of muscle regeneration through modulat-ion of myostatin expression[J]. Cell Rep, 2016, 14(9): 2238-2249.
[20] SECCO M, BUENO C J, VIEIRA N M,. Systemic delivery of human mesenchymal stromal cells combined with IGF-1 enhances muscle functional recovery in LAMA2 dy/2j dystrophic mice[J]. Stem Cell Rev, 2013, 9(1): 93-109.
[21] TIERNEY M T, AYDOGDU T, SALA D,. STAT3 signaling controls satellite cell expansion and skeletal muscle repair[J]. Nat Med, 2014, 20(10): 1182-1186.
[22] VALERO M C, HUNTSMAN H D, LIU J,. Eccentric exercise facilitates mesenchymal stem cell appearance in skeletal muscle[J]. PLoS One, 2012, 7(1): e29760.
[23] VU N B, LE HT, DAO T T,. Allogeneic adipose-derived mesenchymal stem cell transplantation enhances the expression of angiogenic factors in a mouse acute hindlimb ischemic model[J]. Adv Exp Med Biol, 2017.
[24] WITT R, WEIGAND A, BOOS A M,. Mesenchymal stem cells and myoblast differentiation under HGF and IGF-1 stimulation for 3D skeletal muscle tissue engineering[J]. BMC Cell Biol, 2017, 18(1): 15.
[25] XIAN L, WU X, PANG L,. Matrix IGF-1 maintains bone mass by activation of mTOR in mesenchymal stem cells[J]. Nat Med, 2012, 18(7): 1095-1101.
[26] ZANOU N, GAILLY P. Skeletal muscle hypertrophy and regeneration: interplay between the myogenic regulatory factors (MRFs) and insulin-like growth factors (IGFs) pathways[J]. Cell Mol Life Sci, 2013, 70(21): 4117-4130.
[27] ZOU K, DEL M, HUNTSMAN H D,. Laminin-111 improves skeletal muscle stem cell quantity and function following eccentric exercise[J]. Stem Cells Transl Med, 2014, 3(9): 1013-1022.
[28] ZOU K, HUNTSMAN H D, CARMEN V M,. Mesenchymal stem cells augment the adaptive response to eccentric exercise[J]. Med Sci Sports Exerc, 2015, 47(2): 315-325.
Effects of Allogeneic Adipose Mesenchymal Stem Cells Injected Intramuscularly on Skeletal Muscle Regulatory Factors in Rats after Eccentric Exercise
LIU Xiu-juan1, ZHANG Nian-yun1, SUN Biao1, WANG Bin1, XU Yan2
1. Nanjing Sports Institute, Nanjing 210014 China; 2. Nanjing Regenerative Medicine Engineering Technology Research Center, Nanjing 210000 China.
Objective: To observe the effect of allogeneic adipose mesenchymal stem cells (ASCs) on skeletal muscle growth factor in rats at different time points after a single eccentric exercise, and to investigate the mechanism of ASCs injection in repairing skeletal muscle injury after eccentric exercise. Methods: After a one-off eccentric exercise in 8-week-old male SD rats, normal saline was injected into the gastrocnemius muscle in the left leg, and ASCs were injected into the gastrocnemius muscle of the right leg. The rats were randomly divided into four groups: one day(D1), three days(D3), seven days(W1)and fourteen days(W2)after exercise. Skeletal muscle ultrastructure was observed by electron microscopic. The content of IGF1 and GDF8 in serum was determined, andskeletal muscle regulatory factors was determined. Results:Compared with group PBS, the structure of muscle fiber was improved obviously in group ASCs. Compared with group D1, the serum IGF1 and GDF8 contents in group W1 were significantly decreased (<0.05), the serum IGF1 and GDF8 content in group W2 was remarkably increased (<0.05). Compared with group PBS, the expression IGF1 mRNA in group ASCs were notably enhanced at time point W2 (<0.05), the expression of GDF8 mRNA were significantly decreased at time point D3 (<0.05) and which were extremely significantly down-regulated at time point W2 (<0.01). The expression of Atrogin1 mRNA were significantly decreased at time point D3 (<0.05) and which were extremely significantly down-regulated at time point W1 (<0.01). The expression of IGF1 mRNA in skeletal muscle showed significantly positive correlation with serum IGF1 content (<0.05) in group PBS, that of GDF8 mRNA had higher correlation with serum GDF8 content in group PBS (<0.01); and that of PCNA mRNA in skeletal muscle showed significant positive correlation with IGF1mRNA both in group PBS and in group ASCs (<0.05). Conclusion: After eccentric exercise, allogeneic adipose mesenchymal stem cells injected intramuscularly can increase the transcription of IGF1 and decreased the transcription of GDF8 and Atrogin1 in skeletal muscle. Allogeneic adipose mesenchymal stem cells injected intramuscularly may not affect the secretion of IGF1 and GDF8, but it may improve the regeneration and repair of skeletal muscle after eccentric exercise through affecting local gene expression.
1002-9826(2018)03-0079-08
10.16470/j.csst.201803010
G804.2
A
2018-01-02;
2018-03-18
江苏省高校自然科学基金资助项目(17KJB180008);江苏高校品牌专业建设工程资助项目(PPZY2015C255);江苏高校“青蓝工程”资助。
刘秀娟,女,副教授,博士,主要研究方向为运动锻炼的生物学基础,E-mail:lxjmqb2006@163.com。
