低氧训练通过HIF-1α - miR-122-5p-SREBP-1c调节肥胖大鼠肝脏脂代谢的机制研究
2018-06-06李传芬冯连世路瑛丽
荆 文,李传芬,冯连世,路瑛丽
低氧训练通过HIF-1α - miR-122-5p-SREBP-1c调节肥胖大鼠肝脏脂代谢的机制研究
荆 文1,李传芬2,冯连世3,路瑛丽3
1.山东师范大学 体育学院,山东 济南 250014;2.济南军区总医院 神经内科,山东 济南 250031;3.国家体育总局体育科学研究所,北京 100061
目的:探讨低氧训练对肥胖大鼠肝脏中miR-122-5p及其上下游调节因子在转录水平表达的影响,并在细胞中验证miR-122-5p的表达对下游脂代谢相关基因的调节。方法:雄性SD大鼠经10周高脂饮食诱导建立肥胖大鼠模型,适应性训练后随机分为常氧安静组(N组)和低氧训练组(H组)。4周后测量体重、体脂、血清脂类含量,利用实时荧光定量PCR检测肝脏中miR-122-5p及上下游调节因子转录水平的相对表达。将大鼠正常肝细胞BRL-3A分为未转染组(C组)、过表达miR-122-5p组(Up组)、抑制表达miR-122-5p组(Down组)和空载体组(Nc组),慢病毒转染建立稳定转染细胞系,利用实时荧光定量PCR检测miR-122-5p及下游脂代谢调节因子转录水平的相对表达。结果:与N组相比,H组大鼠体重、体脂显著降低(<0.01),血清脂类含量显著改善(<0.05或<0.01),肝脏miR-122-5p及C/EBPα、SREBP-1c、FASN、ACC1 mRNA的相对表达水平显著降低(<0.05或<0.01),HIF-1α、CPT1A mRNA的相对表达水平显著升高(<0.05或<0.01)。在BRL-3A细胞中过表达或抑制表达miR-122-5p,导致SREBP-1c、FASN、ACC1 mRNA相对表达水平显著升高或降低(<0.05或<0.01),CPT1A mRNA的相对表达水平显著降低或升高(<0.05或<0.01)。结论:低氧训练可能通过HIF-1α - miR-122-5p - SREBP-1c途径调节肥胖大鼠肝脏脂代谢,低氧训练诱导HIF-1α的表达升高,依次下调C/EBPα和miR-122-5p的表达,进而通过升高SREBP-1c、FASN、ACC1和降低CPT1A的表达,抑制肝脏中脂肪酸的合成,促进脂肪酸的氧化,改善肝脏脂类的代谢。
低氧训练;miR-122-5p;肥胖;肝脏;脂代谢
超重和肥胖是由脂肪过量堆积引起的健康损伤,是脂肪肝、糖尿病和心脑血管疾病等多种慢性病的主要危险因素。低碳高脂的膳食结构、久坐不动的生活方式使得越来越多的人罹患肥胖症,据2017年10月世界卫生组织报道[1],1975~2016年全球肥胖流行率增长近3倍。国家体育总局《2014年国民体质监测公报》显示,超重与肥胖问题已经成为影响我国成年、老年人群体质的突出问题[2],而肥胖会引起肝脏脂质代谢异常,导致肝脏损伤[14]。超重和肥胖人群常用急慢性低氧暴露来降低体重,但不同的被试、不同的低氧程度和暴露时间减重效果不同[15]。以往的研究证实,低氧训练能够显著降低肥胖人群的体重、体脂[3,6,14],改善血脂和肝脏脂类代谢[8,20]。
微小RNA(microRNA, miRNA)是一类仅有22 nt左右的内源性单链非编码RNA,一般位于基因与基因之间、基因的内含子或外显子区域,在进化上具有高度保守性[22],主要通过与其靶基因3´端非翻译区互补结合,引起靶基因mRNA降解或阻止其翻译[9]。miR-122是肝脏组织特异性miRNA,在肝脏中高表达,约占肝脏总miRNA的70%,参与肝脏脂质稳态的调节[17]。miR-122前体是由一条反向互补的单链形成的发夹结构,加工为成熟miR-122时,根据在前体中的位置分为两条,位于5’端的命名为miR-122-5p,而位于3’端的命名为miR-122-3p。miR-122在调节肝脏功能中发挥着重要的作用,有研究表明,miR-122能够调节胆固醇的生物合成[18]、脂肪酸合成和β-氧化[12]。
前期研究发现,低氧训练能显著降低肥胖大鼠肝脏中miR-122-5p的表达水平,但低氧训练通过miR-122-5p调节肝脏脂代谢的分子机制还未完全清楚。因此,本研究拟以miR-122-5p为核心,研究低氧训练对肥胖大鼠肝脏中miR-122-5p及其上游转录调节因子低氧诱导因子-1α(Hypoxia Inducible Factor-1α, HIF-1α)、CCAAT增强子结合蛋白α(CCAAT/enhancer binding proteinα,C/EBPα)、以及下游脂代谢调节因子固醇调节元件结合蛋白-1c(Sterol Regulatory Element Binding Protein-1c, SREBP-1c)、二脂酰甘油酰基转移酶2(Diacylgycerol Acyltransferase 2, DGAT2)、脂肪酸合成酶(Fatty Acid Synthetase, FASN)、乙酰辅酶A羧化酶1(Acetyl-CoA Carboxylase 1, ACC1)和肉毒碱棕榈酰基转移酶1A(Carnitine Palmitoyl Transferase 1 A, CPT1A)表达的影响,并在大鼠正常肝细胞BRL-3A中过表达和抑制表达miR-122-5p,验证miR-122-5p与其下游脂代谢相关基因表达的关系,探讨miR-122-5p在低氧训练中调节肝脏脂代谢的作用及机制,为低氧训练应用于降低体重和体脂,改善由肥胖引起的代谢疾病等提供一定的理论依据。
1 材料与方法
1.1 动物实验
1.1.1 实验动物及分组
50只21天龄离乳雄性SD大鼠(购自北京维通利华实验动物有限公司),普通饲料适应性喂养1周后,随机分为两组:普通饮食组10只,普通饲料(能量百分比:碳水化合物65%、脂肪15%、蛋白质20%)喂养;高脂饮食组40只,高脂饲料(能量百分比:碳水化合物35%、脂肪45%、蛋白质20%)喂养。分笼饲养,每笼5只,自由饮食,自然光照,室温保持22 ℃左右,湿度保持40%~60%。10周后,从高脂饮食组挑选体重大于普通饮食组平均体重20%的大鼠作为肥胖组,共21只。
1.1.2 运动方案设计
常氧环境下肥胖组大鼠水平跑台适应性训练5天(训练速度从20 m/min递增到25 m/min,运动时间从20 min/天递增到60 min/天)后,根据实验大鼠适应性训练情况,选取了16只大鼠随机分为2组:常氧安静组(N组)和低氧训练组(H组,氧气含量为13.6%),每组8只。H组用大鼠水平跑台进行耐力训练,训练强度20 m/min,持续运动1 h/天、5 天/周、共4周[20]。
1.1.3 取材
H组大鼠最后一次训练后恢复24 h,与N组一起取材。大鼠取材前禁食禁水12 h,称重,按0.3 mL/100 g体重的剂量腹腔注射10%水合三氯乙醛溶液麻醉大鼠,测量鼻尖至肛门的距离作为体长,计算Lee´s index=体重1/3(g)/体长(cm);将大鼠固定于取材板上,打开腹腔,腹主动脉取血,分离血清-20 ℃保存待测;取肝右叶液氮速冻,-80 ℃保存待测;取肾周和附睾脂肪,在预冷的生理盐水中漂洗去血,滤纸吸干水分,称重,计算脂肪重和脂体比(脂肪重/体重×100%)[4]。
1.1.4 血清脂类含量测定
利用全自动生化分析仪检测血清总胆固醇(Total Cholesterol, TC)、甘油三酯(Triglyceride, TG)、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol, LDL-C)和高密度脂蛋白胆固醇(HighDensity Lipoprotein Cholesterol, HDL-C)的含量。
1.1.5 实时荧光定量PCR
提取肝脏组织总RNA(动物组织总RNA提取试剂盒,Tiangen),琼脂糖凝胶电泳检查总RNA的质量,分别反转录合成miRNA和mRNA对应的cDNA(miRcute miRNA cDNA第一链合成试剂盒、TIANScript RT Kit,Tiangen),利用LightCycler480(Roche)进行实时荧光定量PCR反应(miRcute miRNA荧光定量检测试剂盒SYBR Green、Talent荧光定量检测试剂盒SYBR Green,Tiangen),分别以U6和β-actin作为内参检测肝脏中miR-122-5p的相对表达水平,以及HIF-1α、C/EBPα、SREBP-1c、DGAT2、FASN、ACC1和CPT1AmRNA的相对表达,反应条件为95℃预变性2 min,PCR反应(94℃、10s,60℃、40s)40个循环。利用=2-△△Ct计算相对表达量。实验所用引物由生工生物工程(上海)股份有限公司设计合成(表1)。
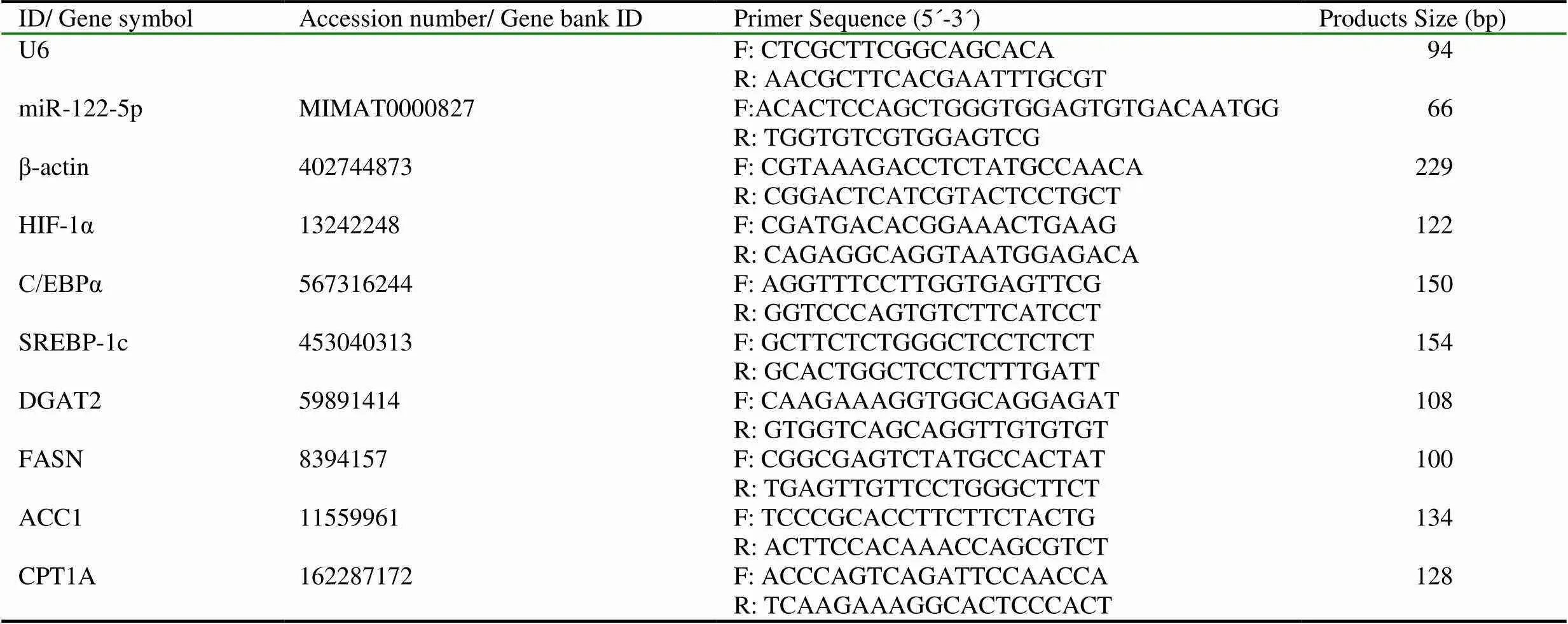
表1 实时荧光定量PCR引物
1.2 BRL-3A细胞实验
1.2.1 细胞株及慢病毒载体构建
大鼠正常肝细胞BRL-3A购于广州吉妮欧生物科技有限公司。miR-122-5p过表达和抑制表达慢病毒载体的构建和包装由上海吉凯基因化学技术有限公司完成,滴度分别为4×108TU/mL和6×108TU/mL。

图1 miR-122-5p过表达和抑制表达慢病毒载体
Figure 1. Overexpression or InhibitionExpression of miR-122-5p Lentivirus Vector
注:A为miR-122-5p过表达慢病毒载体,插入序列是通过化学合成的miR-122-5p前体。B为miR-122-5p抑制表达慢病毒载体,插入序列是miR-122-5p的互补序列。
1.2.2 建立稳定转染细胞系
1. 铺板:完全培养基调整BRL-3A细胞的密度为(3~5)×104个/mL,铺板在96孔板(100μL/孔),在CO2培养箱中37 ℃培养24 h,至细胞的密度达到20%~30%。
2. 感染:BRL-3A细胞分为4组:C组(control组,未转染慢病毒)、Up组(转染miR-122-5p过表达慢病毒)、Down组(转染miR-122-5p抑制表达慢病毒)、Nc组(negative control组,转染空载体慢病毒)。根据预实验确定MOI(multiplicity of infection)值为100,按公式(病毒体积=MOI×细胞数目/病毒滴度)计算加入病毒体积。
3. 培养:在CO2培养箱中37 ℃培养10 h后观察细胞情况,并更换为新鲜完全培养基。
4. 建立稳转细胞系:感染2~4天根据荧光观察感染效率,建立稳定感染细胞系(图2)。

图2 过表达和抑制表达miR-122-5p稳定转染细胞系的建立
Figure 2. Establishment of Stable Transfection Cell Line of Overexpression and InhibitionExpression of miR-122-5p
注:A、B、C、D分别为C组、Up组、Down组和Nc组明视野图,a、b、c、d分别为C组、Up组、Down组和Nc组荧光图,200×。
1.2.3 实时荧光定量PCR
将C组、Up组、Down组和Nc组细胞复苏,在CO2培养箱中37 ℃培养2~4天,至细胞密度达80%~90%。弃去原培养基,DMEM冲洗,Trizol法分别提取4组细胞总RNA,琼脂糖凝胶电泳检查总RNA质量,根据OD260的值计算RNA浓度(1OD=40μg/mL)。miR-122-5p的相对表达量检测和相关基因转录水平的相对表达量检测方法与动物实验一致。
1.3 数据统计
2 结果
2.1 低氧训练显著降低肥胖大鼠体重和体脂
H组比N组大鼠的体重、Lee’s index、脂肪重均极显著下降(<0.01),脂体比显著降低(<0.05,图3)。
Figure 3. Effects of Hypoxic Training on Morphological Indexes of Obese Rats
注:独立样本检验,*表示两组间有显著性差异(<0.05),**表示两组间有极显著性差异(<0.01),下同。
2.2 低氧训练显著改善肥胖大鼠血清脂类含量
低氧训练显著降低肥胖大鼠血清TC、TG、LDL-C含量(<0.05或<0.01),显著升高HDL-C含量(<0.05,图4)。

图4 低氧训练对肥胖大鼠血脂含量的影响
Figure 4. Effects of Hypoxic Training on Serum Lipids Concentration of Obese Rats
2.3 低氧训练对肥胖大鼠肝脏miR-122-5p及脂代谢相关调节因子转录水平的影响
低氧训练显著下调了miR-122-5p及C/EBPα、SREBP-1c、FASN、ACC1 mRNA相对表达水平,显著上调了HIF-1α、CPT1α mRNA的相对表达水平(<0.05或<0.01),DGAT2表达下调但无显著差异(>0.05,图5)。
2.4 miR-122-5p过表达和抑制表达对BRL-3A细胞脂代谢相关调节因子转录水平的影响
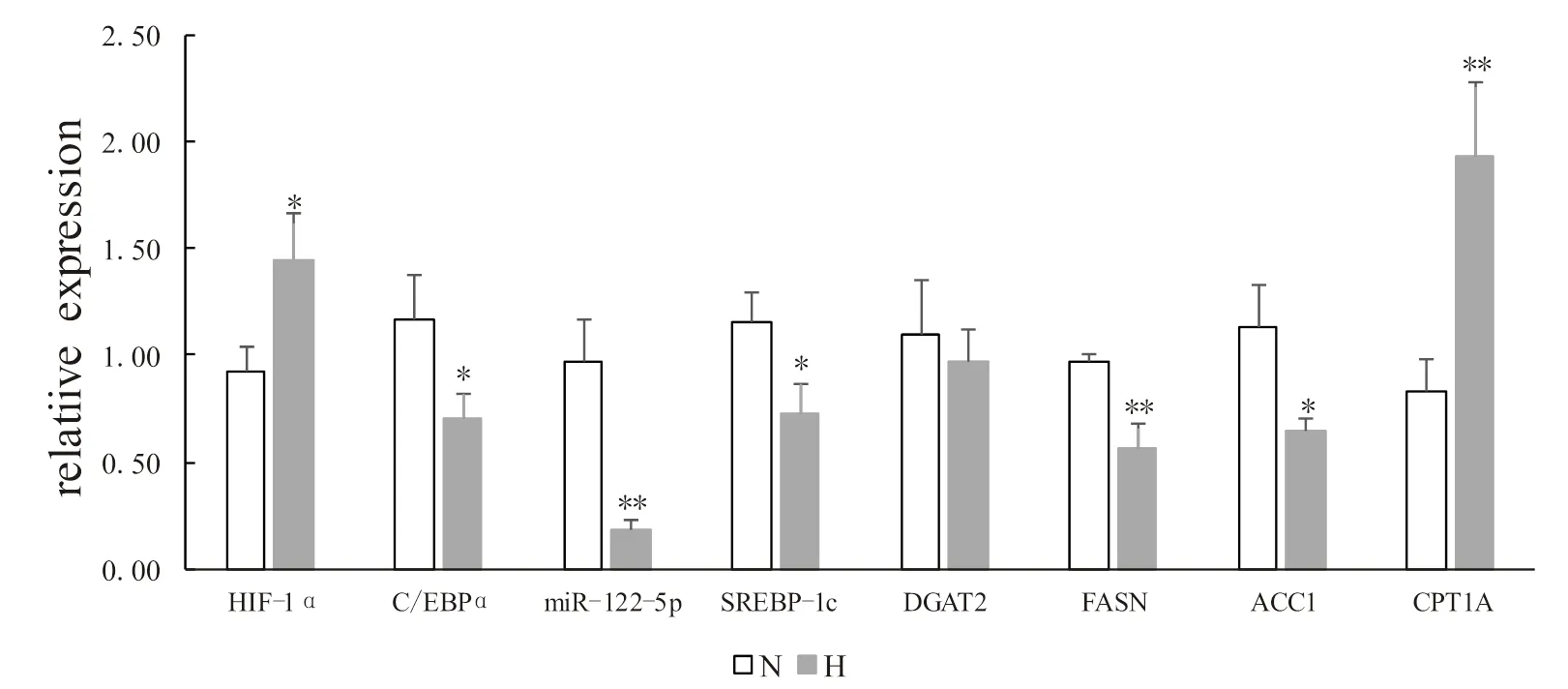
图5 低氧训练对miR-122-5p及脂代谢相关调节因子转录水平的影响
Figure5. Effects of HypoxicTraining on Transcription Level of miR-122-5p and Lipid Metabolism Related Regulators
与C组相比,Up组miR-122-5p相对表达水平极显著升高(<0.01),Down组极显著降低(<0.01),Nc组无显著变化(>0.05,图6)。
与C组相比,Up组SREBP-1c、FASN、ACC1 mRNA相对表达水平显著升高(<0.05或<0.01),CPT1A mRNA相对表达水平显著降低(<0.05);Down组SREBP-1c、FASN、ACC1 mRNA相对表达水平显著降低(<0.05或<0.01),CPT1A mRNA相对表达水平显著升高(<0.01);Nc组各调节因子转录水平均无显著变化(>0.05);DGAT2在Up组和Down组分别表现出升高和降低的趋势,但无显著差异(>0.05,图6)。

图6 BRL-3A细胞中miR-122-5p及脂代谢相关调节因子转录水平的相对表达
Figure6. Relative Expression of miR-122-5p and Lipid MetabolismRelated Regulatory Factors in BRL-3A Cells
注:单因素方差分析,*表示该组与C组相比有显著性差异(<0.05),**表示该组与C组相比有极显著性差异(<0.01)。
3 分析与讨论
3.1 低氧训练刺激肥胖大鼠肝脏HIF-1α表达升高
肥胖及由其引起的慢性相关疾病已严重威胁人类健康,低氧训练是降低体重和体脂[5,6]、改善血脂含量、调节肝脏脂代谢的有效方法[8,11,16,20]。低氧训练会引起机体血液重新分配,使肝脏处于相对缺血缺氧状态,HIF-1α是对氧气敏感的转录因子,调控低氧诱导基因的表达,协调细胞对低氧环境的反应。有研究表明,游离脂肪酸产生的脂肪毒性是导致非酒精性脂肪性肝炎的重要病理机制,上调HIF-1α是降低非酒精性脂肪肝的一种可能策略[25]。而低氧训练能显著上调肥胖大鼠肝脏中HIF-1αmRNA的表达水平,表明机体为应对低氧和训练的双重刺激,产生了深刻的适应性反应[7],HIF-1αmRNA的表达与本研究结果一致,提示低氧训练可能通过上调HIF-1α的表达应对肝脏低氧的刺激,降低脂质对肝脏的损伤。
3.2 高表达HIF-1α下调了其下游效应因子C/EBPα的表达
低氧训练上调肝脏中HIF-1αmRNA的表达水平,引起C/EBPα的表达水平下降。研究表明,缺氧使膀胱癌细胞高表达HIF-1α蛋白,导致C/EBPα的mRNA和蛋白表达降低;而抑制HIF-1α的表达可以增强C/EBPα的表达,提示C/EBPα可能是HIF-1α的下游效应因子[26],本研究结果进一步证明高表达的HIF-1α下调了C/EBPα的表达。
3.3 低氧训练引起的C/EBPα表达水平的降低可能是miR-122-5p表达下降的主要原因
表达下调的C/EBPα可能会导致肝脏miR-122-5p的表达降低。有研究表明,miR-122启动子区含有C/EBPα的多个结合位点,能在体内外互相结合,抑制C/EBPα的表达,能显著降低miR-122的启动子活性,减少内源性miR-122的表达水平[27]。白介素-6和肿瘤坏死因子-α通过下调转录因子C/EBPα,而阻断C/EBPα介导miR-122的转录,抑制miR-122的表达[19],该研究进一步证明了C/EBPα对miR-122表达的调节作用。
3.4 miR-122-5p通过调节SREBP-1c的表达影响脂肪酸和胆固醇的代谢
本研究中低氧训练导致肥胖大鼠肝脏中miR-122-5p的表达降低可能是低氧训练调节肝脏脂代谢的重要途径。miR-122是肝脏中含量最多的miRNA,已有研究证明,miR-122在调节血浆胆固醇[18]和肝脏脂类代谢中发挥重要作用。在正常小鼠中抑制miR-122的表达,导致血浆胆固醇含量显著降低,肝脏脂肪酸和胆固醇合成速率显著下调,增加肝脏脂肪酸氧化。在饮食诱导的小鼠肥胖模型中,下调miR-122的表达水平,同样能显著降低血浆胆固醇含量,减少脂肪的生成,改善肝脏脂肪变性[13]。
SREBP是体内胆固醇和脂肪酸代谢的重要核转录调节因子,存在3种异构体:SREBP-1a、1c和2[10],肝脏和脂肪细胞中高表达SREBP-1c,而SREBP-1a、1c与脂肪酸代谢相关酶的表达相关[24],SREBP-1c可以通过影响FASN和ACC1的表达对机体脂肪合成进行调节,3周低氧训练能够较好的抑制肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达[5],从而通过改变SREBP-1c的表达调节脂肪酸的代谢。
低氧训练可能通过下调肝脏中miR-122-5p的表达水平间接抑制SREBP-1c的表达,发挥减少肝脏脂肪酸合成的作用。在体内抑制miR-122的功能可降低血清胆固醇和脂肪酸水平。体外抑制miR-122的表达,使细胞因子信号抑制因子3(suppressor of cytokine signaling 3, SOCS3)表达降低时,SREBP1表达下调;在抑制miR-122表达的细胞中过表达SOCS3,可使SREBP1的表达恢复,表明miR-122通过改变SOCS3的表达间接调节SREBP1的表达[23]。也有研究证明,抑制miR-122的表达可以降低SREBP1和SREBP2的水平[21],miR-122和SREBP-1c之间有相互促进作用[28]。
综上所述,低氧训练引起的缺氧刺激上调了肝脏HIF-1α的表达水平,而C/EBPα是HIF-1α的下游效应因子,高表达的HIF-1α降低了C/EBPα的表达;C/EBPα与miR-122-5p具有共表达的特点,低表达的C/EBPα抑制了miR-122-5p的表达;下调的miR-122-5p通过降低SREBP-1c、FASN、ACC1的表达,升高CPT1A的表达,调节肝脏中脂肪酸的合成与氧化。因此,HIF-1α-miR-122-5p-SREBP-1c途径可能在低氧训练调节肥胖大鼠肝脏脂类代谢过程中发挥重要作用。
4 结论
低氧训练可以有效地降低肥胖大鼠体重和体脂,改善血清脂类含量,调节肝脏中脂类的代谢。低氧训练可能通过HIF-1α-miR-122-5p-SREBP-1c途径调节肝脏脂代谢。低氧训练上调肝脏HIF-1α的表达水平,降低C/EBPα的表达,抑制miR-122-5p的表达,间接引起SREBP-1c、FASN、ACC1的表达降低,上调了CPT1A的表达,导致肝脏中脂肪酸合成减少,脂肪酸氧化增加,减弱肝脏遭受脂质的损伤,起到保护肝脏的作用。
[1] 肥胖和超重[EB/OL].http://www.who.int/mediacentre/factsheets/ fs311/ zh/.
[2] 2014年国民体质监测公报 [EB/OL]. http://www. sport.gov.cn/ n16/n1077/ n1227/7328132.html.
[3] 冯连世, 张漓, 高炳宏, 等. 不同环境下有氧运动对超重和肥胖青少年体重与体脂含量的影响[J]. 体育科学, 2013, 33(11): 58-65.
[4] 荆文. 低氧训练对高脂饮食大鼠肝脏microRNA表达及脂代谢的调节研究[D]. 上海: 上海体育学院, 2014: 27.
[5] 王金昊, 路瑛丽, 冯连世, 等. 高住高练对肥胖大鼠肝脏SREBP-1c表达的影响[J].中国运动医学杂志, 2012, 31(07): 590-595,622.
[6] 王茹, 苏利强, 杨钦, 等. 低氧训练对肥胖青少年减控体重的影响与血镁浓度相关[J]. 体育科学, 2016, 36(9): 28-35,47.
[7] 徐建方, 冯连世, 路瑛丽, 等. 不同模式低氧耐力训练对大鼠肝组织HIF-1α、HO-1 mRNA 表达的影响[J]. 中国体育科技, 2011, 47(1): 126-129.
[8] 朱磊,路瑛丽, 冯连世. 低氧训练诱导miR-27/PPARγ调控肥胖大鼠肝脏脂肪酸代谢变化的研究[J]. 中国体育科技, 2018, 54(1): 115-122.
[9] AMBROS V. The functions of animal microRNAs [J]. Nature, 2004, 431(7006): 350–355.
[10]BROWN M S, GOLDSTEIN J L. The SREBP pathway: regulat-ion of cholesterol metabolism by proteolysis of membrane-bound transcription factor [J]. Cell, 1997, 89 (3): 331-340.
[11]CAMACHO-CARDENOSA A,CAMACHO-CARDENOSA M, BURTSCHER M,. High-intensity interval training in normo baric hypoxia leads to greater body fat loss in overweight/ obese women than high-intensity interval training in normoxia [J]. Front Physiol, 2018, 9: 60.
[12]ELHANATI S, BEN-HAMO R, KANFI Y,. Reciprocal regulation between SIRT6 and miR-122 controls liver metabol-ism and predicts hepatocarcinoma prognosis [J]. Cell Rep, 2016, 14(2): 234-242.
[13]ESAU C, DAVIS S, MURRAY S F,. miR-122 regulation of lipid metabolism revealed by in vivo antisense targeting [J]. Cell Metab, 2006, 3(2): 87–98.
[14]GOODMAN Z D. The impact of obesity on liver histology [J]. Clin Liver Dis, 2014, 18(1): 33-40.
[15]HOBBINS L, HUNTER S, GAOUA N,. Normobaric hypoxic conditioning to maximize weight loss and ameliorate cardio-metabolic health in obese populations: a systematic review [J]. Am J Physiol Regul Integr Comp Physiol, 2017, 313(3): R251-R264.
[16]HORTON J D, SHIMANO H. Disruption of LDL receptor gene in transgenic SREBP-1a mice unmasks hyperlipidemia resulting from production of lipid-rich VLDL [J]. J Clin Invest, 1999, 103 (7): 1067-1076.
[17]JOPLING C. Liver-specific microRNA-122: Biogenesis and function [J]. RNA Biol, 2012, 9: 137–142.
[18]Krützfeldt J, RAJEWSKY N, BRAICH R,. Silencing of micro RNAs in vivo with ‘antagomirs’ [J]. Nature, 2005, 438 (7068): 685–689.
[19]LI C, DENG M, HU J,. Chronic inflammation contributes to the development of hepatocellular carcinoma by decreasing miR-122 levels [J]. Oncotarget, 2016, 7(13): 17021-17034.
[20]LU Y L, JING W, FENG L S,. Effects of hypoxic exercise training on microRNA expression and lipid metabolism in obese rat livers [J]. J Zhejiang Univ Sci B, 2014, 15(9): 820-829.
[21]MENON B, SINDEN J, FRANZO-ROMAIN M,. Regulation of LH receptor mRNA binding protein by miR-122 in rat ovaries [J]. Endocrinology, 2013,154(12): 4826–4834.
[22]RODRIGUEZ A, Griffiths J S, Ashurst J L,. Identification of mammalian miRNA host genes and transcription units [J]. Genome Res, 2004, 14 (10A):1902-1910.
[23]Shibata C, Kishikawa T, Otsuka M,. Inhibition of microRNA122 decreases SREBP1 expression by modulating suppressor of cytokine signaling 3 expression [J]. Biochem Biophys Res Commun, 2013, 438(1): 230-235.
[24]Yang Q, Huang G, Tian Q,. "Living High-Training Low" improved weight loss and glucagon-like peptide-1 level in a 4-week weight loss program in adolescents with obesity: A pilot study [J]. Medicine (Baltimore), 2018, 97(8): e9943.
[25]Yoo W, Noh K H, Ahn J H,. HIF-1α expression as a protective strategy of HepG2 cells against fatty acid-induced toxicity [J]. J Cell Biochem, 2014, 115(6):1147-1158.
[26]Xue M, Li X, Chen W. Hypoxia regulates the expression and localization of CCAAT/enhancer binding protein α by hypoxia inducible factor-1α in bladder transitional carcinoma cells [J]. Mol Med Rep, 2015, 12(2): 2121-2127.
[27]Zeng C, Wang R, Li D,. A novel GSK-3 beta-C/EBP alpha-miR-122-insulin-like growth factor 1 receptor regulatory circuitry in human hepatocellular carcinoma [J]. Hepatology, 2010, 52(5):1702-1712.
[28]Zhai X, Cheng F, Ji L,. Leptin reduces microRNA-122 level in hepatic stellate cells in vitro and in vivo [J]. Mol Immunol, 2017, 92: 68-75.
The Mechanism of Hypoxic Training RegulatingLipid Metabolism by HIF-1α - miR-122-5p - SREBP-1c in Obese Rat Liver
JING Wen1, LI Chuan-fen2, FENG Lian-shi3, LU Ying-li3
1. Shandong Normal University, Jinan 250014, China; 2. Jinan Military General Hospital, Jinan 250031, China; 3. China Institute of Sport Science, Beijing 100061, China.
Objective: To investigate the effects of hypoxic training on the expression of miR-122-5p and the transcriptional levels of lipid metabolism regulatory factors in the liver of obese rats, and to verify the role of miR-122-5p on the expression of lipid metabolism related genes in vitro, to investigate the mechanism of miR-122-5p in regulating liver lipid metabolism during hypoxic training. Methods: Male Sprague-Dawley (SD) rats were induced to establish obese rat model by high-fat diet for 10 weeks. After adaptive training, obese rats were randomly divided into two groups: normoxic sedentary group (N group) and hypoxic training group (H group). 4 weeks later, body weight, body fat and serum lipid content of rats were measured, and the relative expression of miR-122-5p and transcription level of lipid metabolism important regulatory factors in liver were detected by real-time quantitative PCR. The BRL-3A cells were divided into four groups: untransfected group (C group), overexpression miR-122-5p group (Up group), suppressive expression miR-122-5p group (Down group) and empty vector group (Nc group). The cells were transfected with lentivirus to establish stable transfection cell lines. Real-time quantitative PCR was used to detect the relative expression levels of miR-122-5p and lipid metabolism regulating factors. Results: Compared with N group, the body weight and body fat of rats in H group decreased significantly (<0.01), and the serum lipid concentration significantly improved (<0.05 or<0.01). The relative expression levels of miR-122-5p and C/EBPα, SREBP-1c, FASN, ACC1 mRNA were significantly down-regulated (<0.05 or<0.01), and the relative expression levels of HIF-1α and CPT1A mRNA were significantly up-regulated (<0.05 or<0.01) in H group. Overexpression or inhibition of miR-122-5p in BRL-3A cell resulted in a significant increase or decrease in the relative expression levels of SREBP-1c, FASN, ACC1 mRNA (<0.05 or<0.01), while the relative expression level of CPT1A mRNA was significantly decreased or increased (<0.05 or<0.01). Conclusions: Hypoxic training may regulate lipid metabolism by HIF-1α - miR-122-5p - SREBP-1c in obese rat liver. Hypoxic training increased the expression of HIF-1α in the liver of obese rats, and down-regulated the expression of C/EBPα and miR-122-5p in turn, then inhibited the synthesis of fatty acids by decreasing the expression of SREBP-1c, FASN and ACC1, and promoted the oxidation of fatty acids by increasing the expression of CPT1A, to play a role in regulating lipid metabolism in the liver.
1002-9826(2018)03-0060-08
10.16470/j.csst.201803008
G804.7
A
2018-03-12;
2018-05-08
国家自然科学基金资助项目(31471139);山东省自然科学基金青年基金资助项目(ZR2014CQ026)。
荆文,男,讲师,博士,主要研究方向为低氧训练对脂代谢的调节机制,E-mail:jingwenjw@163.com。
冯连世,男,研究员,博士生导师,主要研究方向为高原训练与低氧训练的理论与方法、运动员控体重的理论与方法, E-mail:fengls98@126.com。
