燃烧合成氧空位型BiOCl及其可见光催化活性综合实验设计
2018-06-05刘瑞红李义磊李发堂
刘瑞红, 李义磊, 李发堂
(河北科技大学 理学院, 河北 石家庄 050021)
2006年Zhang等人[1]报道了BiOCl具有比P25二氧化钛更加优异的光催化活性,原因在于其具有独特的层状结构和间接电子跃迁模式,光生电子-空穴的分离效率较高。同时,BiOCl也因其价格低廉、容易制备等优点而在近10余年来吸引了人们越来越多的关注和研究,已成为极具发展前景的光催化剂之一[2]。但是,BiOCl禁带宽度约在3.2~3.4 eV左右,只能吸收紫外光,限制了其对太阳光的有效利用。而且单一催化剂本身电子-空穴容易复合。因此半导体复合[3]、元素掺杂[4]等技术被应用于修饰BiOCl,以提升电子-空穴对的分离效率或降低禁带宽度。
近年来,空位研究在光催化领域得到了广泛重视[5]。如氧空位不仅可以作为缺陷位捕获光生电子,也能够降低半导体的禁带宽度。传统构建空位的方法有真空或通N2等气氛下进行热处理等方法,但是容易导致材料团聚,降低催化能力。溶液燃烧合成可以通过选择燃料构建还原气氛以使材料中氧原子逸出而设计合成具有氧空位的材料,具有一步合成的优势[6]。
本课题组前期研究发现以二乙胺盐酸盐为燃料可以构建具有表面氧空位的BiOCl,但没有考察燃料用量等因素对氧空位量及光催化活性的影响[7]。本文考虑到溶液燃烧合成是一项简便易行的技术,所需设备简单、耗时短[8-9],适合学生实验室操作,因而设计了本综合实验。
1 实验试剂与仪器
试剂:Bi(NO3)3·5H2O,二乙胺盐酸盐(C4H11N·HCl),均为分析纯,购自国药集团,无需纯化直接使用。
仪器:电炉,氙灯光源(纽比特HSX-F300),X射线粉末衍射仪(Rigaku D/MAX 2500 ),透射电镜(JEOL JEM-2010 ),紫外可见分光光度计(Thermo Scientific Evolution 220),
2 实验方法
2.1 样品制备
用烧杯称取0.050 mol的Bi(NO3)3·5H2O以及0.005 0~0.008 0 mol的C4H11N·HCl,置于电炉上加热,形成离子液体。以两种原料物质的量之比1∶1为例,其离子液体形成反应如下:
Bi(NO3)3·5H2O+C4H11N·HCl=
[Bi(NO3)3Cl]-+ [C4H11N·H]++ 5H2O
(1)
继续加热,该离子液体发生氧化还原反应,燃烧放热,即可得BiOCl材料。二乙胺盐酸盐加入量不同时的燃烧反应(所得样品编号见表1):
Bi(NO3)3·5H2O+C4H11N·HCl+3O2=
BiOCl+4CO2+2N2+11H2O
(2)
Bi(NO3)3·5H2O+1.2C4H11N·HCl+4.35O2=
BiOCl+4.8CO2+2.1N2+12.1H2O+0.2HCl
(3)
Bi(NO3)3·5H2O+1.4C4H11N·HCl+5.7O2=
BiOCl+5.6CO2+2.2N2+13.2H2O+0.4HCl
(4)
Bi(NO3)3·5H2O+1.6C4H11N·HCl+7.05O2=
BiOCl+6.4CO2+2.3N2+14.3H2O+0.6HCl
(5)
由以上方程式可见,随着二乙胺盐酸盐用量的增多,反应所需氧气量增大。

表1 样品编号及降解RhB动力学方程
2.2 样品表征
以X射线衍射仪(XRD)测定样品组成,以扫描电镜(SEM)和高倍透射电镜(HRTEM)观测样品颗粒形貌及鉴定物相,以紫外-可见分光光度计表征样品光吸收性能(UV-vis DRS)。
2.3 光催化实验
取100 mL、质量浓度为10 mg/L的罗丹明B(RhB)溶液,加入0.1 g样品,暗处预吸附10 min达到吸附平衡后再进行光催化反应。反应以300 W氙灯为光源,以400 nm滤光片滤掉波长在400 nm以下的紫外光,以保证体系在可见光下进行,光照一定时间后取样离心分离,取上层清液在552 nm波长处测吸光度,以C0/C计算RhB的降解率(C0为初始浓度,C为光照度浓度)。
3 结果与讨论
3.1 物相鉴定及空位观察
图1为硝酸铋与不同量二乙胺盐酸盐燃烧反应时合成样品XRD图谱。由图1可见,4个样品的所有衍射峰均与JCPDS No.01-082-0485 BiOCl的特征峰一致,无Bi2O3等其他可能的杂质峰出现,表明此燃烧条件可以保证BiOCl纯相的生成。但是有2个现象值得注意,一是燃料用量最多的BiOCl-4样品衍射峰强度明显偏低,表明其BiOCl粒径较小。一般来讲,燃料量越高、燃烧温度越高,所得样品容易团聚,造成粒径偏大。本实验中此现象的出现应该是由于燃料量过高,如式(5)所示,所需氧气量过多,而燃烧环境中提供不了,因而易使燃料不完全燃烧,燃烧温度反而降低;另外,(001)和(101)是BiOCl的2个主要晶面,而由图1可见,随燃料量的增加,(001)晶面强度明显增强,到BiOCl-4又减弱,表明适当的二乙胺盐酸盐能够诱导(001)晶面的生长。
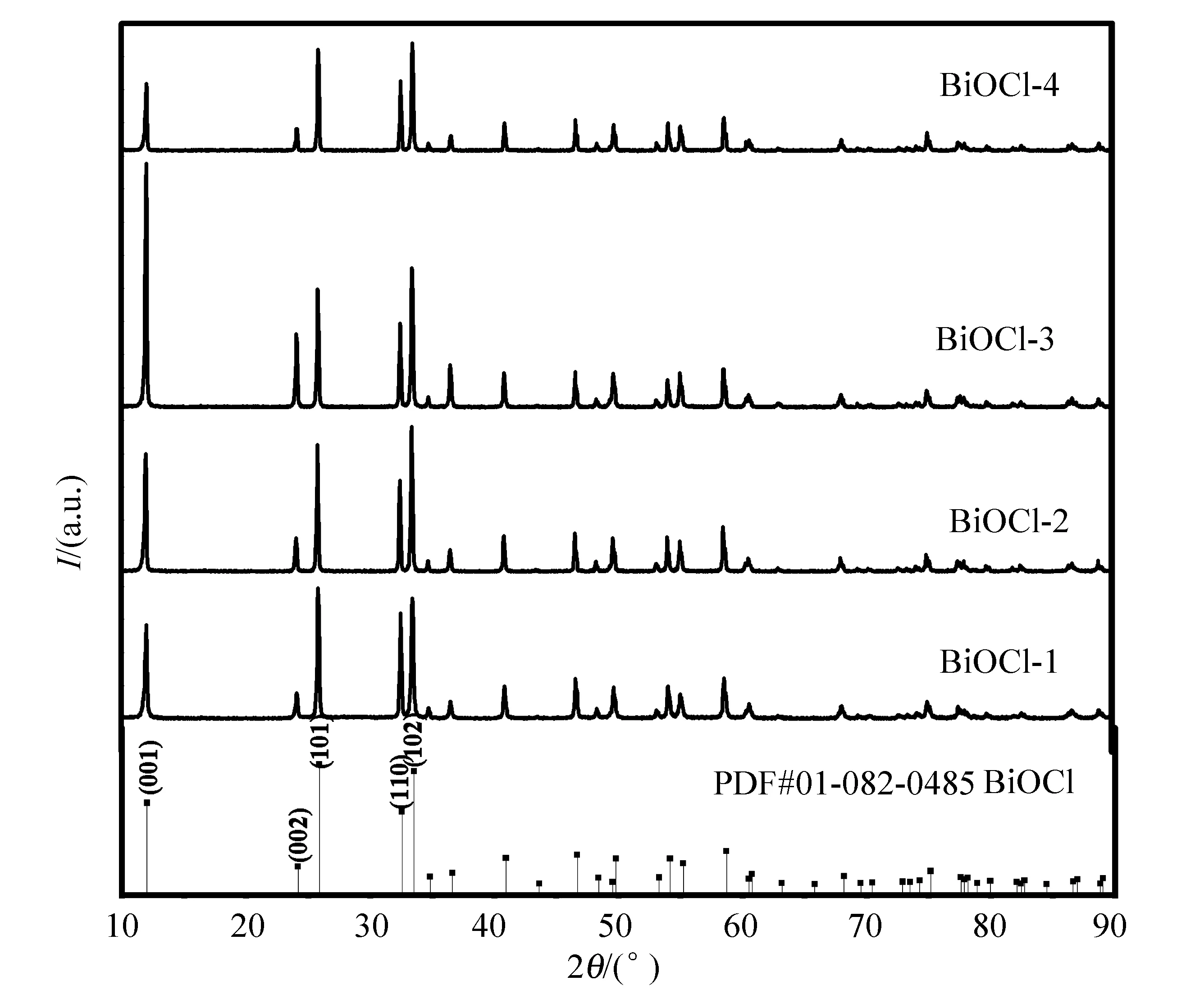
图1 不同燃料量时的样品XRD图谱
不同样品的(001)与(101)晶面的衍射峰强度如图2所示,来自JCPDS No.01-082-0485 标准BiOCl的强度比为0.677,而本实验合成的BiOCl-3其(001)与(101)晶面强度比可达2.07。而高暴露的(001)晶面更有利于电子的传递和分离[10],因此本实验合成的样品有利于光催化活性的提高。

图2 不同样品的(001)/(101)晶面强度比
由式(1)—(4)可知,燃料量增加使得反应所需氧气用量增加,XRD也表明氧气量不充分时也会造成燃料不完全燃烧。另外,燃烧环境为氧分压不足的还原气氛时,BiOCl表面上的氧原子也容易逸出而形成表面氧空位。图3为BiOCl-1和BiOCl-3样品的高倍透射电镜(HRTEM)图谱。由图首先可见,2个样品的晶格条纹间距均为0.268nm,与BiOCl的(102)晶面一致,进一步验证了所合成物相为BiOCl。另外,样品BiOCl-1的表面基本上都有明显的晶格条纹,证明结晶比较完整;而BiOCl-3表面却含有无晶格条纹、呈絮状物质的区域,这就是由于氧原子逸出而造成的晶体不完整的表现,证明了氧空位的形成。

图3 样品的HRTEM图谱
3.2 光学吸收能力
不同样品的紫外可见漫反射光谱见图4。由式(6)可计算禁带宽度[11]:
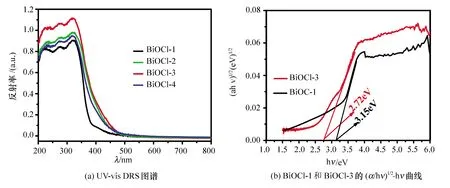
图4 样品的UV-vis DRS图谱及样品BiOCl-1和BiOCl-3的(αhν)1/2-hν曲线
(6)
式中,α为吸光率,h为普朗克常数,ν为频率,A为系数。
由于BiOCl为间接跃迁半导体,此处n=4。将图4(a)中代表性的BiOCl-1和BiOCl-3样品数据用上述公式处理后结果如图4(b)所示,结果表明,无氧空位的BiOCl-1样品的禁带宽度为3.15 eV,而具有氧空位的BiOCl-3的禁带宽度却降低到了2.72 eV,表明其具有了可见光吸收能力,更加有利于对太阳光的充分利用。
3.3 光催化活性及其动力学
实验表明,BiOCl催化剂对RhB吸附10 min即可达到平衡,表明其有较快的吸附能力。吸附平衡后,打开光源,RhB光催化降解结果如图5所示(图中t为反应时间)。

图5 不同样品降解RhB实验结果
由图5可见,无催化剂时,10 min光照下RhB自身降解率仅为3.2%,表明RhB自身比较稳定。4个样品中,BiOCl-1虽然仅对紫外光有吸收,但由实验结果可见其对RhB也具有一定的光脱色效果,这是由于RhB的光敏作用导致的。另外,BiOCl-3表现出最好的催化活性,反应10 min降解率达到96.0%。
低浓度污染物的光降解一般都符合表观一级动力学方程[12]:
ln(C0/C)=kt+ln(C0/C1)
(7)
式中,C0、C1及C分别表示RhB的初始浓度(C0=10 mg/L)、达到吸附平衡后浓度及光照后浓度,k为表观反应速率常数(min-1)。ln(C0/C1)代表了催化剂对染料的吸附能力。
将图4数据进行处理、拟合后(一级动力学曲线截距强制过ln(C0/C1)),所得表观一级动力学图及方程式分别列于图6及表1。由表1可知,BiOCl-3样品的一级动力学反应速率常数为0.233 min-1,是样品BiOCl-1(0.063 min-1)的3.7倍,表明本步燃烧构建氧空位及暴露高活性(001)晶面的方法可以有效提高BiOCl的光催化活性。

图6 RhB降解的ln(C0/C)-t动力学图示
4 结语
本实验利用离子液体自燃烧合成了含有表面氧空位及(001)高活性晶面暴露的BiOCl材料,氧空位的形成使其禁带宽度由3.15 eV降低到2.72 eV,高活性晶面暴露使得光生电子能够更有效地迁移并分离。燃烧合成是一种节能、节约时间且无需复杂设备的绿色合成工艺,适合开设为学生实验;且燃烧合成及氧空位和光催化的概念融合了化学、材料、环境等多学科的相关知识。有利于学生综合能力的提高和创新意识的培养。
参考文献(References)
[1] Zhang K L, Liu C M, Huang F Q, et al. Study of the electronic structure and photocatalytic activity of the BiOCl photocatalyst[J]. Appl Catal B, 2006, 68:125-129.
[2] Ye L Q, Su, Y R, Jin X L, et al. Recent advances in BiOX(X = Cl, Br and I) photocatalysts: synthesis, modification, facet effects and mechanisms[J]. Environ Sci-Nano, 2014, 1:90-112.
[3] 杨冰叶,李航,商宁昭,等. 中空花状可见光响应催化剂g-C3N4@BiOCl的制备及其光催化活性[J].无机化学学报, 2017,3(33):96-404.
[4] 谢芳霞,毛晓明,李瑞,等. 无机阳离子对BiOCl光催化降解罗丹明B活性的影响[J].人工晶体学报,2015,2(44):401-408.
[5] 龙明策,郑龙辉. 用于太阳光催化反应的空位工程(英文)[J].催化学报,2017,38(4):617-624.
[6] Li F T, Ran J R, Jaroniec M, et al.Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion[J]. Nanoscale, 2015,7:17590-17610.
[7] Li F T, Li Y L, Chai M J, et al.One-step construction of {001} facet-exposed BiOCl hybridized with Al2O3for enhanced molecular oxygen activation[J]. Catal Sci Technol, 2016, 6:7985-7995.
[8] 宿新泰,燕青芝,葛昌纯.低温燃烧合成超细陶瓷微粉的最新研究[J].化学进展,2005,17(3):430-436.
[9] 李发堂,李义磊,刘瑞红. 纳米ZnFe2O4快速燃烧合成及其光催化活性综合实验设计[J].实验技术与管理,2016,33(5):28-31.
[10] Dandapat A, Gnayem H, Sasson Y. The fabrication of BiOClxBr1-x/alumina composite films with highly exposed {001} facets and their superior photocatalytic activities[J]. Chem Commun, 2016,52:2161-2164.
[11] Malwal D, Gopinath P. Enhanced photocatalytic activity of hierarchical three dimensional metal oxide@CuO nanostructures towards the degradation of Congo red dye under solar radiation[J]. Cataly Sci Technol, 2016,6:4458-4472.
[12] Li F T, Zhao Y, Hao Y J, et al. N-doped P25 TiO2-amorphous Al2O3composites: One-step solution combustion preparation and enhanced visible-light photocatalytic activity[J].J Hazard Mater, 2012, 239/240:118-127.
