原发性高血压患者盐摄入量与血压变异性的关系
2018-06-05张新军
余 谦,张新军
(四川大学华西医院老年病科,四川 成都 610041)
原发性高血压通过遗传与环境的相互作用而发病,而钠盐作为重要的环境因素,在高血压发病机制有着重要作用。钠盐摄入过多不仅能够使血压升高,还会抵抗降压药物的治疗效果[1]。目前研究认为 24 小时尿钠测定是衡量个体日常钠盐摄入量的最好方法[2]。血压变异性(blood pressure variability,BPV)是用来体现个体在一定时间内血压波动程度的指标,是可以定量评价心血管自主神经活动的无创指标,有研究表明 BPV 是心脑血管疾病预后的较强预测因子[3~5],是外部环境刺激与心血管控制机制之间相互复杂作用的结果,具体机制尚未明确[6],动态血压监测(ambulatory blood pressure monitoring,ABPM)已经普遍用于观察血压的变化,是临床上最常用于评估 BPV 的方法[7~9],24 h ABPM与靶器官损害及预后密切相关[10~12]。目前钠盐摄入量与BPV的关系研究较少,故本文通过研究盐摄入量与血压变异性的关系,为控制血压变异提供参考依据。
1 资料与方法
1.1一般资料选取2017年1~7 月本院门诊及住院首诊的原发性高血压患者 108 例,其中男53例,女55 例。年龄18~80岁 [(53.11±14.11)岁]。符合 2010 年《中国高血压防治指南》的定义的高血压诊断标准。均为首次诊断出高血压,并且未经药物治疗。排除继发性高血压、糖尿病、甲状腺疾病、急慢性感染、严重肝肾功能损害、严重心脑血管疾病、恶性肿瘤、妊娠期或哺乳期女性。本组患者摄盐量范围3.4~25.4 g/d,根据摄盐量的三分位数将入选人群分为三组,分别为低盐组(3.4~9.4 g/d)、中盐组(9.5~14.9 g/d)、高盐组(15.1~25.4 g/d)。三组患者的性别、年龄、身高、体重、BMI、TC、TG、HDL-C、LDL-C、Glu和HbAc差异均无统计学意义(P> 0.05)。见表1。
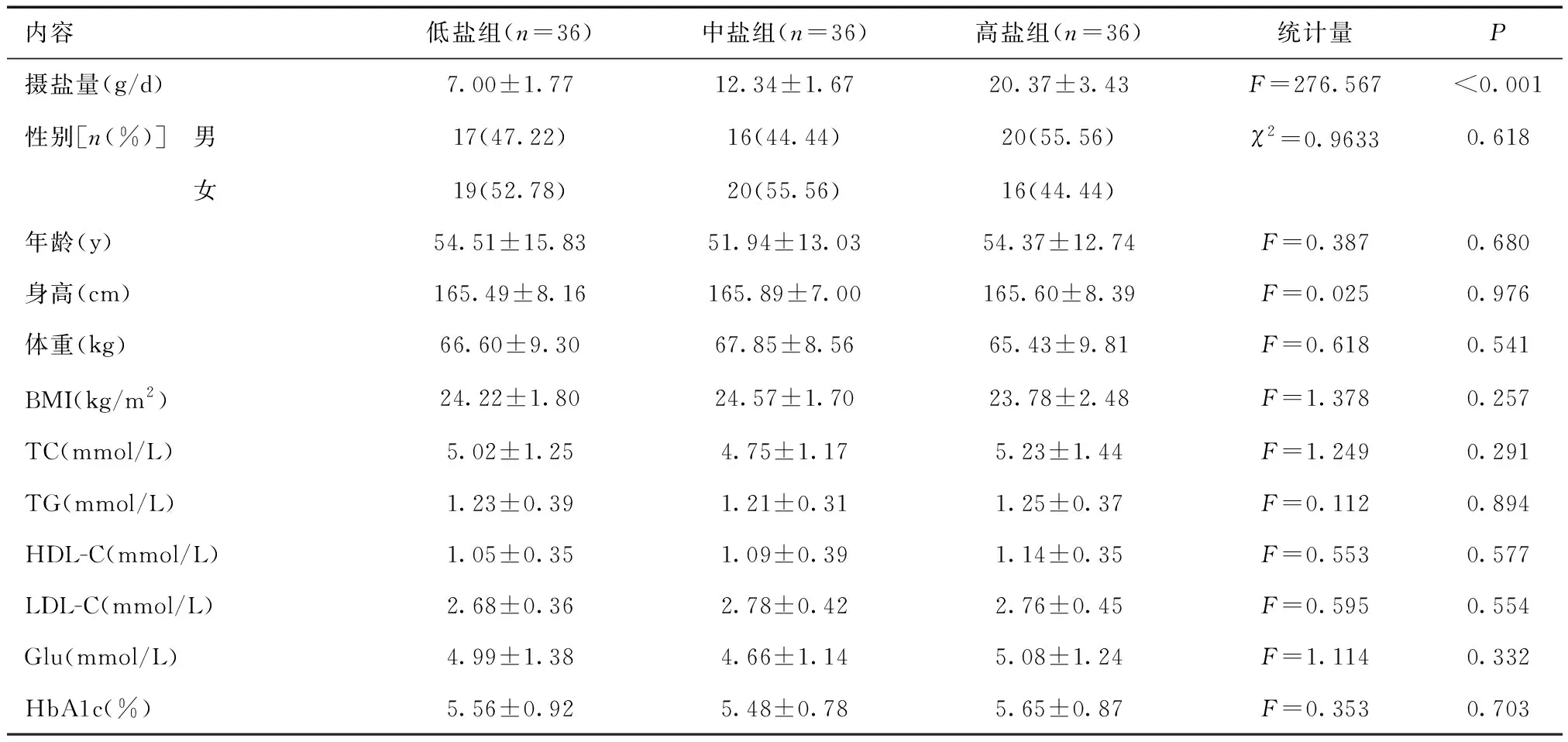
表1 不同盐摄入量患者一般临床资料的比较
1.2方法
1.2.124 h尿标本的收集和测定 采用 24 小时尿钠量来衡量每日钠盐摄入量,当日在休息状态下留取尿标本,正常饮食。晨起 7 点前或7点准时第一次排小便,遗弃,此后全天的小便存于加入防腐剂的专用清洁尿桶中,至第二日早 7 点准时排小便最后一次,将 24 h 标本搅拌均匀。用量筒测量 24 h 全部尿液体积,并记录。留取其中 100 ml 尿液在 2~8 摄氏度环境下保存。采用全自动生化分析仪检测尿钠浓度,并换算 24 h 尿钠排泄量为每日钠盐摄入量,每日摄盐量(g)=10/9×24 h尿钠排泄量 (mmol/24 h)×58.5/1000[13]。
1.2.2动态血压监测 采用动态血压仪记录血压,将袖带绑缚在受试者的非优势手臂上,将 6:00~23:00测得的血压称为日间血压,将 23:00 至次日 6:00测定的血压定义为夜间血压,测量频率为每小时1次,自动检测时,受试侧手臂自然下垂(站立或坐位)或受试侧手臂自然放平(平卧位)。计算 24 h 平均收缩压(24 h SBP)、24 h 平均舒张压(24 h DBP)、日间平均收缩压(d SBP)、日间平均舒张压(d DBP)、夜间平均收缩压 (n SBP)、夜间平均舒张压(n DBP)。BPV 采用血压标准差来表示,即 24 h收缩压标准差(24 h SSD)、白天收缩压标准差(dSSD)、夜间收缩压标准差(n SSD)及 24 h 舒张压标准差(24 h DSD)、白天舒张压标准差(d DSD)、夜间舒张压标准差(n DSD)。血压昼夜节律应用夜间收缩压及舒张压下降率表示,即夜间平均血压较日间平均血压下降的百分比。
1.3统计学方法使用 SPSS 24.0 软件进行分析。计量资料以均数±标准差表示。不同摄盐量组间均数比较采用单因素方差分析。计数资料以例数和百分数表示,采用卡方检验。两因素之间的相关性采用Pearson 相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1三组血压水平的比较高盐组患者的24 h SBP、24 h DBP、d SBP、d DBP、n SBP和n DBP均高于中盐组及低盐组,差异有统计学意义(P< 0.05)。见表2。
2.2三组血压变异性的比较高盐组患者24 h SSD、d SSD、n SSD、24 h DSD、d DSD、n DSD和夜间收缩压下降率均高于中盐组及低盐组,差异有统计学意义(P< 0.05),而夜间舒张压下降率差异无统计学意义(P> 0.05)。但是低盐组和中盐组患者n SSD、24 h DSD、d DSD、n DSD和夜间收缩压下降率差异均无统计学意义(P> 0.05)。见表3。
2.3摄盐量与BPV的相关性分析Pearson 相关性分析显示,盐摄入量与24 h SSD、d SSD、n SSD、24 h DSD、d DSD、n DSD和夜间收缩压下降率均呈正相关(P< 0.05),而与夜间舒张压下降率无相关性(P> 0.05)。见表4。
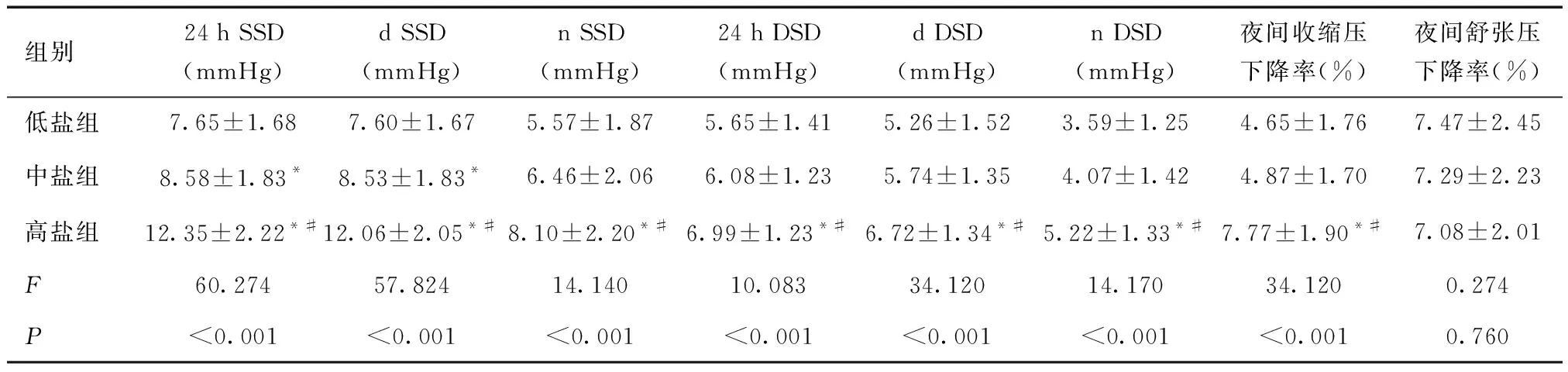
表2 不同盐摄入量患者血压水平的比较
*与低盐组比较,P< 0.05;#与中盐组比较,P< 0.05
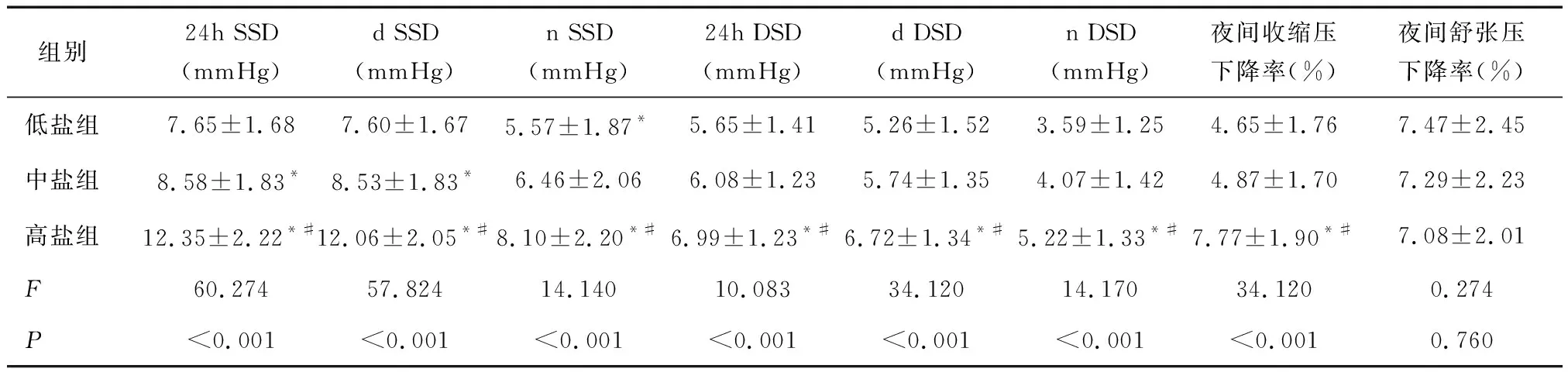
表3 不同盐摄入量患者血压变异性的比较
*与低盐组比较,P< 0.05;#与中盐组比较,P< 0.05
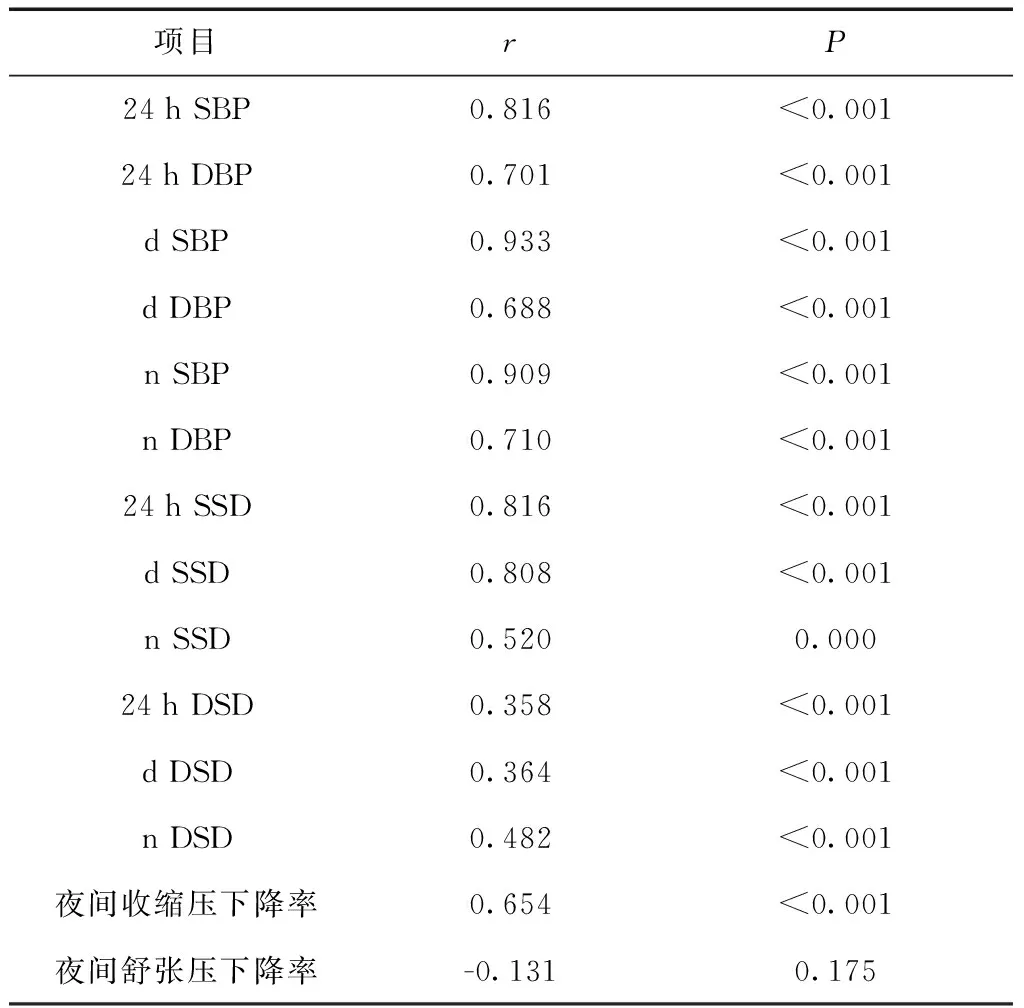
表4 盐摄入量与血压、血压变异性的相关性分析
2.4BPV相关因素的多元线性回归分析分别以 24 h SSD、24 h DSD、d SSD、d DSD、n SSD、n DSD 和夜间收缩压及舒张压下降率作为因变量,以年龄、身高、体重、BMI、TC、TG、、HDL-C、LDL-C、Gl、HbA1c和摄盐量为自变量行多元线性回归分析。结果显示摄盐量是24 h SSD、24 h DSD、d SSD、d DSD、n SSD、n DSD及夜间收缩压下降率的影响因素。同时LDL-C、BMI和Glu对 24 h SSD、 d SSD 的影响有统计学意义,BMI对夜间收缩压下降率的影响具有统计学意义(P< 0.05)。见表5。
3 讨论
BPV 是指在一定时间区间内血压波动的幅度,其机制目前尚未阐明。目前研究显示:BPV 不仅有遗传基因的作用,而且受生活方式的影响,其中BPV 与高盐、高脂、高糖饮食、缺乏运动等有关。
肾素-血管紧张素-醛固酮系统在调节血压和水盐代谢中起着重要的作用。动物研究发现,高盐膳食可抑制血浆肾素活性、醛固酮浓度[14]。小样本的人群随机对照研究发现,在高血压患者及正常人中,短期高钠膳食可抑制肾素分泌[15];荟萃分析显示,减盐后血浆肾素及醛固酮水平升高。有研究显示,高盐膳食导致的水钠潴留抑制了循环肾素血管紧张素系统活性的同时导致了血压的升高,但组织的肾素血管紧张素活性却是增加[16]。因此,高血压患者体内肾素-血管紧张素-醛固酮系统的失调可能是引起高血压血压变异增大的原因。
正常人生理情况下,昼夜收缩压、舒张压与钠排泄显著相关,血压和尿钠排泄均呈现夜间杓型变化趋势。由此可见,尿钠的排泄节律影响血压的节律变化。有研究[17]发现,高盐较低盐摄入患者有更多比例的非杓型高血压;夜间高血压患24 h尿钠排泄量明显升高,提示高盐膳食与血压节律改变有关。由于部分患者存在肾脏排钠缺陷,钠排泄能力降低所致钠潴留,为排出体内潴留的钠,机体压力性利尿利钠作用重建,夜间尿钠排泄量被动性增加,故夜间血压代偿性升高,杓型趋势变浅甚至消失,出现非杓型血压改变[18,19]。

表5 BPV相关因素多元线性回归分析结果
本研究结果显示,高血压患者的盐摄入量与患者BPV呈显著正相关,在血压水平相同的情况下,盐摄入量越高,BPV越大。因此,控制高血压患者的盐摄入量对控制患者血压水平和血压变异性具有重要的临床意义。我们需要更多大规模的前瞻性研究来阐明BPV、盐摄入量与心血管疾病的相关性。
[1] Pimenta E,Gaddam KK,Oparil S,et al.Effects of dietary sodium reduction on blood pressure in subjects with resistant hypertension:results from a randomized trial[J].Hypertension,2009,54(3):475-481.
[2] Karppanen H,Mervaala E.Sodium intake and hypertension[J].Prog Cardiovasc Dis,2006,49(2):59-75.
[3] Koy,Park JH,Yang MH,et al.The significance of blood pressure variability for the development of hemorrhagic transformationg in acute ischemic stroke [J].Stroke,2010,41(11):2512-2518.
[4] 吕肖锋,黄金鑫,张微微,等.急性脑梗死合并2型糖尿病与血糖漂移及同型半胱氨酸水平的相关性研究[J].解放军医药杂志,2013,15,25(11):16-19.
[5] 鲁旭亮.同型半胱氨酸胱抑素C与2型糖尿病血管并发症的相关性研究[J].解放军医药杂志,2013,25(11):23-25.
[6] Sayk F,Teckentrup C,Becker.Effects of selective slowwave sleep deprivation on nocturnal blood pressure dipping and daytime blood pressure regulation [J].American Journal of Physiology,2010,298(2):191-197.
[7] 陈维杰,李瑾,李微.老年原发性高血压血压变异性与靶器官损害的关系[J].同济大学学报(医学版),2011,32(5):68-71.
[8] 王家赐,刘八一,李建功.原发性高血压患者血压变异性与血清 TNF-α、IL-6 和 hs-CRP 关系的研究[J].中国医药导报,2012,9(5):39-41.
[9] 王宁,余振球.高血压患者血压变异性与肱踝脉搏波传导速度的关系研究[J].中国全科医学,2012,15(3):851.
[10]Tai C,Sun Y,Dai N,et al.Prognostic Significance of Visit -to-Visit Systolic Blood Pressure Variability:a Meta -Analysis of 77,299 Patients[J].The Journal of Clinical Hypertension,2015,17(2):107-115.
[11]Zvia BE,Anat L,Meira N,et al.The correlation between retinal blood flow velocity measured by the retinal function imager and various physiological parameters [J].Ophthalmic surgery,2014,44(1):51-58.
[12]Damasceno A,Caupers P,Santos A,et al.Influence of salt intake on the daytime-nighttime blood pressure variation in normotensive and hypertensive black subjects[J].Rev Cardiol,2000,19(3):315-329.
[13]Ekinci EI,Cheong KY,Dobson M,et al.High sodium and low potassium intake in patients with Type 2 diabetes[J].Diabet Med,2010,27(12):1401-1408.
[14]Hildebrandt DA,Irwin ED,Cates AW,et al.Regulation of rennin secretion and arterial pressure during prolonged baroreflexa ctivation:influence of saltintake [J].Hypertension,2014,64(3):604 -609.
[15]Murphey LJ,Eccles WK,Williams GH,et al.Loss of sodium Modulation of plasma kinins in human hypertension [J].J Pharma Col Exp Ther,2004,308 (3):1046-1052.
[16]Chamarthi B,Williams JS,Williams GH.Amechanism for salt-sensitive hypertension:abnormal dietary sodium-mediated vascular response to angiotensin- II [J].J Hypertens,2010,28(5):1020 -1026.
[17]齐曼古丽·伊米尔艾散,许建忠,唐晓峰,等.原发性高血压患者24 h尿钠与血浆肾素活性、醛固酮水平及血压节律的关系[J].中华高血压杂志,2017,25(8):762-770.
[18]Damasceno A,Caupers P,Santos A,et al.Influence of salt intake on the daytime-nighttime blood pressure variation in normotensive and hypertensive black subjects[J].Rev Cardiol,2000,19(3):315-329.
[19]Sachdeva A,Weder AB.Nocturnal sodium excretion,blood pressure dipping,and sodium sensitivity [J].Hypertension,2006,48(4):527-533.
