Castleman病临床病理分析
2018-06-05王春艳古庆家
王春艳,古庆家
(1.遵义医学院,贵州 遵义 563000;2.四川省人民医院耳鼻咽喉头颈外科,四川 成都 610072)
Castleman病是一种临床罕见的无典型特征的淋巴结增生性疾病,又被称为巨大淋巴结病、或血管滤泡性淋巴组织增生、淋巴结错构瘤等。其病理表现为不同程度增生淋巴滤泡、血管及浆细胞,临床上以深部或浅表淋巴结显著肿大为特点,部分病例可伴全身症状和(或)多系统损害。由于该病缺乏临床特点、影像学表现无异质性,且针吸病检组织细胞较少、不易诊断,术前诊断一般较为困难,临床上容易造成误诊和漏诊。现收集我院2006年8月至2017年7月期间收治的9例Castleman病患者的临床资料,并结合相关文献进行分析。
1 资料与方法
1.1一般资料收集2006年8月至2017年7月间在我院住院诊治为Castleman病的9例患者的临床资料,均经手术切除肿大淋巴结或取活检,术后病检及免疫组化证实为Castleman病。
1.2方法回顾性分析9例CD患者的临床特点、治疗及预后。
2 结果
2.1临床特点9例患者中男5例,女4例;年龄23~57岁,中位年龄45岁;病程10天至4年,平均病程1.1年,每例患者最大肿物大小在2.3 cm×1.5 cm×1.0 cm~7.8 cm×5.2 cm×5.0 cm。9例中以发现局部肿大包块为主诉的5例,其中表现为颈部淋巴结肿大的4例,体检发现纵膈淋巴结肿大的1例;以颜面水肿、心累等症状为主诉来就诊的2例,均表现为双侧腋下多个淋巴结肿大,伴多浆膜炎、慢性肾功能障碍等;因腹胀、黑便就诊的1例,表现为双侧腋下淋巴结肿大,伴肝炎、肺炎,急性消化道出血等;因咳嗽、咳痰就诊的1例,入院后检查出纵膈淋巴结肿大。9例患者HIV检查均为阴性。9例患者根据临床分型分为:局灶型(LCD)6例(66.6%),表现为局部淋巴结肿大、临床和影像学检查无其他部位淋巴结肿大,其中为纵膈淋巴结肿大者2例,颈部局灶性淋巴结肿大4例;多中心型(MCD)3例(33.3%),表现为临床及影像学检查见多个部位淋巴结肿大,其中至少一个部位淋巴结经病理检查确诊为Castleman病,或伴浆膜腔积液、肾功能下降等并发症。LCD发病率高于MCD。9例中6例患者均行肿大淋巴结切除术、完全切除肿块;3例患者行局部肿大淋巴结活检术,术后配合内科综合治疗,其中1例患者治疗期间自动出院。所有组织行病理常规染色及免疫组化。
2.2病理结果9例患者中透明血管型(hyaline vascula,HV)6例,其镜下特点为淋巴结内淋巴滤泡增生,滤泡中心血管增生呈玻璃样变,生发中心变小,外套层小淋巴细胞成同心圆排列似“洋葱皮”样,以及“棒棒糖”样表现,如图1;免疫组化表现多为CK(-)、CD3 CD5及CD45 T细胞(+)、CD20 B细胞(+)、CD21 FDC网(+)、CD34 血管(+)、Ki-67 多<10%、κ(+)、 λ(+)、CD138 浆细胞多为(-),其中病例9表现为CD34和CD138均(+)。浆细胞型(plasma cells,PC)3例,其镜下特点为无明显的玻璃样变性和“洋葱皮”样改变,滤泡间大量成熟浆细胞弥漫增生,如图2;免疫组化为CK(-)、CD3 CD5及CD45 T细胞(+)、CD20 B细胞(+)、CD21 FDC网(+)、CD34 血管(-)、CD138 浆细胞(+)、Ki-67 多>10%、κ(+)、 λ(+);9例患者中无混合型病例;HV型发病率略高于PC型。
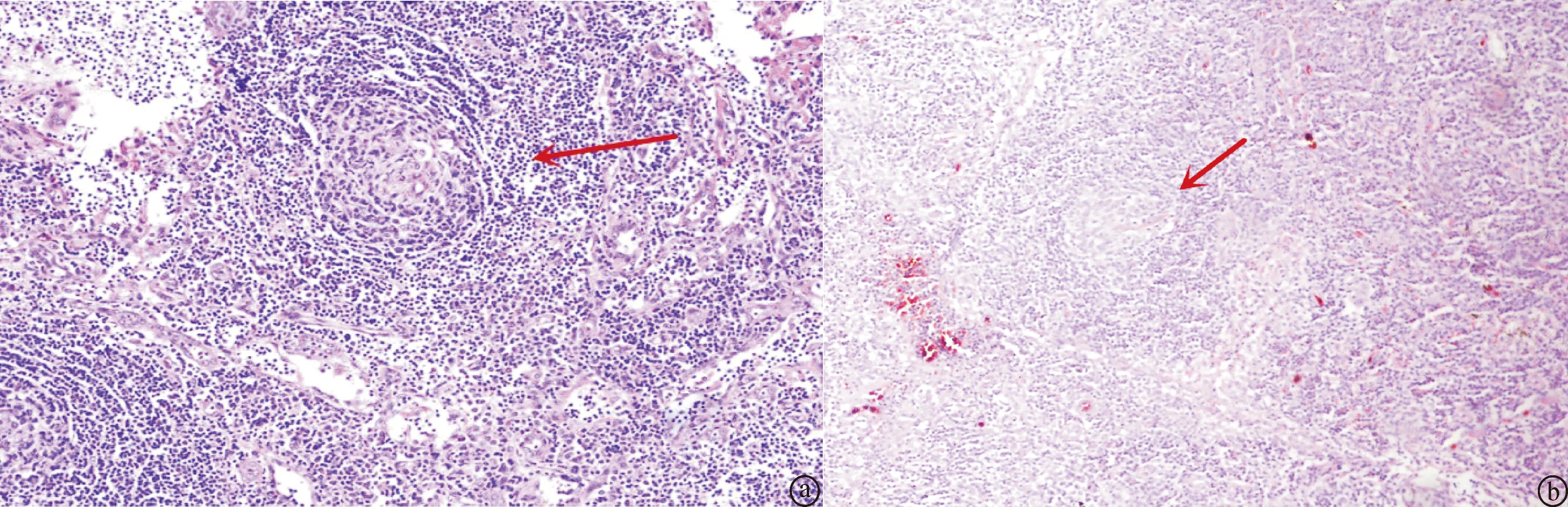
图1 Castleman病局部肿大淋巴结病理改变 (HE染色,×100) a:透明血管型,箭头示“洋葱皮”样表现。b:浆细胞型,箭头示淋巴滤泡增生,周围浆细胞浸润
2.3随访及预后对9例患者进行电话或门诊随访,随访截止至2017年6月,随访时间7~113月,中位随访时间102月。其中6例LCD型无复发;2例MCD型综合治疗后症状缓解,病例5出院后6月症状反复,再次综合治疗后好转;1例MCD型患者治疗期间症状无缓解时要求自动出院,失访。
3 讨论
Castleman 病是以淋巴结肿大为特点的介于良恶性之间的淋巴结增生性疾病,多以无痛性淋巴结肿大或不明原因的巨大肿块为特点,可发生于全身任何部位[1],以纵膈、腹部、颈部、腋窝、腹股沟等部位多见,也可涉及肺、心包、鼻咽部等结外器官或组织[2]。早在 1954 年Castleman 等[3]第一次报道了其病理特征,之后又在1956年报道了13例此病种并总结了这类疾病的临床特征[4],由此命名为 Castleman 病。目前研究认为CD是一种临床少见的、病因不明的反应性淋巴结增生病,各个年龄阶段皆可发病,目前研究报道中成年人多见,男女发病率无明显差异,与此次研究结果一致,另有文献报道女性发病率略高于男性[5,6],研究结果的差异可能与CD属于罕见疾病、国内外各研究的病例数较小有关。CD可按临床类型分为2型:LCD和MCD。按照其病理特点分为3型:透明血管型(HV)、浆细胞型(PC)、混合型(Mix)。国内资料报道[7],HV 型临床较常见,约 80% ~90%,临床多为LCD,常表现为单一部位淋巴结无痛性肿大,一般无全身症状;PC 型所占比例约 10% ~20%,临床多为MCD,表现为多部位淋巴结肿大,可伴发全身症状如发热和肝脾肿大、低蛋白血症、胸腹水、高 γ 球蛋白血症和贫血,以及肾损害等。国外学者报道,透明血管型发病率约48%、浆细胞型约占48%、混合型较少、约占4%[8]。此次研究发现透明血管型占66.7%,浆细胞型占33.3%,和国内相关资料相近。
3.1Castleman病的发病机制CD的病因及发病机制目前尚不十分清楚,根据近年来研究分析,可能与病毒感染、细胞因子调节异常及血管增生等因素有关:①病毒感染:近年来研究比较倾向于探讨人类疱疹病毒8 (HHV-8) 和人类免疫缺陷病毒 (HIV) 感染与CD的关联,有学者建议将MCD 分为 HHV-8 相关性和 HHV-8 阴性两种类型;报道指出通过对 HHV-8 相关性CD患者的骨髓活检标本进行检测,发现其主要表现特征为骨髓浆细胞反应性增生,推测其具有一定的诊断价值[9]。②免疫缺陷与免疫调节异常:研究发现196例MCD患者中有140例合并有HIV感染[10],并且合并HIV感染的MCD还具有侵袭性;多数PC型CD患者可合并自身免疫性疾病如SLE、特发性血小板减少性紫癜、POEMS 综合征、类风湿关节炎等并发症;提示免疫力下降或者免疫调节功能异常,可导致CD病情加重、免疫功能异常可能参与CD的疾病发生发展过程[11,12]。③细胞因子:文献报道IL-6、IL-5、IL-10可能参与MCD的发生[13,14],其中IL-6 在该病发病机制中起重要作用。然而由于缺少全面大量的研究,这些因素与CD发病的机制仍无明确论证,有待进一步的研究。
3.2Castleman病的临床特征及病理、基因、影像学特征CD的临床表现无典型性,一般起病隐匿、常呈惰性发展、病程较长,临床表现为无痛性淋巴结肿大。此次研究病例多为无意间或体检时发现局部包块,或因并发症去就医。研究发现[15],LCD多发生于中青年,HV型较多,可无全身症状,肿块过大时可压迫临近组织器官、引起相应症状,多数患者也是因此就医。此次研究中LCD患者发病年龄23~56岁,其中病例9患者肿块已压迫推挤颈内静脉,实验室检查无异常,与国内外相关研究结果一致。MCD多发于老年,多为PC型,表现为多部位淋巴结肿大,是一种全身弥漫性淋巴结病,临床表现常具有侵袭性,病人多有发热、乏力、消瘦、贫血等症状,此外还可能伴有并发症,如肾病综合征、SLE、口腔炎、特发性血小板减少性紫癜、POEMS综合征、干燥综合征、副肿瘤性天疱疮等。根据报道,MCD患者伴随肾损害的比率较高[6]。此次研究中3例MCD患者均表现为全身多系统并发症。
病理检查和免疫组化是诊断CD的主要依据。其病理分型为:透明血管型、浆细胞型、混合型。CD主要病理形态学改变是具有完整淋巴组织结构、淋巴滤泡增生和小血管肿瘤样增生,而针吸活检无法观察完整的淋巴组织结构,这也是针吸活检不易诊断的原因。其不同类型之间的特点为:HV型镜下特点为淋巴滤泡增生,玻璃样变的滤泡中心血管增生,血管外套层淋巴细胞成同心圆排列、形成类似“洋葱皮”样或“棒棒糖”样。PC型特点为无明显的玻璃样变性和“洋葱皮”样改变,但具有大量成熟浆细胞增生。混合型则包含上述两种特征。本次研究结果发现,HV型CD免疫组化表现为CD34(+)、Ki-67多<10%;PC型CD免疫组化表现为CD138(+)、Ki-67多>10%;HV型和PC型CD20、CD3 CD5、κ 、λ均为(+),无特异性,CD21阳性阴性率无特异性。刘洁等[16]研究发现发现CD31和CD34有助于HV-CD诊断,CD138有助于PC-CD诊断;这与本次研究结果一致。
CD的影像学检查并无特异性,但也可根据其CT及B超表现结合临床作为诊断参考。其CT 表现无特异性,为均匀密度、可表现为局灶肿块性圆形或椭圆形的软组织密度影[17],部分呈浅分叶状,部分有斑点状或分支样钙化,其钙化影可能与增生毛细管壁增厚、伴有玻璃样变性、纤维化变性等有关,病灶体积较大时对周围组织或器官有不同程度推挤、压迫征象。此次研究资料显示,9例CD患者中CT表现多为密度均匀软组织影,部分可见钙化影。有研究证实CT 增强扫描时病灶的强化程度与病理分型有关,可用于鉴别HV型CD和PC型 CD,HV型动脉期和静脉期 CT 值均高于浆细胞型,且从平扫到动脉期 CT 上升值也大于浆细胞型 CD[18]。王姝等[19]经18F-FDG PET/CT显像发现CD病灶有中等程度的代谢增高,提示18F-FDG PET/CT显像对CD的诊断有价值。CD的超声检查常表现为包膜清晰、血流分布部分呈边缘型、部分呈门型还有一部分呈混合型、血供丰富,淋巴结内可见点状血流信号,并无特异性。
3.3Castleman病的诊断及鉴别诊断由于缺乏典型的临床特征及影像实验室特点,CD的术前诊断相对困难,因此临床医生有必要加强对该病的认识,提高对该病的诊疗水平。Frizzera 等[20]在1988提出了沿用至今的CD诊断标准:LCD:单一部位淋巴结肿大,组织病理学上具有特征性增生,除外可能的原发病,多无全身症状,贫血、免疫球蛋白升高等(PC型除外),肿物切除后可长期存活。MCD:具有特征性组织病理学改变,显著淋巴结肿大累及外周淋巴结,有多系统受累表现,排除其他病因,手术、放疗、化疗仅获部分缓解。一般临床遇到以上几点应该考虑该病的可能。由于针吸活检组织量极少且肿块部分切除未能完整切除肿瘤、不利于病理形态观察分析,术前活检术可能诊断率不高、容易造成误诊漏诊。此次报道病例9患者前后经历四次活检均未确诊,最后通过完整切除肿块后确诊。该病最终是依靠病理及免疫组化进一步明确诊断,且尽量完整切除肿块,利于诊断。还应注意与以下疾病相鉴别:淋巴结转移性癌、淋巴结结核、霍奇金淋巴瘤、血管免疫母细胞性 T 细胞淋巴瘤、胸腺瘤、滤泡性淋巴瘤等。
3.4治疗及预后对于LCD的治疗,一般首选手术彻底切除肿大淋巴结,预后良好、复发率小,此次研究中6例LCD型患者,术后恢复良好,随访无复发,符合此结论。对于肿块过大不能彻底切除或有手术禁忌者,可考虑放疗,放疗对局限性PC型疗效较佳、局限性HV型效果较差,放疗剂量一般采用30~45 Gy。对于MCD 采用综合治疗,也可手术切除肿大淋巴结改善压迫症状,其全身症状也可得到缓解;但常因其多部位淋巴结肿大,手术彻底切除可能性小,可选化疗,常用方案为CHOP和COP,其中CHOP效果较好、临床常用;也可采用激素治疗,有激素治疗后发热减轻、肿块减小的案例[21]。对于手术难以完整切除肿物者,报道称造血干细胞移植对MCD亦有效[22];也有采用抗人 IL-6 受体的人源化单克隆抗体、沙利度胺、全反式维 A 酸等药物治疗的[23,24]。此外有学者报道[25]用靶向药物治疗及自体干细胞移植治疗等也有一定疗效,但尚处于临床试验阶段,治疗效果及不良反应有待进一步观察。LCD通过手术治疗多可治愈,高润涛等[26]发现一例CD 从LCD向MCD转变,提示局限型可能是疾病的早期表现。由于病例太少不具有代表性,有待临床应长期随访研究发现疾病的临床规律。MCD则病情复杂,预后较差,可转化为霍奇金淋巴瘤[27,28],或者转变为恶性淋巴瘤、浆细胞瘤及 Kaposi 肉瘤等,故要长期随访。
综上所述,Castleman病临床少见,且不易诊断,临床医生的经验、知识及判断在对疾病的诊治中有着非常重要作用,因此,熟悉CD的临床表现、影像学特点及病理表现,有助于该病正确及时诊断。临床遇到淋巴结肿大且除外原发疾病、伴或不伴全身症状,无法明确诊断时,可考虑行手术切除肿块,术后行病检确诊。尤其是局灶型患者的情况,彻底手术切除肿块是治疗该病的最佳方法,且预后良好。
[1] Bonekamp D,Horton KM,Hruban RH,et al.Castleman disease:thegreat mimic[J].Radiographics,2011,31(6):1793-1807.
[2] 刘炜炜,葛春林,陈旭春,等.12例多中心型Castleman病的诊断与治疗[J].中国肿瘤临床,2010,37(20):1179-1183.
[3] Castleman B,Towne VW.Case records of the Massachusetts GeneralHospital:Case No.40231[J].N Engl J Med,1954,250(23):1001-1005.
[4] Castleman B,Iverson L,Menendez VP.Localized mediastinal lymphnode hyperplasia resembling thymomaJ].Cancer,1956,9(4):822-830.
[5] 高然,张蕊,曲艺,等.Castleman病82例临床特征分析[J].现代肿瘤学,2013,21(8):1843-1845.
[6] Linkhorn H,van Dermeer G,Gruber M,et al.Castleman’s disease:An unusually young presentation resulting in delayed diagnosis of a neck mass[J].International journal of pediatric otorhinolaryngology,2016,86:90-92.
[7] 刘卫平,平凌燕,郑文,等.21例 Castleman 病的临床病理特点[J].西安交通大学学报(医学版),2014,35(1):139 -142.
[8] Dispenzieri A,Armitage JO,Loe MJ,et al.The clinical spectrum ofCastleman,s disease[J].Am J Hematol,2012,87(11):997-1002.
[9] Venkataraman G,Uldrick T S,Aleman K,et al.Bone marrow findings in HIV-positive patients with Kaposi sarcoma herpesvirus associated multicentric Castleman disease[J].Am J Clin Pathol,2013,139(5):651 -661.
[10]Oksenhendler E,Boutboul D,Fajgenbaum D,et al.The full spectrum of Castleman disease:273 pantients studied over 20 years.Br J Haematol,2018,180(2):206-216.
[11]张路,李剑.Castleman 病发病机制研究进展[J].中国医学科学院学报,2016,38(1):118-121.
[12]Seo S,Yoo C,Yoon DH,et al.Clinical features and outcomes in patients with human immunodeficiency virus-negative,multicentric Castleman’s disease:a single medical center experience[J].Blood Res,2014,49(4):253-258.
[13]Yoshizaki K,Murayama S,Ito H,et al.The role of Interleukin 6 in Castleman Disease[J].HematolOncol Clin of North Am,2018,32(1):23-36.
[14]Zondag TC,Rokx C,van Lom K,et al.Cytokine and viral load kinetics in human herpesvirus 8-associated multicentric Castleman’s disease complicated by hemophagocytic lymphohistiocytosis[J].Int J Hematol,2016,103(4):469-472.
[15]徐傲,陈柯,王琦,等.Castleman病45例临床病理学分析[J].安徽医药,2017,21(9):1632-1637.
[16]刘洁,徐玉乔,杨守京.Castleman病的免疫表型和基因重排分析[J].临床与实验病理学杂志,2011,15(4):361-366.
[17]陈勃江,李为民,张尚福,等.3例胸腔Castleman病临床病理特点分析[J].实用医院临床杂志,2013,10(4):30-33.
[18]包婕,徐耀,王希明,等.CT增强扫描在鉴别Castleman病病理类型中价值的研究[J].临床放射学杂志,2017,36(3):374-377.
[19]王姝,李雪娜,刁尧,等.18F-FDG PET/CT显像诊断单中心Castleman病1例及文献复习[J].现代肿瘤医学,2018,26(6):932-935.
[20]Frizzera G.Castleman’s disease and related disorders [J].Semin Diagn Pathol,1988,5(4):346-364.
[21]NooK,Lee SW,Lee JW,et al.Cases report ofunicentric Castleman’s disease:revisit of radiotherap role[J].Radiat oncol J,2013,31:48-54.
[22]Jiang JP,Shen XF,Du JF,et al.A retrospective study of 34 patients with unicentric and multicentric Castleman’s disease:Experience from a single institution[J].Oncol Lett,2018,15(2):2407-2412.
[23]Dong Y,Wang M,Nong L,et al.Clinical and laboratory characterisation of 114 cases of Castleman disease patients form a singlecenter:paraneoplastic pemphigus is an unfavourable prognosticfactor[J].Br J Haematol,2015,169(6):834-842.
[24]Deisseroth A,Ko CW,et al.FDA approval:siltuximab for the treatment of patients with multicentric Castleman disease[J].Clin Cancer Res,2015,21(5):950-954.
[25]陈青青,张会来,王华庆.Castleman 病的研究进展[J].中国肿瘤临床,2014,41(17):1135 -1139.
[26]高润涛,张宁,任辉,等.Castleman病14例临床特征及诊治分析[J].临床和实验医学杂志,2016,15(1):3-6.
[27]李峰.多中心型、浆细胞型Castleman病转变为经典型霍奇金淋巴瘤1例[J].中国临床医学影像杂志,2012,23(7):527-529.
[28]寿娟,龙艳丽,粟凤,等.Castleman病继发霍奇金淋巴瘤临床病理分析并文献复习[J].华中科技大学学报(医学版),2017,46(5):612-614.
