分泌型卷曲相关蛋白-1在糖尿病肾病小鼠肾组织中的表达及意义
2018-06-05孟庆敏刘玲伶田平平王圆圆石明隽
孟庆敏 余 莹 孔 静 刘玲伶 田平平 郭 兵 肖 瑛 王圆圆 石明隽
(贵州医科大学病理生理学教研室,贵州 贵阳 550004)
糖尿病(DM)肾病(DN)是DM常见而严重的并发症之一,然而DN的确切发病机制尚不清楚。肾小管上皮细胞向间充质细胞转分化(EMT)在肾小管间质纤维化的发生发展中起着重要作用〔1~3〕。 wnt信号通路是诱导EMT发生的一条关键信号通路。目前大量的研究表明wnt信号通路的异常激活参与了肺、肝、心脏、皮肤及肾等很多器官纤维化时的EMT过程〔4,5〕。分泌型卷曲相关蛋白家族(sfrps)因为与wnt信号通路的受体Frizzled的CRD区域同源而被认为是wnt信号通路的一类拮抗因子。本实验旨在观察sfrp-1在DN小鼠肾组织中的表达变化,探讨DN时sfrp-1在DN肾纤维化发生发展中的作用及可能机制。
1 材料与方法
1.1主要材料、试剂 链脲佐菌素(STZ)购自美国Sigma公司;聚偏二氟乙烯膜(PVDF)膜、增强化学发光法(ECL)显色剂、蛋白浓度测定试剂盒二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自碧云天,蛋白质Marker购自北京索莱宝公司;两步法免疫组化检测试剂、辣根过氧化物酶标记羊抗兔免疫球蛋白(Ig)G、辣根过氧化物酶标记羊抗小鼠IgG均购自北京中杉全桥生物技术有限公司;β管家基因(β-actin)、E-钙黏蛋白(E-cadherin)、α-平滑肌肌动蛋白(SMA)、胶原蛋白(col-Ⅲ)、wnt4、β-连环蛋白(β-catenin)、sfrp-1均购自北京博奥森公司;sfrp-1逆转录试剂盒为Thermo产品;sfrp-1实时荧光聚合酶链反应(Real-time PCR)试剂盒为北京天根系列产品。
1.2动物模型复制、分组和标本收集 雄性清洁级昆明小鼠购自贵州医科大学动物中心,动物批号:SCXK(黔)2012-0001;昆明小鼠在清洁环境下给予正常饮食及自由饮水适应性喂养1 w,检测尿蛋白和尿糖定性为阴性;小鼠空腹血糖都在正常范围(3.2~7.1 mmol/L)内。小鼠禁食不禁水3 h,给予55 mg/kg STZ腹腔注射,连续5 d,1次/d。造模后2 w测小鼠空腹血糖,以血糖≥16.7 mol/L且尿糖阳性者判定为造模成功。正常对照组给予相同剂量STZ溶媒无菌柠檬酸钠缓冲液腹腔注射,连续5 d,1次/d。小鼠均给予标准饲料喂养,自由饮水。 12只小鼠随机分为DM组(n=6)、正常对照组(n=6)。两组分别于成模后10 w处死。小鼠处死前1 d用小鼠代谢笼收集24 h尿。处死前禁食不禁水6 h,称体重,测空腹血糖,水合氯醛麻醉后摘眼球取血,开腹取胰腺组织和双侧肾脏,胰腺和一侧肾脏固定于4%中性甲醛,另一侧肾脏保存于-80℃。
1.3免疫组化法检测目的蛋白表达 烤片60℃、2 h后,常规脱蜡水化,3%过氧化氢封闭内源性过氧化物酶、柠檬酸缓冲液微波炉煮沸抗原修复、曲拉通破膜、磷酸盐缓冲液(PBS)洗3次后,一抗(β-catenin;1∶100;sfrp-1;1∶100)4℃冰箱湿盒孵育过夜;复温30 min,PBS洗3次后,37℃孵育相应二抗1 h。PBS洗3次,二氨基联苯胺(DAB)显微镜下染色,流水冲洗,苏木素镜下复染,流水冲洗,常规脱水透明,晾干,中性树脂封片干燥后,镜下观察蛋白表达。
1.4免疫印迹分析 称取小鼠50~100 mg肾脏组织,去掉髓质,加入按比例配置的含苯甲基磺酰氟(PMSF)的裂解液于匀浆器内,冰上研磨,BCA蛋白浓度测定试剂盒测定蛋白浓度,按比例加入1.5倍缓冲液配置成蛋白样品,震荡混匀,100℃,煮沸10 min,使蛋白充分变性,-20℃保存待用。用前解冻,上样、电泳、转膜、封闭、相应一抗4℃冰箱摇床孵育过夜,一抗分别为β-actin(1∶1 000)、wnt4(1∶400)、α-SMA(1∶200)、E-cadherin(1∶200)、sfrp-1(1∶500)、col-Ⅲ(1∶200)、糖原合成酶激酶(GSK)-3β(1∶500)、p-GSK3β(1∶500)、β-catenin(1∶300)。次日,洗膜后,相应二抗孵育1 h,洗膜后ECL显影曝光。检测各目的蛋白的相对表达量,图像采用BIO-RAD图像处理软件分析。
1.5RNA的提取和RT-PCR分析 按照TRIZOL总RNA试剂盒方法提取小鼠肾皮质总RNA,测定RNA纯度和浓度。根据Thremo试剂盒说明将RNA逆转录成cDNA,Real-time PCR采用天根试剂盒20 μl体系,具体实验步骤按照试剂盒说明书进行。数据采用BIO-RAD软件处理分析。
1.6统计学方法 采用SPSS17.0软件进行t检验。
2 结 果
2.1两组生化指标比较 小鼠造模成功后,逐渐出现多饮、多食、多尿、消瘦,体重明显减轻;正常对照组无上述症状,体重增长明显。DM组血糖、肌酐、尿素氮、24 h尿蛋白、三酰甘油水平均明显高于正常对照组(P<0.05),见表1。
2.2免疫组化结果 正常对照组肾组织几乎没有β-catenin蛋白的表达,而DM组肾小管上皮细胞胞质内可见β-catenin蛋白大量集聚,并出现核转移(图中箭头所指处);sfrp1蛋白在正常对照组肾皮质肾小管细胞胞质内可见棕黄色阳性表达,而在DM组阳性表达减少,见图1。
2.3Western印迹结果 与正常对照组比较,wnt4、β-catenin、p-GSK3β、α-SMA和col-Ⅲ蛋白在DM组肾皮质表达明显增多(P<0.05),E-cadherin和sfrp-1蛋白表达显著减少(P<0.05),而GSK-3β蛋白表达两组差异无统计学意义(P>0.05)。见表2、图2。
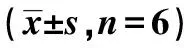
表1 两组生化指标比较
与正常对照组比较:1)P<0.05;表2同

图1 两组肾组织sfrp-1蛋白和β-catenin蛋白表达(×400)
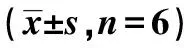
表2 两组肾组织wnt4、β-catenin、P-GSK3β、GSK-3β、sfrp-1、E-cadherin、α-SMA和col-Ⅲ蛋白表达

图2 两组肾组织wnt4、β-catenin、p-GSK3β、GSK3β、sfrp-1、E-cadherin、α-SMA和Col-Ⅲ蛋白表达
2.4Sfrp-1 mRNA表达 与正常对照组(1.1±0.13)比较,DM组肾皮质sfrp-1表达显著降低(0.6±0.08,P<0.05)。
3 讨 论
本研究蛋白印迹结果表明,小鼠肾皮质肾小管上皮细胞中,上皮细胞表型标志蛋白E-cadherin表达下调,而间充质细胞表型标志蛋白α-SMA表达上调,同时伴有细胞外基质的主要成分之一col-Ⅲ显著增多,提示DN小鼠肾小管上皮细胞发生了EMT。
wnt信号通路是诱导EMT的一条关键信号通路,wnt家族19种成员中wnt4与泌尿系统发展至关重要。本研究提示DN小鼠肾脏wnt信号通路被激活。 p-GSK3β蛋白不能使β-catenin发生磷酸化,未被磷酸化的β-catenin蛋白不能被泛素化降解而在胞质中不断累积后转移入核,结合核内转录因子,调节下游致纤维化靶基因的表达,从而促进DN小鼠肾脏EMT的发生。前期的研究结果也表明wnt4/β-catenin信号通路的异常激活促进了单侧输尿管梗阻(UUO)大鼠肾纤维化时肾小管上皮细胞EMT的发生。与He等〔6〕报道的UUO大鼠模型肾组织中wnt4、col-Ⅲ及α-SMA蛋白高水平表达一致。
有研究证实SFRP-1基因改变或表达下调是wnt信号通路异常激活的重要原因〔7〕。sfrp-1属于分泌型糖蛋白家族,定位于染色体8p12~11.1〔8〕,由sfrp基因编码。sfrp结构上与wnt通路的受体(frizzled,Fz)具有同源的CRD区,能与wnt蛋白相互作用以阻止wnt蛋白结合至Fz蛋白;或与Fz形成无功能复合物而阻碍wnt信号转导。sfrp-1通过抑制wnt信号通路而抑制纤维化进程。本研究结果提示sfrp-1可能参与了DN小鼠肾纤维化过程,这与Suzuki等〔9〕在大肠癌中建立的人结肠癌细胞和结直肠癌裸鼠模型中的研究结果一致,有研究证实,在培养间充质干细胞培养基中,应用sfrp-1蛋白能通过抑制wnt信号通路从而抑制肺成纤维细胞增殖〔10〕。葛文松等〔11〕发现,sfrp-1阻断wnt经典信号通路可显著抑制肝星状细胞(HSC)增殖,促使其凋亡,减少胶原分泌。
总之,DN时wnt信号被激活,而wnt信号通路的抑制因子sfrp-1蛋白和mRNA表达下调。提示wnt信号通路的的异常激活可能与其抑制因子sfrp-1的表达下调而导致对wnt信号的抑制作用减弱有关,进而促进了DN小鼠肾纤维化的发生发展。而寻找sfrp-1表达下调的原因及重新恢复其表达,进而扭转wnt信号的活化状态,为抗DN肾纤维化提供了新方向。
4 参考文献
1方开云,娄晶磊,肖 瑛,等.转化生长因子β1和snail参与糖尿病大鼠肾小管上皮细胞向间充质细胞转变〔J〕.生理学报,2008;60(1):125-34.
2Li Y,Sun Y,Liu F,etal.Norcantharidin inhibits renal interstitial fibrosis by blocking the tubular epithelial-mesenchymal transition〔J〕.PLoS One,2013;8(6):e66356.
3Liu RX,Wang YY,Xiao Y,etal.SnoN as a key regulator of the high glucose-induced epithelial-mesenchymal transition in cells of the proximal tubule〔J〕.Kidney Blood Press Res,2012;35:517-28.
4Duan J,Gherghe C,Liu D,etal.wnt1/beita-catenin injury response activates the epicardium and cardiac fibroblasts to promote cardiac repair〔J〕.EMBO J,2011;31(2):429-42.
5Humphries JD,Byron A,Dhar A,etal.Proteomic analysis of extrancellular matrix from the hepatic stellate cell line LX-2 identifies CYR61 and Wnt-5a as novel constituents of extracellular of fibrotic liver〔J〕.J Proteome Res,2012;11(8):4052-64.
6He W,Dai C,Li Y,etal.Wnt/beta-catenin signaling promotes renal interstitial fibrosis〔J〕.J Am Soc Nephrol,2009;20(4);766-76.
7Martin-Manso G,Calzada MJ,Chuman Y,etal.SFRP-1 binds Via its netrin-related motif to the N-module of thrombospondin-1 and blocks thrombospondin-1 stimulation of MDA-MB-231 breast carcinoma cell adhesion and migration〔J〕.Arch Biochem Biophys,2011;509(2):147-56.
8Weeratna AT,Jiang Y,Hostetter G,etal.Wnt5a signaling directly affects cell motility and invasion of metastatic melanoma〔J〕.Cancer Cell,2002;1:279-88.
9Suzuki H,Watkins DN,Jair KW,etal.Epigenetic inactivation of SFRP genes allows constitutive WNT signaling in colorectal cancer〔J〕.Nat Genet,2004;358:1148-59.
10Beyer C,Schramm A,Akhmetshina A,etal.beta-catenin is a central mediator of pro-fibrotic wnt signaling in systemic sclerosis〔J〕.Ann Rheum Dis,2012;71(5):761-7.
11葛文松,吴建新,陈颖伟,等.siRNA沉默β-catenin对肝星状细胞Ⅰ、Ⅲ型胶原表达的影响〔J〕.肝脏,2011;18(4):308-11.
