老年宫颈癌组织中转化生长因子-β1、叉头框蛋白P3、程序性死亡蛋白1及其受体的表达及意义
2018-06-05高雁荣
高雁荣 郭 玉
(安阳市肿瘤医院妇三科,河南 安阳 455000)
研究表明,肿瘤免疫逃逸可能在宫颈癌形成过程中发挥重要作用。转化生长因子(TGF)-β1是细胞生长抑制因子,参与免疫调节反应,与多种肿瘤的发生发展密切相关〔1,2〕。叉头样转录因子(FOX)P3可通过调控Treg细胞发育、分化和成熟,发挥免疫抑制作用〔3,4〕。程序性死亡受体配体-1(PD-L1)及程序性死亡受体(PD)-1是免疫反应中极其重要的协同刺激分子,其激活有助于肿瘤免疫逃逸〔5,6〕。TGF-β1、FOXP3、PD-1、PD-L1在多种肿瘤中表达异常。本研究通过分析TGF-β1、FOXP3、PD-1、PD-L1在不同组织中的表达及相关性,并分析这四种蛋白表达水平与老年宫颈癌患者临床病理特征的关系,旨在探讨TGF-β1、FOXP3、PD-1、PD-L1在老年宫颈癌发生中的可能作用机制。
1 资料与方法
1.1临床资料 选取安阳市肿瘤医院2014年9月至2016年9月手术切除的老年宫颈癌患者的癌组织60例及老年宫颈上皮内瘤样变患者的宫颈上皮内瘤样变组织30例,同时收集因子宫肌瘤行全子宫切除术且术后病理证实无宫颈病变的组织标本共20例。所有组织标本均置于液氮中保存,标本均经HE染色,经3名有经验的病理医师确诊,纳入对象均未接受过放、化疗等。老年宫颈癌患者年龄60~78岁,平均(69.4±4.8)岁;临床分期:Ⅰ期12例,Ⅱ期14例,Ⅲ期18例,Ⅳ期16例。肿瘤大小:<3 cm 28例,≥3 cm 32例。组织学分级:中高分化27例,低分化33例;有淋巴结转移26例,无淋巴结转移34例,病理类型:38例为鳞状细胞癌,17例为腺癌,5例为腺鳞癌。宫颈上皮内瘤样变患者年龄60~76岁,平均(69.1±4.3)岁;正常宫颈组织患者年龄61~78岁,平均(68.8±4.7)岁。三组研究对象年龄经比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会审核同意。
1.2主要试剂 小鼠抗人TGF-β1、FOXP3、PD-1、PD-L1一抗均购自Santa Cruz公司(美国),免疫组化二抗购自北京中山金桥生物技术有限公司。
1.3免疫组化染色 石蜡包埋组织切片经二甲苯脱蜡,在100%、95%、85%的酒精浸泡水化,在98℃的枸橼酸钠溶液(0.01 mol/L,pH6.0)中浸泡15 min进行抗原修复,将切片放在 Hydrogen Peroxide Block 中孵育 10~15 min以降低内源性过氧化物酶造成的非特异性背景染色。室温封闭20 min,一抗4℃孵育过夜,二抗室温孵育1 h,滴加链霉亲和素-过氧化物酶,室温孵育1 h,DAB显色,在显微镜下掌握染色程度,流水冲洗及时中止反应,封片,镜检。
1.4免疫组化结果判定 在放大400倍的显微镜下观察,每张切片随机选取5个以上观察视野。综合染色强度和阳性细胞百分比判定,染色强度:0分为无着色,1分为淡黄色,2分为棕黄色,3分为棕褐色;阳性染色百分比(<25%为1分,25%~75%为2分,>75%为3分)。两项评分乘积小于2分判定为阴性,≥2分判定为阳性。
1.5统计学分析 采用SPSS17.0软件进行χ2检验,相关性分析采用列联系数分析。
2 结 果
2.1老年宫颈癌组织TGF-β1蛋白的表达 与正常宫颈组织及宫颈上皮内瘤样变组织比较,老年宫颈癌组织中TGF-β1蛋白阳性表达率明显较高(P<0.05);与正常宫颈组织比较,宫颈上皮内瘤样变组织中TGF-β1蛋白阳性表较高(P<0.05);正常宫颈组织中少见TGF-β1表达,见图1,表1。
A:正常宫颈组织;B:宫颈上皮内瘤样变组织;C:老年宫颈癌组织;下图同图1 不同宫颈组织中 TGF-β1蛋白表达(DAB,× 400)
2.2老年宫颈癌组织FOXP3蛋白的表达 与正常宫颈组织和宫颈上皮内瘤样变组织比较,FOXP3蛋白在老年宫颈癌组织中表达的阳性率明显较高;与正常宫颈组织比较,宫颈上皮内瘤样变组织中FOXP3蛋白表达的阳性率明显较高(P<0.05),见表1,图2。
2.3老年宫颈癌组织PD-1蛋白的表达 与正常宫颈组织和宫颈上皮内瘤样变组织比较,PD-1蛋白在老年宫颈癌组织中表达的阳性率明显较高;与正常宫颈组织比较,宫颈上皮内瘤样变组织中PD-1蛋白表达的阳性率明显较高(P<0.05),见表1,图3。
2.4老年宫颈癌患者组织PD-L1蛋白的表达 与宫颈上皮内瘤样变组织比较,PD-L1蛋白在老年宫颈癌组织中表达的阳性率明显较高(P<0.05),而正常宫颈组织无PD-L1的表达,见表1,图4。

图2 不同宫颈组织中 FOXP3蛋白的表达(DAB,×400)

图3 不同宫颈组织中 PD-1蛋白的表达(DAB,×400)

图4 不同宫颈组织中 PD-L1蛋白的表达(DAB,×400)
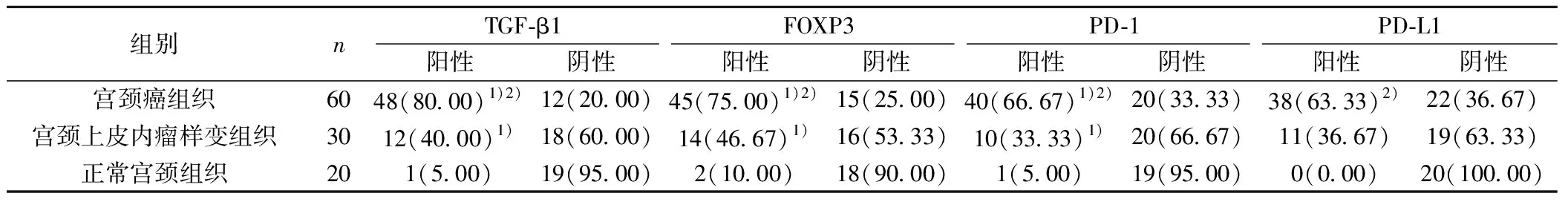
表1 不同组织标本中各蛋白的表达比较〔n(%)〕
与正常宫颈组织比较:1)P<0.05;与宫颈上皮内瘤样变组织比较:2)P<0.05
2.5老年宫颈癌组织TGF-β1、FOXP3、PD-1、PD-L1表达与临床病理特征的关系 TGF-β1的阳性表达与老年宫颈癌的淋巴结转移有关(P<0.05),而与肿瘤大小、临床分期及组织学分级无关(P>0.05)。FOXP3的阳性表达与老年宫颈癌的组织学分级和淋巴结转移有关(P<0.05),而与肿瘤大小、临床分期无关(P>0.05)。PD-1的阳性表达与老年宫颈癌的组织学分级和淋巴结转转移有关(P<0.05),而与肿瘤大小、临床分期无关(P>0.05)。PD-L1的阳性表达与老年宫颈癌的淋巴结转移有关(P<0.05),而与肿瘤大小、临床分期及组织学分级无关(P>0.05),见表2。
2.6老年宫颈癌组织TGF-β1、FOXP3、PD-1、PD-L1表达的相关性 相关性分析发现,TGF-β1与FOXP3表达呈正相关(r=0.685,P=0.003);PD-1与PD-L1表达呈正相关(r=0.412,P=0.000);TGF-β1与PD-1、PD-L1的表达无相关性(r=-0.177、0.137,P=0.171、0.284),FOXP3与PD-1、PD-L1的表达无相关性(r=0.163、0.023,P=0.206、0.757)。

表2 老年宫颈癌患者TGF-β1、FOXP3、PD-1、PD-L1表达与临床病理特征的关系〔n(%)〕
3 讨 论
目前宫颈癌发病机制尚不完全清楚,对其预防和治疗仍是难点。因此,探讨宫颈癌发生发展机制,将为该类患者的治疗提供新的治疗策略和理论依据,并为该病防治药物的研发提供新机制、新靶点、新方向。免疫监视学说认为,免疫系统的一个关键作用是识别并清除肿瘤,免疫系统可监视肿瘤的发生并通过免疫机制杀灭肿瘤,若机体免疫功能低下则可能发生肿瘤。在肿瘤发生、发展过程中,细胞衍生出逃避免疫监视的方式,肿瘤能够逃避免疫监视则被视为肿瘤的十大特征之一。研究发现,宫颈癌发生发展中宫颈局部微环境的免疫监视功能下降所导致的免疫逃逸现象起到了重要的作用,但导致宫颈癌免疫监视能力下降的机制目前尚不清楚。
TGF-β1是一类多肽类细胞因子,具有多种功能,可通过其信号通路发挥生物学效应,广泛参与机体各种生理病理过程。恶性肿瘤细胞可分泌大量的TGF-β1,发挥免疫抑制因子作用。TGF-β1在不同恶性肿瘤患者中有不同程度的表达并参与肿瘤的发生、发展及预后〔7,8〕。FOXP3是一种多功能的转录因子,其发挥免疫抑制作用的途径是通过调控Treg细胞的发育、分化和成熟。研究发现,FOXP3阳性表达的细胞在肿瘤免疫逃逸机制中发挥了相当重要的作用,并且FOXP3在多种肿瘤中表达上调,如肺癌、胃癌、乳腺癌、肝癌、前列腺癌等〔9,10〕。PD-1主要表达在活化T细胞上,是个抑制性受体,可与其配体PD-L1结合,抑制T细胞增殖、活化。PD-L1、PD-1在多种肿瘤中表达异常,可传递负性调节信号,使得肿瘤细胞能够逃避机体免疫机制的监控、杀伤〔11~15〕。本研究提示TGF-β1、FOXP3、PD-1、PD-L1在老年宫颈癌发生中发挥重要作用,但其在肿瘤细胞中的高表达是如何形成的尚待进一步研究。本文结果提示TGF-β1、PD-L1、FOXP3、PD-1与老年宫颈癌患者的不良预后密切相关,分析可能原因为,此4种蛋白可能直接或间接地参与宫颈癌细胞的侵袭、迁移能力调控,并且FOXP3、PD-1可能还参与宫颈癌细胞分化能力的调控;本研究结果还提示TGF-β1与FOXP3、PD-1与PD-L1可能在同一通路中发挥作用。
综上所述,老年宫颈癌组织中TGF-β1、FOXP3、PD-1、PD-L1蛋白表达显著升高,可能与机体对肿瘤细胞的免疫监视能力下降密切相关,进而导致老年宫颈癌的发生发展,研究这些蛋白的表达对老年宫颈癌患者的治疗、预后具有一定的临床价值。
4 参考文献
1Zhou X,Mao Y,Zhu J,etal.TGF-beta1 promotes colorectal cancer immune escape by elevating B7-H3 and B7-H4 via the miR-155/miR-143 axis〔J〕.Oncotarget,2016;7(41):67196-211.
2Wu M,Chen X,Lou J,etal.TGF-β1 contributes to CD8+Treg induction through p38 MAPK signaling in ovarian cancer microenvironment〔J〕.Oncotarget,2016;7(28):44534-44.
3Wang X,Lang M,Zhao T,etal.Cancer-FOXP3 directly activated CCL5 to recruit FOXP3+Treg cells in pancreatic ductal adenocarcinoma〔J〕.Oncogene,2017;36(21):3048-58.
4韩丽萍,刘丽雅,孙晓慧,等.宫颈癌组织中 FOXP3、PD-1及PD-L1蛋白的表达〔J〕.郑州大学学报(医学版),2017;52(1):83-8.
5吴介恒,杨安钢,温伟红.PD-1/PD-L1参与肿瘤免疫逃逸的研究进展〔J〕.细胞与分子免疫学杂志,2014;30(7):777-80.
6林 城,陈 雄,刘静南,等.PD-1/PD-L1信号通路在非小细胞肺癌免疫逃逸及其治疗中的研究进展〔J〕.中国肺癌杂志,2014;17(10):734-40.
7Zhang F,Dong W,Zeng W,etal.Naringenin prevents TGF-β1 secretion from breast cancer and suppresses pulmonarymetastasis by inhibiting PKC activation〔J〕.Breast Cancer Res,2016;18(1):38.
8García-Rocha R,Moreno-Lafont M,Mora-García ML,etal.Mesenchymal stromal cells derived from cervical cancer tumors induce TGF-β1 expression andIL-10 expression and secretion in the cervical cancer cells,resulting in protection from cytotoxicT cell activity〔J〕.Cytokine,2015;76(2):382-90.
9Sun X,Feng Z,Wang Y,etal.Expression of Foxp3 and its prognostic significance in colorectal cancer〔J〕.Int J Immunopathol Pharmacol,2017;30(2):201-6.
10Chakraborty S,Panda AK,Bose S,etal.Transcriptional regulation of FOXP3 requires integrated activation of both promoter and CNS regions in tumor-induced CD8+Treg cells〔J〕.Sci Rep,2017;7(1):1628.
11Ciccarese C,Iacovelli R,Bria E,etal.The incidence and relative risk of pulmonary toxicity in patients treated with anti-PD1/PD-L1 therapy for solid tumors:a meta-analysis of current studies〔J〕.Immunotherapy,2017;9(7):579-87.
12Erlmeier F,Weichert W,Schrader AJ,etal.Prognostic impact of PD-1 and its ligands in renal cell carcinoma〔J〕.Med Oncol,2017;34(6):99.
13Jones K,Ballesteros A,Mentink-Kane M,etal.PSG9 stimulates increase in FoxP3+ regulatory T-cells through the TGF-β1 pathway〔J〕.PLoS One,2016;11(7):e0158050.
14Bally AP,Tang Y,Lee JT,etal.Conserved region C functions to regulate PD-1 expression and subsequent CD8 T cell memory〔J〕.J Immunol,2017;198(1):205-17.
15Moret FM,van der Wurff-Jacobs KM,Bijlsma JW,etal.Synovial T cell hyporesponsiveness to myeloid dendritic cells is reversed by preventing PD-1/PD-L1interactions〔J〕.Arthritis Res Ther,2014;16(6):497.
