16个Y-STR基因座快速复合扩增体系的构建研究
2018-06-02韩俊萍李彩霞丁光树李万水朱波峰
董 倩,欧 元,韩俊萍,李彩霞,尚 蕾,赵 蕾,丁光树,孙 辉,李万水,叶 健,朱波峰*,孙 敬*
(1.西安交通大学口腔医学院陕西省颅颌面精准医学研究重点实验室;陕西省牙颌疾病临床医学研究中心,中国陕西西安710004;2.公安部物证鉴定中心北京市现场物证检验工程技术研究中心;法医遗传学公安部重点实验室,中国北京100038;3.北京市公安局朝阳分局刑事侦查支队,中国北京100025)
Y-STR为正常男性所特有,呈父系遗传,在法医领域中,尤其对男女混合检材及父权鉴定发挥着独特的作用,此外,对于家系排查、缩小侦查范围、调整侦查方向同样具有重要意义。1997年Prinz等[1]首次建立了Y-STR复合扩增体系,将其命名为Quadruplex I,并做了法医学应用性研究。此后,许多研究者通过各种尝试和探索开发了新的Y-STR复合扩增体系[2,3]。
目前国内外学者主要侧重于多个Y-STR基因座的体系构建和遗传多态性研究[4~7],缺乏对Y-STR快速分型和检测体系的构建研究。常规的DNASTR分型要经过DNA的提取、纯化、PCR扩增和电泳检测,需要8~10 h,其中最耗时的过程就是PCR扩增,将近3~4 h。为了提高检验效率,人们提出了快速PCR技术[8,9]。本研究首次在国内构建了符合中国人群的16个Y-STR基因座的快速复合扩增体系,明显提高了样品检测效率,对日常Y-STR数据库的建设和一些特殊案件的初步排查具有一定的实际意义。
1 材料与方法
1.1 实验样本
初始浓度为10 ng/μL的DNA标准品9948购自美国MCLAB公司;血卡由实验室日常积累而来;血液样本DNA由M48 QIAGEN®试剂盒提取获得。
1.2 主要试剂与仪器
M48 QIAGEN®试剂盒(QIAGEN公司,德国);蛋白酶 K(Merck公司,德国);FastStart Taq DNA Polymerase和PCR Optimization Kit(Roche Applied Science公司,德国);STR基因座引物(生工生物工程(上海)股份有限公司);ProPlex热循环仪、3130xl型遗传分析仪(Applied Biosystems公司,美国)。
1.3 基因座信息
本研究选取Y染色体非重组区上的16个STR基因座,包括“欧洲最小单倍群”7个基因座:DYS19、DYS385a/b、DYS390、DYS391、DYS392 和DYS393;SGMDNA学会推荐的2个基因座:DYS-438、DYS439;7个适合中国人群的高度多态性基因座:DYS437、DYS448、DYS456、DYS458、DYS-635、DYS447和Y_GATA H4。引物均由生工生物工程(上海)股份有限公司合成。
1.4 扩增条件的初步选择
将实验分为3组,采用3种不同的扩增程序,即Typer 15试剂盒程序(A)、罗氏试剂盒扩增程序(B)、GlobalFilerTMExpress Kit(C),进行初步选择,扩增条件见表1。反应体系最初根据罗氏试剂盒说明书为10 μL,包括10×FastStart High Fidelity Reaction Buffer(MgCl2)1 μL,dNTP Mix(10 mmol/L)0.2 μL,DNA TyperTM15 引物混合物 1 μL,快速热启动酶(5 U/μL)0.4 μL,DNA标准品模板9948(1 ng/μL)1μL,去离子水补足至 10 μL。实验重复5次。

表1 PCR扩增程序Table1 PCR amplification procedures
1.5 反应体积的选择
将反应体积分为 4 组,分别为 10 μL、15 μL、20 μL、25 μL,体积配比见表2。采用 1.4 建立的扩增PCR条件,平行比对4种体积的扩增效果,根据等位基因是否丢失和峰的均衡性选择最佳体积,实验重复5次。
1.6 热启动酶用量的筛选
将FastStart高保真聚合酶用量筛选实验分为4组,建立10 μL反应体系,体系配置见表3。根据1.5实验结果选取合适的条件作为扩增程序,用去离子水代替9948模板作为阴性对照,实验重复5次。

表2 PCR扩增体积筛选体系Table2 Volume-selective systems for PCR amplification
1.7 引物平衡调整
将各基因座上下游引物等比混合配成引物混合物,采用1.6中10 μL体系及优选的扩增程序B进行分析。实验主要根据同种荧光标记的各基因座的等位基因荧光信号强度的高低,微调相对应基因座引物的浓度,至全部峰高较为均衡,最终确定各基因座引物浓度。
1.8 快速复合PCR扩增程序的优化
根据1.7采用的最佳扩增体系对1.4初步采用的扩增程序进行快速复合扩增程序优化。1)将实验分为 5 组,循环次数分别为 26、27、28、29、30次,其他步骤同1.4优选的程序,确定最佳的循环次数;2)将循环反应中95℃变性时间分为5组,分别为 2 s、3 s、4 s、5 s、7 s,确定最佳变性时间;3)将循环中的退火温度分为6组,分别为55℃、57℃、59℃、61℃、63℃、65℃,确定最佳退火温度;4)将退火时间分为 5 组,分别为 5 s、10 s、20 s、30 s、40 s,其他程序采用已经优选的程序;5)将循环中的延伸时间分为 5 s、10 s、20 s、30 s、40 s,确定最佳延伸时间;6)将终延伸时间分为5组,分别为 1 min、3 min、5 min、7 min、9 min,确定最佳终延伸时间,每个实验均重复5次。
1.9 PCR缓冲液的筛选
利用PCR Optimization Kit中提供的常见的13种buffers(含有不同pH值和Mg2+浓度,具体见表4)以及高保真的缓冲液,采用1.6中建立的10 μL反应体系及1.8中建立的快速PCR扩增条件,平行比对14种buffers的扩增性能,根据扩增结果选取最佳快速PCR的扩增buffer。
1.10 精确性和片段准确性的研究
将20份等位基因分型标准物与上样缓冲液按1∶9比例混合,3130xl电泳检测,重复5次。然后根据其分型结果计算等位基因片段的大小均值和标准差,以评估所构建Y-STR快速复合扩增体系的精确性。其次,选取300份M48提取的血卡DNA样本,用构建的快速复合扩增体系进行检测,同时9948为阳性对照,去离子水为阴性对照,5个重复,以评估所构建快速体系分型的准确性。

表3 热启动酶用量筛选体系Table3 A selective system for the amount of the heat-activated enzyme
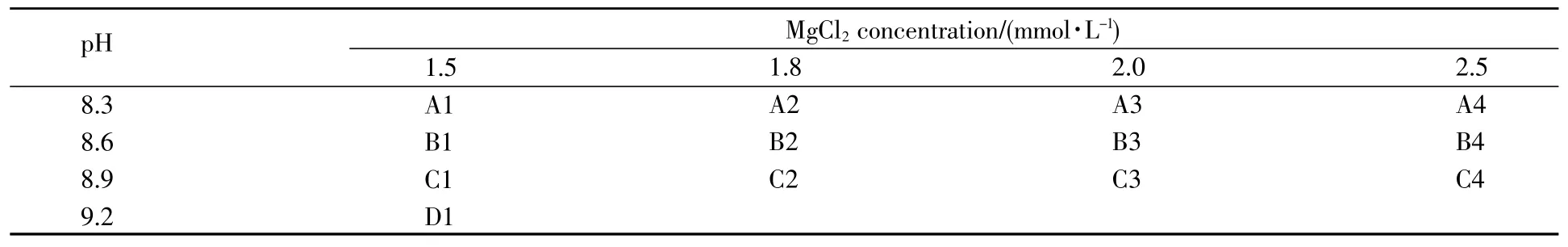
表4 13种缓冲液所含MgCl2浓度及其pH值Table4 The concentration of MgCl2and its pH value in 13 kinds of buffers
1.11 案例样本的研究
为了评估16重Y-STR快速复合扩增体系处理实际样本的能力,以及其遗传多态性性能,用本研究所构建的Y-STR快速扩增体系对日常实验室积累的300份男性样本进行了研究,同时用公安部物证鉴定中心自主研发的Y29试剂盒和阅微基因技术有限公司的MRY29试剂盒进行阳性对照实验,旨在用不同试剂盒验证对同一样本分型结果的准确性。
2 结果
2.1 扩增条件的初步选择
采用表1所示3个扩增条件分别进行扩增,经3130xl遗传分析仪毛细管电泳检测后结果如图1所示。A、B、C分别为3种不同扩增程序的扩增产物电泳图,程序C为GlobalFilerTMExpress Kit,未得到任何产物;程序A和程序B的扩增结果出峰完全,没明显差异。考虑到程序B扩增时间明显缩短,初步选择程序B为后续扩增实验的标准程序。
2.2 反应体积的筛选
通过比较4个反应体积的扩增结果,发现10 μL反应体系在保证获得16个基因座的完整STR分型前提下试剂消耗最少,而且其他3个反应体积都出现不同程度的等位基因丢失、扩增产物峰高较低以及峰高不均衡等现象,故选择10 μL作为快速反应的终体积。
2.3 热启动酶用量的筛选
在初选扩增程序下,比较不同用量的热启动酶对扩增效果的影响,结果显示,虽然各酶量扩增结果均未见等位基因丢失,未出现非特异扩增现象,但是随着热启动酶用量的增加,扩增产物峰逐渐增加,同种荧光基因座间的平衡性更均衡(图2),故后续实验反应体系中均加入0.4 μL热启动酶。10 μL标准反应体系为10×FastStart High Fidelity Reaction Buffer(MgCl2)1 μL,dNTP Mix(10 mmol/L)0.2 μL,10×引物混合物 1 μL,热启动酶(5 U/μL)0.4 μL,9948 模板(1 ng/μL)1 μL,去离子水 6.4 μL。
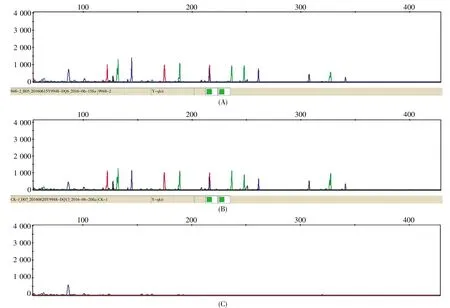
图1 不同PCR条件下9948产物的电泳图谱Fig.1 Electrophoresis profiles of 9948 products under different PCR conditions
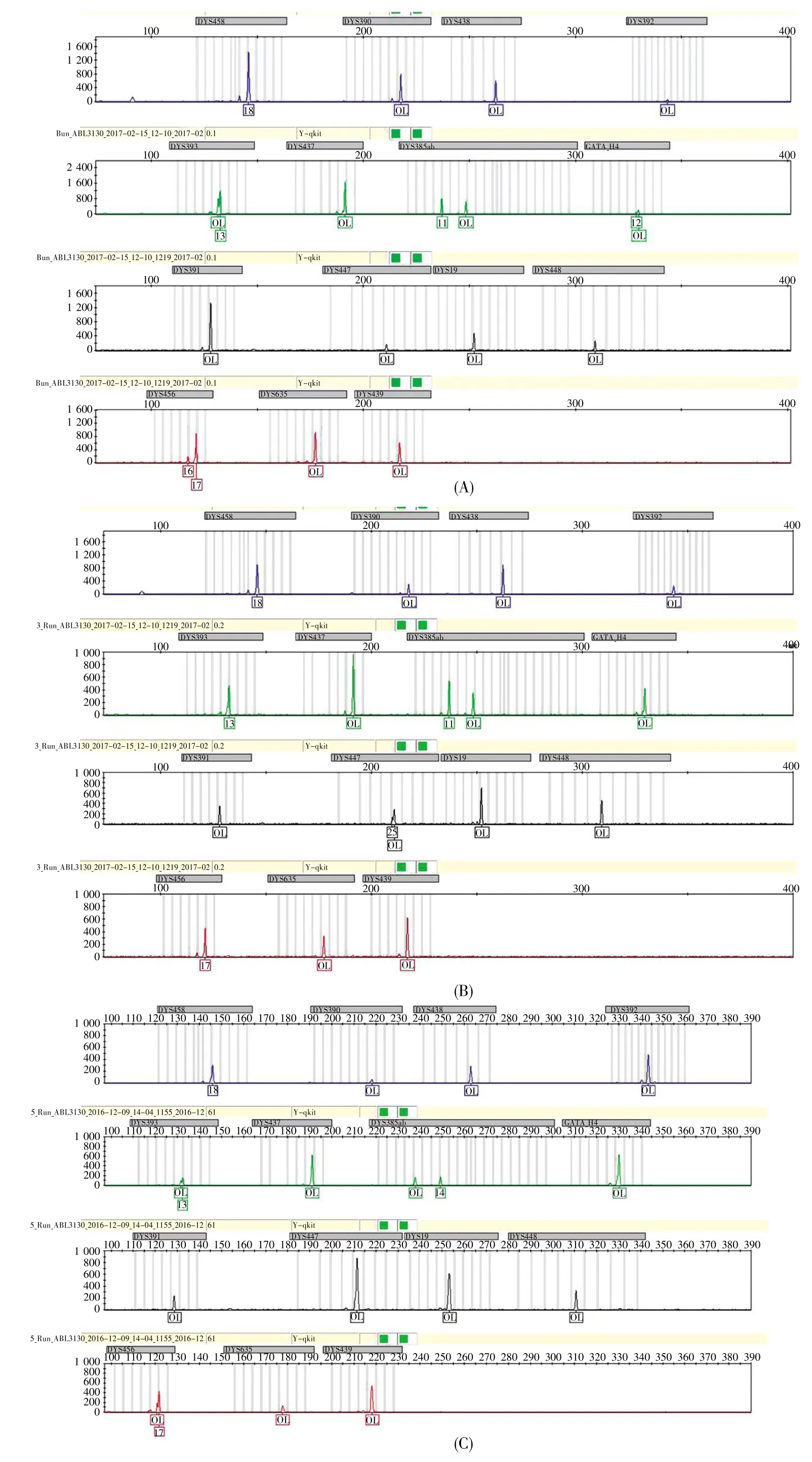

图2 不同浓度热启动酶条件下9948产物的电泳图谱Fig.2 Electrophoresis profiles of 9948 products under different concentrations of hot start enzyme
2.4 引物平衡调整
根据扩增分型结果的峰高对引物浓度进行微量调整以达到基因座间峰高的均衡。最终检测结果见图3,各基因座等位基因谱带清晰,且扩增的产物峰高较为均衡,峰型对称尖锐,无非特异性峰,分型结果准确。各基因座引物终浓度配比见表5。
2.5 快速复合PCR扩增程序的优化
2.5.1 循环次数
利用确定好的标准程序和10 μL标准体系对循环次数进行优化,扩增结果显示,26、27个循环时产物峰高明显过低不易分型,从28至30个循环时均可得到完整基因座分型结果,产物峰高强度随循环数增加而增加(图4)。其中,28和29个循环时峰高明显改善且均衡性好;30个循环时,出现个别基因座峰的渗透、非特异扩增和基因座间峰高的均衡性变差,因而根据实际样本选择28或29作为PCR循环次数。
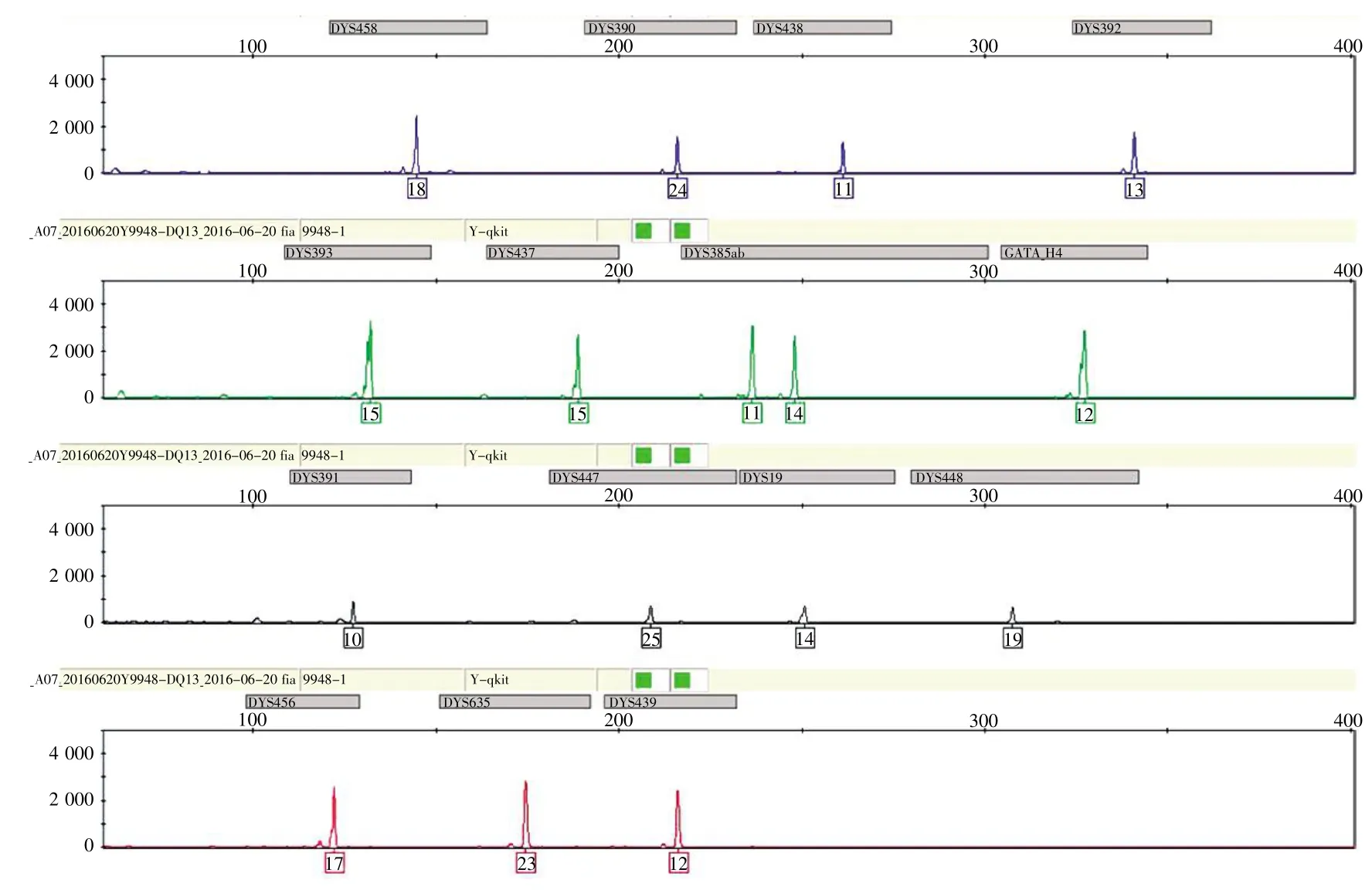
图3 调整后全部引物复合扩增检测结果Fig.3 The results of composite amplification test of all primers after adjustment
2.5.2 变性时间
利用标准程序B及10 μL标准体系对循环中变性时间进行优化,实验结果显示,变性时间从2 s延长至7 s时,除DYS458和DYS392基因座的峰高均衡性较差外,其余基因座均可得到完整分型结果,扩增产物峰高、均衡性均未见明显变化。由于7 s相比5 s,DYS458和DYS392基因座的峰高均衡性更好(图5),故选择7 s作为PCR扩增循环中的变性时间。
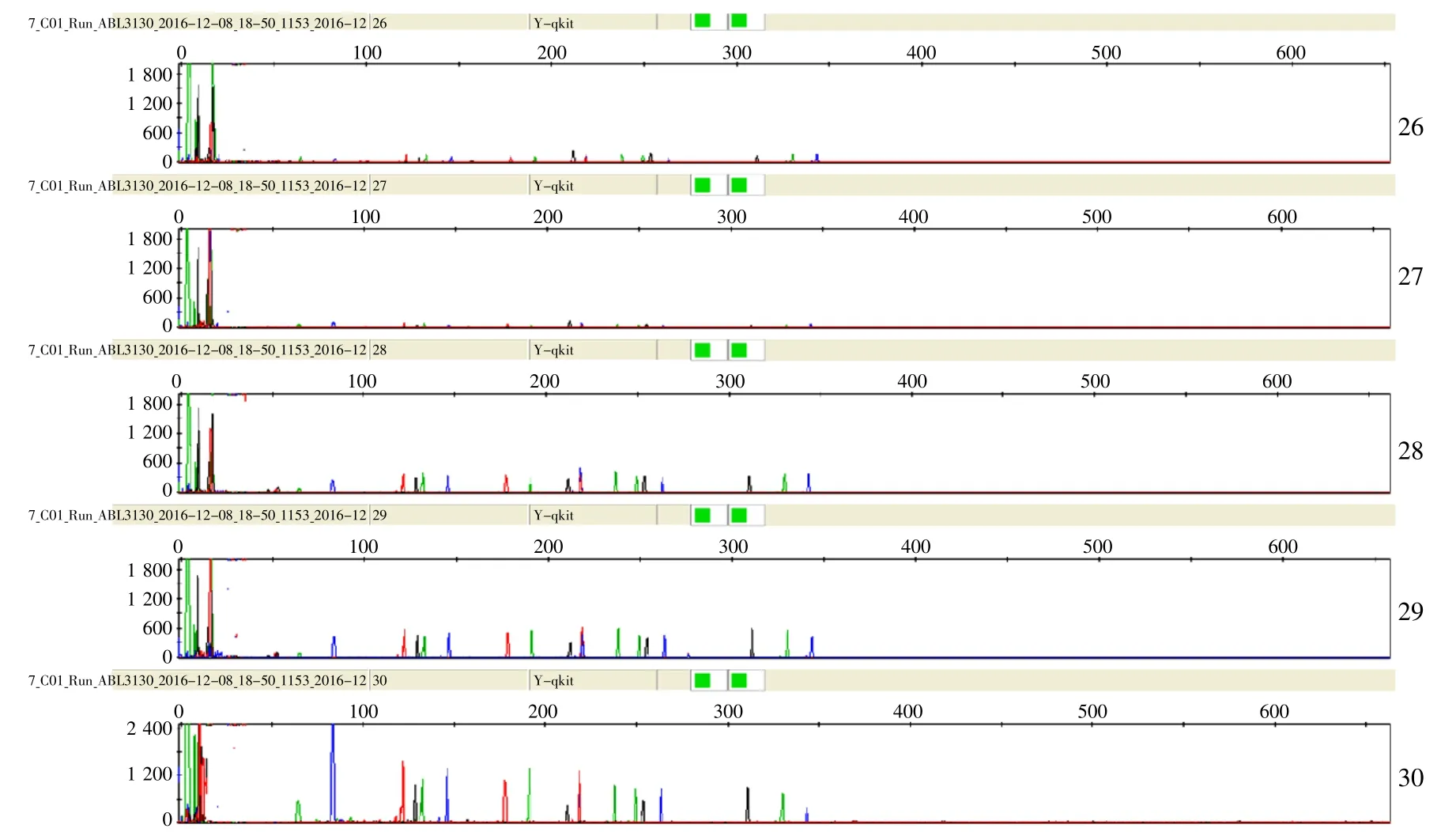
图4 不同循环次数条件下9948产物的电泳图谱Fig.4 Electrophoresis profiles of 9948 products under different cycles
2.5.3 退火温度及时间
采用2.5.2程序和扩增体系先后对循环中的退火温度和退火时间进行优选。退火温度的考察结果如图6所示,从图中可知,退火温度为55℃时,个别基因座出现非特异性扩增(图6A);63~65℃时,出现基因座丢峰,尤其是65℃时可见大部分基因座峰丢失(图6B);57~61℃时,没有丢峰现象,但59℃时基因座间均衡性最佳(图6C)。关于退火时间,5~10 s时等位基因丢失逐渐减少,产物峰的信号强度逐渐增大;20~40 s时,各基因座分型均完整准确,但是与20 s相比,30 s时扩增产物的峰高和等位基因峰值均衡性更佳,且与40 s无明显差异。基于以上结果,选择59℃、30 s作为快速PCR扩增循环中的退火温度和退火时间。
2.5.4 延伸时间和终延伸时间
采用1.4中的程序B和10 μL标准体系对循环中的延伸时间和终延伸时间进行优选,实验扩增结果显示,延伸时间为10~30 s、终延伸时间为3~9 min时均无非特异性峰和基因座丢失,且产物峰值间均衡性无明显变化。因此,快速PCR扩增循环中的最佳延伸时间设为10 s,终延伸时间设为3 min。
综合以上优选结果,最终确定的快速PCR条件为95℃4 min;95℃7 s,59℃30 s,72℃10 s,28或29个循环;72℃3 min;25℃保温。共需30 min。
2.6 PCR缓冲液的筛选
将实验中选择的13种缓冲液和试剂盒推荐的 10×FastStart High Fidelity Reaction Buffer加入确定的最佳10 μL PCR扩增体系,结果显示所选择13种缓冲液的扩增结果均出现大部分等位基因丢失,只有D2缓冲液10×FastStart High Fidelity Reaction Buffer分型完整(图7)。故采用D2缓冲液10×FastStart High Fidelity Reaction Buffer作为反应的缓冲液。
2.7 精确性和片段准确性研究
为了评估本研究构建的16个Y-STR快速体系实际处理案件样本的能力,我们首先对16个基因座的等位基因片段进行了测序分析,每个位点的测序结果与位点的实验检测位置一一对应,从而科学地验证了位点信息的准确性,部分结果见图8。随后,采用等位基因标准品allelic ladder重复20次进行电泳检测以验证该快速体系分型的精确性,用血液提取DNA样本进行扩增以检验该快速体系分型的准确性,结果如图9所示。从图9可知,等位基因标准品allelic ladder峰高和均衡性良好;重复20次后等位基因标准品allelic ladder在对应等位基因的片段的标准差均在0.2个核苷酸内,体现了较好的精确度;300份样本DNA等位基因的相应片段大小与allelic ladder相应片段差值均在0.3个核甘酸内,完全在仪器误差允许的范围内。以上结果说明构建的16个基因座的快速复合扩增体系能够精确并且准确地对样本进行分型。
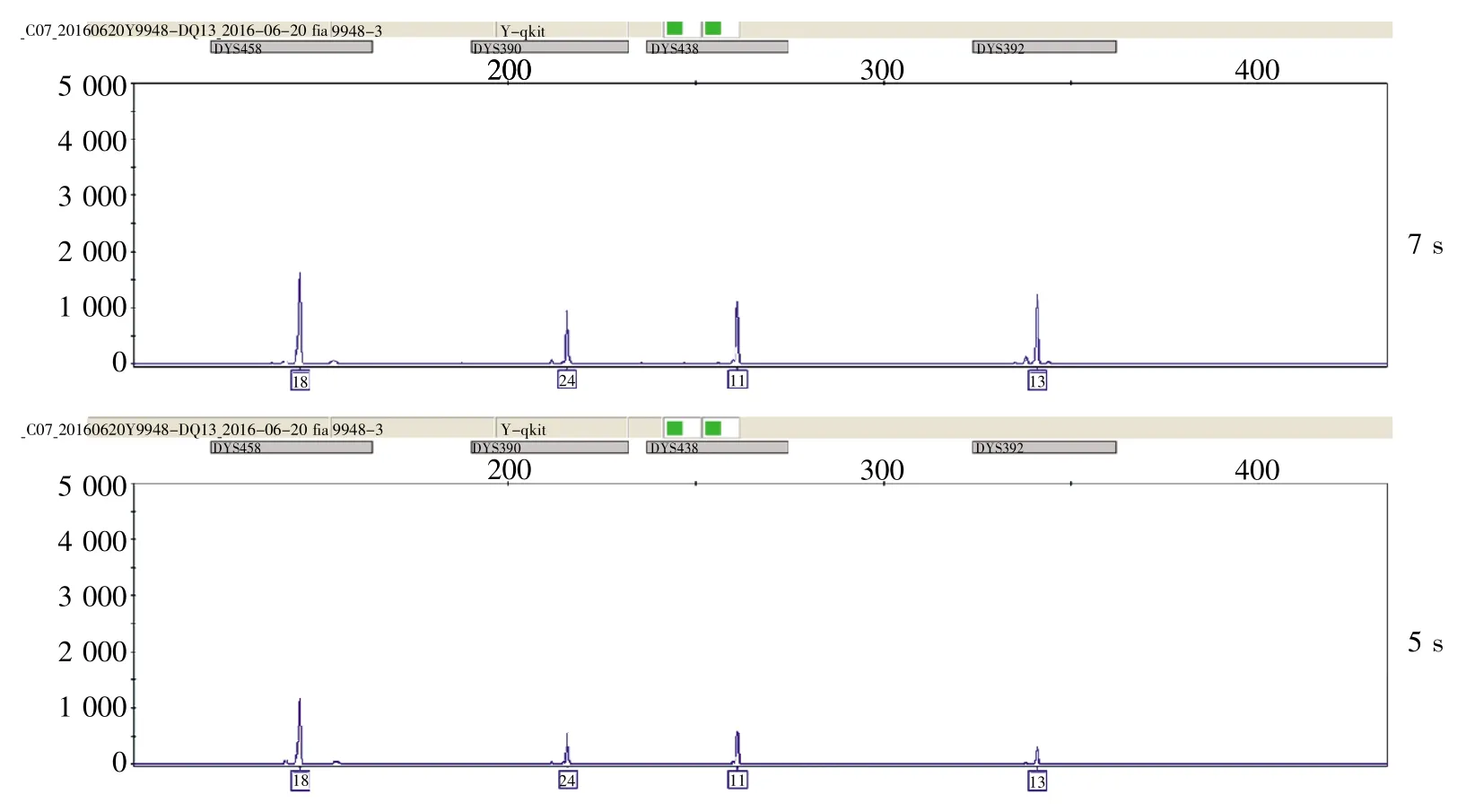
图5 DYS458和DYS392基因座在7 s和5 s变性时间下的分型检测结果Fig.5 The results of detecting DYS458 and DYS392 loci with the denaturation times of 7 s and 5 s
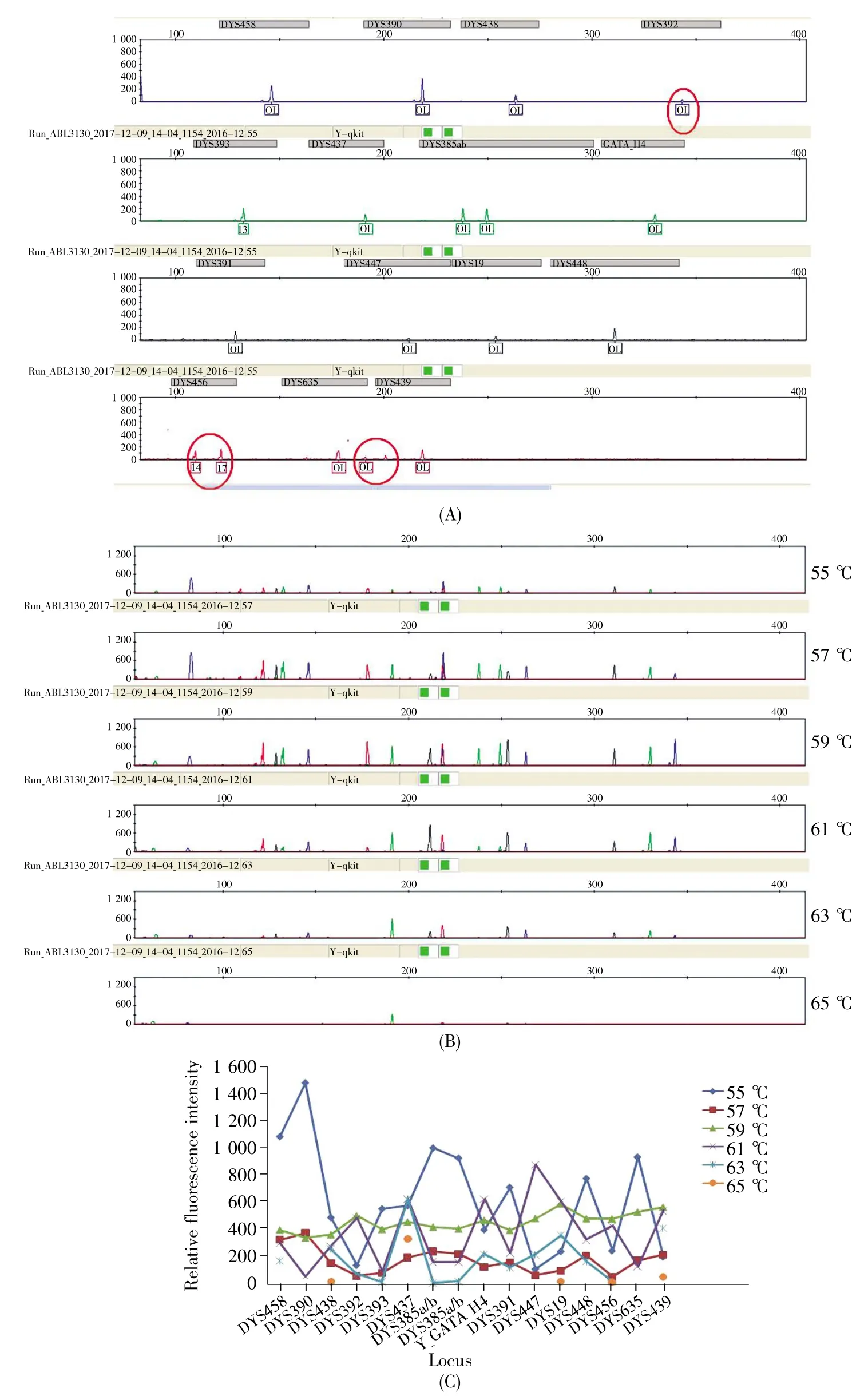
图6 不同退火温度下9948扩增产物的检测结果Fig.6 The results of the 9948 amplification products at different annealing temperatures

图7 不同缓冲液下PCR的9948产物的电泳图谱Fig.7 Electrophoresis profiles of the 9948 products of PCR under different buffers
2.8 案例样本的研究
本研究所构建的Y-STR快速复合扩增体系对300份日常积累检材扩增的检出率为100%。同时,我们用阅微基因有限公司的MRY29试剂盒、公安部物证鉴定中心的Y29试剂盒与我们所构建的Y-STR快速复合扩增体系对多种案例样本进行了交叉性对比验证,分型结果完全一致(图10)。此外,常规Y29试剂需要的扩增时间为3 h,MRY29需要96 min,而本研究所构建的快速扩增体系可在30 min内完成扩增。从以上分析可知,本研究构建的Y-STR快速体系在保证了分型准确的前提下,明显缩短了检验时间。
2.9 遗传多态性
Y-STR快速复合扩增体系的构建是为了在短时间内起到初步排查的目的,本研究同时对实验室收集的300份男性个体样本进行了遗传统计学分析;各基因座等位基因与单倍型检出频率采用直接计数法,基因多样性(genetic diversity,GD)值按公式(pi为各等位基因频率)计算[10]。结果表明Y-STR中的16个基因座的基因多态性(GD)在0.420至0.985之间(表6),其中DYS391最低为0.420,DYS385a/b最高为0.985,其余基因座的GD都在0.5以上,300名男性个体检测得到了298种单倍型,显示了很高的个体区分能力。
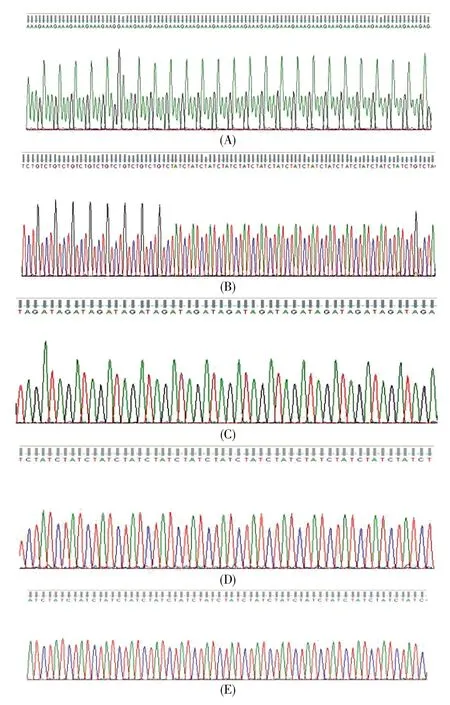
图8 Y-STR基因座的等位基因片段测序结果Fig.8 The allele sequences of Y-STR locus
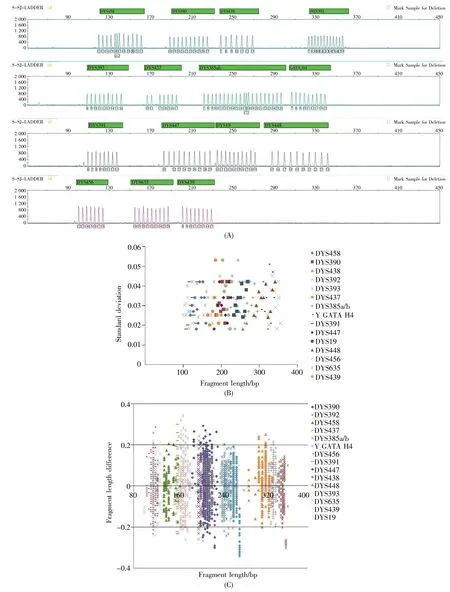
图9 等位基因allelic ladder与300份样本检测结果Fig.9 The testing results of allelic ladders and the 300 samples

图10 不同Y-STR试剂盒对同一烟蒂样本的扩增检测分型图Fig.10 The amplificationdetectionprofilesofthe samecigarette buttsample bythe MRY29,Y29 andY-STRrapidsystems
3 讨论
Y-STR基因座具有群体差异性,对欧洲人群个体识别能力高的单倍型并不一定对中国人群也高。近年来关于Y-STR的研究主要集中在某个特定地区的遗传多态性研究,缺乏对Y-STR快速体系构建的研究。虽然国内外均有许多商品化的快速试剂盒,但主要以常染色体试剂为主。而且,国内Y-STR快速试剂中PCR的扩增时间一般为一个半小时,仍然难以满足案件日益增长的需求。目前,快速PCR技术主要通过DNA聚合酶的改进、添加剂的研制及结合高性能的PCR扩增仪来实现短时间内的扩增[11]。本研究旨在首次在国内构建适合中国人群的Y-STR快速扩增体系。
在快速体系构建中,DNA聚合酶的活化程度和用量都对PCR的扩增起着关键性的作用。本研究中,我们在选择的最佳快速10 μL反应体系中分别加入0.1~0.4 μL热启动酶,实验结果均可得到16个STR基因座的完整分型,而且随着聚合酶用量的增加,扩增产物的峰高明显增强,峰之间的均衡性明显改善,考虑到实践样本中DNA纯度的差异和抑制物的存在,实验最终选择DNA聚合酶用量为0.4 μL,以确保分型成功率。在微调混合引物浓度时,发现FAM标记的DYS458和DYS392基因座的平衡性较差,将DYS392基因座引物体积从1.0 μL增加至7.0 μL时,峰高仍很低,无明显改善。其实,单扩DYS392时基因座峰高正常,而将其与DYS458复合扩增时,DYS392明显受到抑制,可能是两基因座的引物间形成了二聚体。实验中将变性时间从5 s延至7 s,结果显示抑制明显减弱,峰高增强。在PCR循环中,延伸时间主要取决于DNA聚合酶的延伸速率,本文构建的快速扩增体系的一个关键技术在于采用Roche快速热启动酶,它的优点是具有更高的耐变性温度、更高延伸活性和更快的延伸速率,可明显缩短整个PCR扩增时间[9]。本研究通过反复对比实验确定了快速扩增中各个最佳参数,最终获得STR分型完整、各基因座间峰高均衡较好、无非特异性扩增和等位基因丢失的扩增结果。
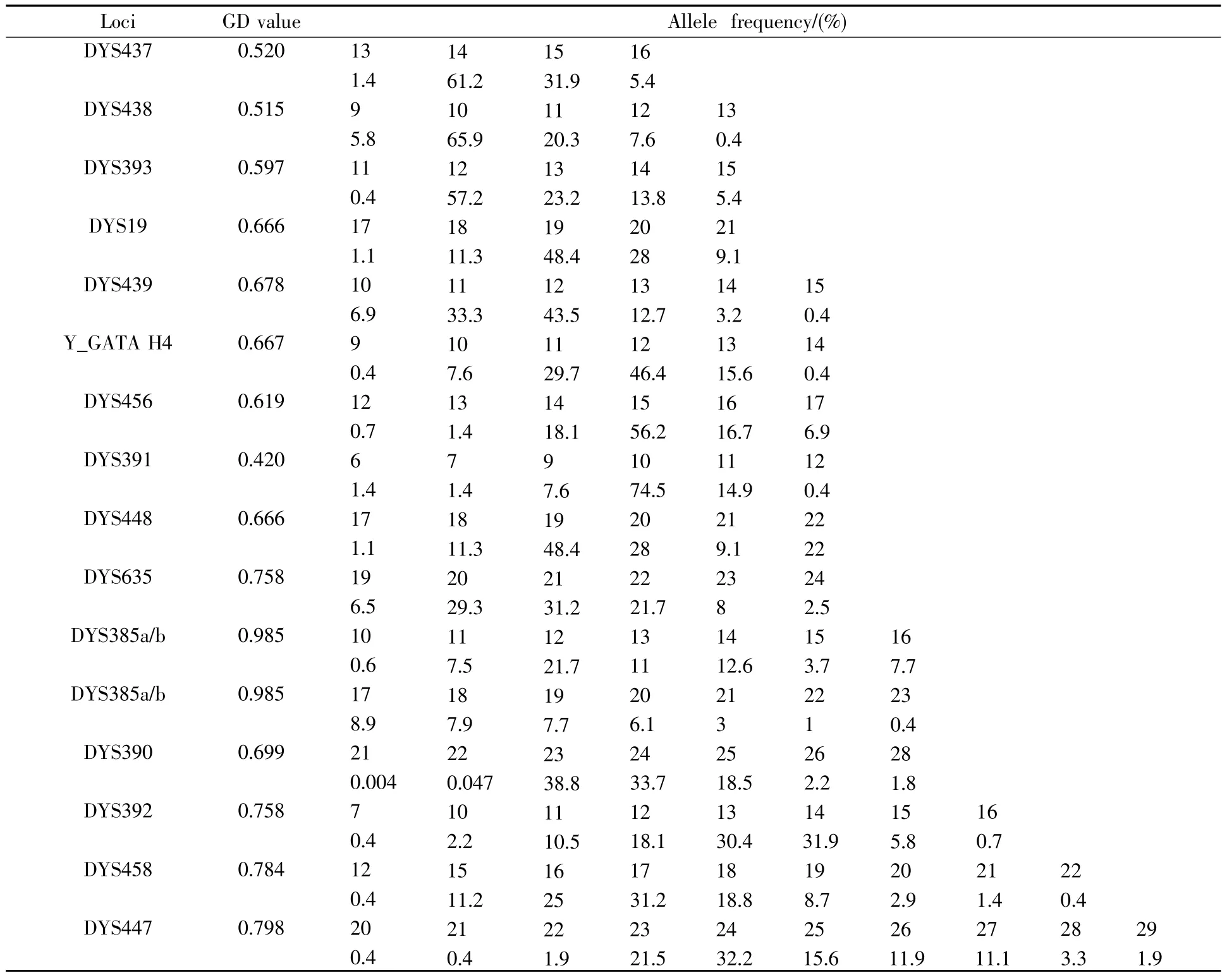
表6 300份男性样本中16个基因座的GD值Table6 The GD values of the 16 loci of 300 male samples
Mg2+是DNA聚合酶激活的必备因子,最佳Mg2+浓度可使PCR增扩反应的效率和特异性最佳[12,13]。同一缓冲液中,pH值的不同也会影响酶的活性,进而影响PCR扩增效率。本研究比较了14种不同pH不同Mg2+浓度缓冲液对PCR扩增反应的影响,通过比较分型完整性、峰高及各基因座间平衡性等参数,最终选择10×FastStart High Fidelity Reaction Buffer。
退火温度对PCR的扩增起着关键性的作用,解链温度(melting temperature,Tm)是DNA双链解旋至一半时所需要的温度,此时PCR引物的特异性最强,但是与模板DNA结合的能力最弱,为了平衡引物与模板特异性和结合能力,一般推荐退火温度为(Tm-10)~(Tm-5)℃[14],本文实验结果显示,59℃退火温度不但可以保证扩增效率,而且基因座间均衡性最佳。
为了评估构建的16个基因座的Y-STR快速体系的实际应用价值,本研究首先对其等位基因标准品ladder的精确性和准确性进行了评估,20次ladder电泳检测和300份样本扩增检验的等位基因相应位置均值和均差在0.5个核苷酸之内,说明我们所构建的体系能够精确并准确地对样本进行分型。
此外,采用本文所构建的Y-STR快速试剂对实验室收集的300份样本进行了检验,同时采用阳性对照Y29试剂盒进行平行验证,结果表明300份男性样本分型成功率为100%,且与Y29试剂盒结果完全一致。Y-STR快速试剂在保障样本分型准确的前提下将常规3 h的扩增时间缩短至30 min。对300份男性样本的遗传学研究表明16个Y-STR基因座具有识别不同个体的能力,可以在极短时间内用于家系排查和性犯罪案件,满足公安实战时效性的需求。
本研究首次在国内构建的Y-STR快速复合扩增体系可在短时间内获得特异性高、峰高均衡、STR分型准确的DNA结果,对公安实战中可疑人员初步快速的排查具有一定的现实意义。
致谢:本研究生物样本来源于国家人类遗传资源共享服务平台(YCZYPT[2017]01-3,Biological samples were provided by NICGR)。
参考文献(References):
[1]Prinz M,Boll K,Baum H,et al.Multiplexing of Y chromosome specific STRs and performance for mixed samples[J].Forensic Science International,1997,85(3):209-218.
[2]Redd A J,Agellon A B,Kearney V A,et al.Forensic value of 14 novel STRs on the human Y chromosome[J].Forensic Science International,2002,130(2-3):97-111.
[3]Zhu B,Liu S,Ci D,et al.Population genetics for Y-chromosomal STRs haplotypes of Chinese Tibetan ethnic minority group in Tibet[J].Forensic Science International,2006,161(1):78-83.
[4]朱传红,杨庆恩,王海生,等.DYS19、DYS391、DYS439基因座多态性及其荧光标记复合扩增检测的研究[J].中国人民公安大学学报(自然科学版)(Zhu Chuan-hong,Yang Qing-en,Wang Hai-sheng,et al.Study on polymorphism of DYS19,DYS391,DYS439 loci and its fluorescent labeling complex amplification[J].Journal of Chinese People′s Public Security U-niversity(Science and Technology)),2004,10(4):40-43.
[5]石美森,百茹峰,于晓军,等.广东汉族22个Y-STR基因座遗传多态性及遗传关系分析[J].遗传(Shi Mei-sen,Bai Rufeng,Yu Xiao-jun,et al.Polymorphism of 22 Y-STR loci in Guangdong Han population and genetic relation with 12 populations[J].Hereditas),2008,30(9):1136-1142.
[6]骆春芳,经广鑫,彭德华,等.广东龙川地区汉族人群17个Y-STR基因座遗传多态性[J].中国法医学杂志(Luo Chunfang,Jing Guang-xin,Peng De-hua,et al.Genetic polymor phisms of 17 Y-STR loci in the Han people in Longchuan district,Guangdong Province[J].Chinese Journal of Forensic Medicine),2015,30(3):305-306.
[7]Weng W,Liu H,Li S,et al.Mutation rates at 16 Y-chromosome STRs in the South China Han population[J].International Journal of Legal Medicine,2013,127(2):369-372.
[8]Verheij S,Harteveld J,Sijen T.A protocol for direct and rapid multiplex PCR amplification on forensically relevant samples[J].Forensic Science International Genetics,2012,6(2):167-175.
[9]Romsos E L,Vallone P M.Rapid PCR of STR markers:applications to human identification[J].Forensic Science International Genetics,2015,18:90-99.
[10]郑秀芬.法医DNA分析[M].北京:中国人民公安大学出版社(Zheng Xiu-fen.Forensic DNA Analysis[M].Beijing:Chinese People′s Public Security University Press),2003:89-90.
[11]韩俊萍,李洋,马原,等.快速PCR方法在法医DNA检验中的研究进展[J].生命科学研究(Han Jun-ping,Li Yang,Ma Yuan,et al.The research progress of the rapid PCR technology in forensic science),2017,21(5):442-449.
[12]黄银花,胡晓湘,徐慰倬,等.影响多重PCR扩增效果的因素[J].遗传(Huang Yin-hua,Hu Xiao-xiang,Xu Wei-zhuo,et al.Factors affecting multiple PCR amplification[J].Genetics),2003,25(1):65-68.
[13]Chevet E,Lematre G,Katinka M D.Low concentrations of tetramethylammonium chloride increase yield and specificity of PCR[J].Nucleic Acids Research,1995,23(16):3343-3344.
[14]Mullis K B,Faloona F A.Specific synthesis of DNAin vitrovia a polymerase-catalyzed chain reaction[J].Methods in Enzymology,1987,155:335-350.
