高脂高糖食物诱导中缅树鼩肥胖的研究
2018-06-02朱万龙侯东敏左木林王政昆
朱万龙,侯东敏,左木林,王政昆*
(1.云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室,中国云南昆明650500;2.云南师范大学生命科学学院,中国云南昆明650500)
哺乳动物体内脂肪主要分为白色脂肪组织(white adipose tissue,WAT)和褐色脂肪组织(brown adipose tissue,BAT)。WAT和BAT由很多群聚的脂肪细胞组成,其中结缔组织将这些成团的脂肪细胞分隔成小叶[1]。WAT广泛分布在动物体内[2],主要用于储存多余的能量,其含量显著增多是肥胖患者的主要特征[3]。褐色脂肪细胞(brown adipose cell,BAC)存在于小型哺乳动物和人类婴儿体内,一般分布在颈部深处、锁骨、肩胛、椎体区、靠近大血管区域[4]。BAC内富含线粒体,通过线粒体解偶联蛋白1(uncoupling protein-1,UCP1)产生热量,抵御低温和肥胖[5],消耗化学能[6~9]。
“米色脂肪”是在白色脂肪和肌肉中存在的一种诱导性棕色脂肪(inducible BAT),亦称为beige或brite,米色脂肪细胞可以表达产热基因UCP1,功能上与BAT类似[5]。在特定条件下(如锻炼或寒冷刺激),米色脂肪细胞会出现于WAT中[5],该变化称为WAT的“褐变”。米色脂肪细胞在接受一定的刺激后可以燃烧脂肪并产热,再加上成人以米色脂肪为主要产热脂肪,因此如何激活米色脂肪细胞并将其作为治疗肥胖症和糖尿病的靶细胞,已经受到越来越多的重视。相关研究表明人或者动物褐色和米色脂肪细胞增加的产热活性一直与肥胖抵抗密切相关[10~12]。现今,在人类和啮齿类动物的脂肪研究中已经证实,脂肪细胞表型之间存在“白色-米色-棕色”的相互转化[7,9,13]。
树鼩被现代医学列为实验动物模型,是一种有着蓬松尾巴、形似松鼠的小型哺乳动物。其进化程度较高,是除灵长类动物外,在解剖学、生理学等方面更接近于人类的动物,因此被医学和生物学研究者所喜爱,广泛应用于科学研究[14]。中缅树鼩(Tupaia belangeri)属攀鼩目(Scandentia)树鼩科(Tupaiidae),是分布在热带和亚热带地区的一种小型哺乳动物。高脂饮食条件下,动物WAT的变化趋势和规律与人类相似[5];现已在人体内证实了存在和BAT类似的棕色脂肪组织,但是活性在成年人体内不强[11];有研究证明冷驯化可以刺激人体内BAT的活性,当然,食物也可以诱导动物的BAT产热[12]。本研究通过测定体重、脂肪组织质量和血液指标等,研究中缅树鼩在高脂高糖食物条件下生理上的变化,再利用流式细胞术和正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)扫描成像来探究食物诱导条件下中缅树鼩是否会出现肥胖抵抗现象,以期为食物诱导中缅树鼩肥胖的研究提供一些基础生理学数据。
1 材料与方法
1.1 实验动物
实验用中缅树鼩30只,雌雄各半,普通级,均是非繁殖期成年个体,购自中国医学科学院医学生物学研究所灵长类研究中心。动物在云南师范大学生命科学学院动物饲养房单笼饲养,饲养笼的长×宽×高规格:120 mm×200 mm×300 mm。适应一个月后,30只中缅树鼩随机分为3组:10只(5 ,5♀)为对照组(0 d);10只(5 ,5♀)为食物诱导28 d组(28 d);10只(5 ,5♀)为食物诱导49 d组(49 d),置于温度为25±1℃,湿度为60%~70%,光暗周期为12 h∶12 h条件下饲养。实验前,3组动物的体重差异不显著(P>0.05),平均体重为96.35±1.27 g。对照组采用标准食物饲喂,食物诱导28 d组与49 d组均采用高脂高糖食物喂养。饲料配方见表1。
1.2 体重、WAT质量和含量测定
对照组动物的体重于0 d、28 d和49 d进行测定,食物诱导28 d组和49 d组动物的体重于28 d和49 d进行测定。28 d高脂高糖食物组动物于实验28 d时处死,对照组和49 d高脂高糖食物组动物于实验49 d时处死,用索氏抽提法(浸提仪SoxtecTM2043购自丹麦Foss公司)测量动物的体脂质量[15],最后计算出体脂含量,体脂含量=脂肪质量/体重[16]。
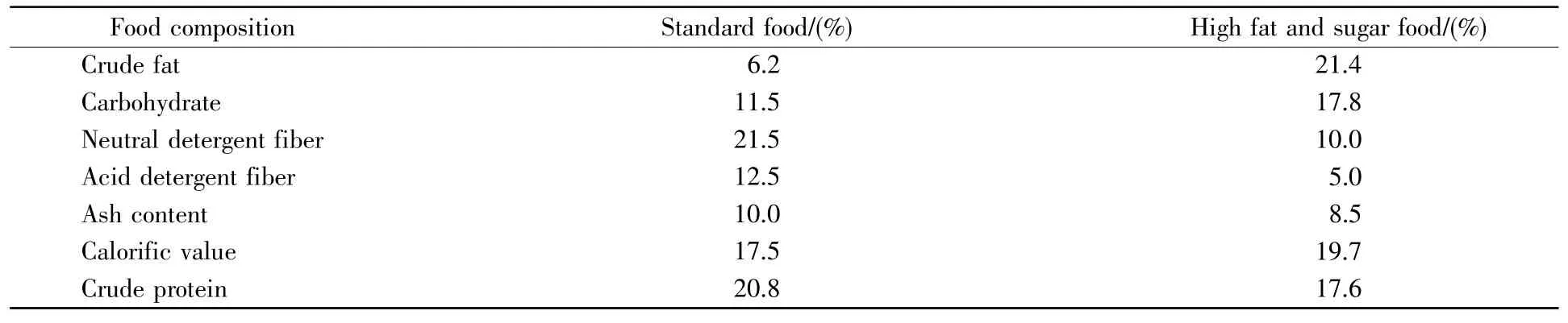
表1 饲养食物组成成分(占干物质质量的百分比)Table1 Compositions of standard and high-fat diets(the percentage of dry matter mass)
1.3 血液指标测定
对照组和49 d高脂高糖食物组于实验49 d进行空腹采血(禁食12 h),全血用凝集管收取,进行血常规检测,离心分离血清进行生化指标检测。血液指标的测定由云南医科大学完成。
1.4 流式细胞分析
1)树鼩断颈处死后用镊子取下腹部大网膜WAT与肩胛间BAT,放于装有PBS的培养皿中。
2)将培养皿中的WAT和BAT组织放入2 mL EP管中,加入1 mL 0.1%的I型胶原酶,剪碎组织;随后转至15 mL离心管,再加入3 mL 0.1%的I型胶原酶,摇匀后于37℃恒温水浴锅中放置1 h,其间每10 min摇匀一次。
3)吸取1 mL 0.1%的I型胶原酶,使用细胞过滤筛过滤。然后分别将WAT和BAT细胞液吸取入1.5 mL离心管中,1 000 r/min离心10 min。弃上清,加入1 mL PBS,吹吸混匀,1 000 r/min离心10 min。弃上清,加入1 mL PBS,吹吸混匀后静置,直至细胞滤液清澈,随后用4%多聚甲醛进行固定。固定后的细胞滤液-4℃冰箱保存不超过24 h。
4)WAT分为3组进行流式细胞分析:第1组加入Ⅰ抗UCP1与Ⅱ抗,标记UCP1阳性细胞;第2组加入Ⅰ抗CD137与Ⅱ抗,标记米色脂肪细胞;第3组为对照,加入Ⅱ抗。BAT分为2组进行流式细胞分析:第1组加入Ⅰ抗UCP1与Ⅱ抗,标记UCP1阳性细胞;第2组为对照,加入Ⅱ抗。流式细胞分析具体步骤:细胞滤液于1 000 r/min离心10 min,吸取上清液,加入200 μL 0.1%的Triton X-100,静置5 min;1 000 r/min离心 10 min,去除Triton X-100,加入200 μL PBS,吹吸混匀;在WAT和BAT实验组1中加入0.5 μL I抗UCP1(Jackson ImmunoResearch Laboratories,Inc.,美国),在WAT实验组2中加入0.5 μL I抗CD137(Ray-Biotech公司,美国),吹吸混匀,静置40 min~1 h;1 000 r/min离心 10 min,去除 PBS,再加 200 μL PBS,1 000 r/min离心10 min,去除PBS,再加入1 000 μL PBS,吹吸混匀后,加入0.5 μL Ⅱ抗免疫荧光,静置40 min~1 h;1 000 r/min离心10 min,去除PBS,再加200 μL PBS,1 000 r/min离心10 min,去除PBS,再加入1 000 μL PBS。WAT实验组3和BAT实验组2中加入0.1%的Triton X-100 200 μL,静置 40 min~1 h,1 000 r/min 离心 10 min,去除Triton X-100,加入200 μL PBS,吹吸混匀,加入0.5 μLⅡ抗,用锡箔纸将离心管包裹避光,轻轻弹离心管,吹吸混匀,静置40 min~1 h,1 000 r/min离心10 min,去除PBS,再加入1 000 μL PBS。最后采用流式细胞分析仪(Guava公司,美国)进行检测。
1.5 PET/CT扫描成像
首先是18氟-氟化脱氧葡萄糖(18-fluoro-fluorodeoxyglucose,18F-FDG)注射:用剃毛器将尾部毛发剃净,然后用500 μL注射器吸取18F-FDG,注射入中缅树鼩尾部静脉。注射40 min后用1 000 μL注射器吸取200 μL浓度为2%的戊巴比妥钠麻醉树鼩(5 min左右动物即可被麻醉)。将中缅树鼩四肢放入固定板的固定绳中进行固定,在其麻醉无意识状态下进行PET/CT扫描(GE公司,美国),共扫描5 min。
1.6 数据处理
采用SPSS 11.5软件包进行实验数据的统计分析。数据经过正态分布和方差齐次性检验,符合参数检验条件。对照组中缅树鼩的体重在0 d、28 d和49 d时差异不显著,因此在分析时合并。中缅树鼩体重、WAT质量和含量采用单因素方差分析(One Way ANOVA)进行统计分析。对照组、28 d实验组、49 d实验组中缅树鼩的肩胛和腹股沟所采集的图像使用软件IRW(Inveon Research Workplace)进行分析,分别计录各部位的平均辐射值(standardized uptake value,SUV),并进行单因素方差分析(One Way ANOVA)。所有实验结果以平均值±标准误(x±sx)表示。P<0.05 代表差异显著;P<0.01代表差异极显著。
2 结果
2.1 体重、WAT质量和含量
28 d组和49 d组中缅树鼩体重分别与对照组相比增加了36.61%和53.87%(图1)。高脂高糖食物组28 d时中缅树鼩WAT质量是对照组的3.7倍,49 d组中缅树鼩WAT质量是对照组的6.4倍(图2)。28 d组中缅树鼩体脂含量是对照组的2.7倍,49 d组中缅树鼩体脂含量是对照组的3.2 倍(图3)。

图1 高脂高糖食物条件下中缅树鼩体重的变化Fig.1 Changes of body mass in T.belangeri during highglucose-fat diet acclimation
2.2 血液指标
49 d实验组中,中缅树鼩的血糖水平极显著高于对照组(P<0.01),甘油三酯含量显著高于对照组(P<0.05),高密度脂蛋白含量显著低于对照组(P<0.05),总胆固醇含量极显著高于对照组(P<0.01)(表2)。与此同时,49 d实验组的白细胞、血红蛋白以及红细胞与对照组相比均无显著差异,但血小板水平极显著高于对照组(P<0.01)(表2)。
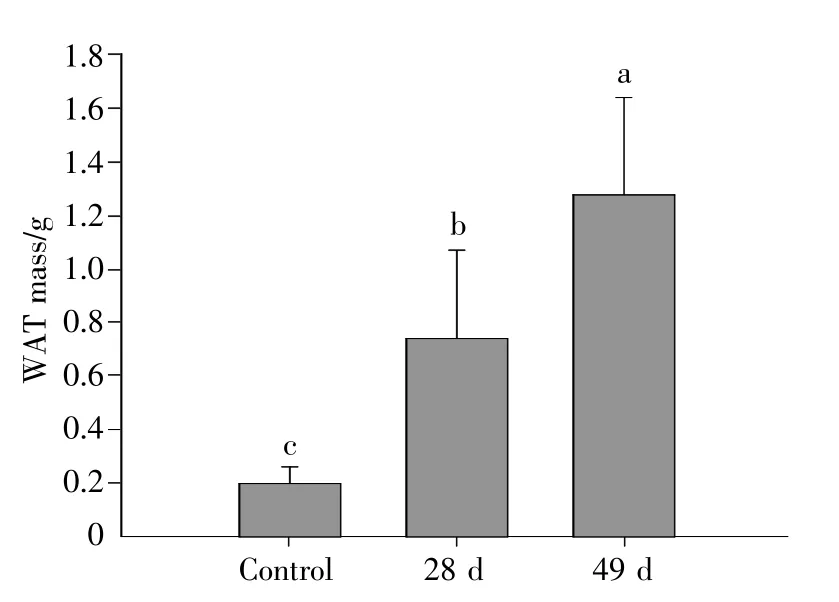
图2 高脂高糖食物条件下中缅树鼩WAT质量的变化Fig.2 Changes of WAT mass in T.belangeri during high-glucose-fat diet acclimation

图3 高脂高糖食物条件下中缅树鼩WAT含量的变化Fig.3 Changes of WAT content in T.belangeri during high-glucose-fat diet acclimation
2.3 流式细胞分析结果
对照组中缅树鼩腹部WAT利用UCP1抗体标记,R2群标记阳性为1.68%;高脂高糖食物28 d组树鼩腹部WAT被UCP1抗体标记后,有36.33%的细胞为阳性;高脂高糖食物49 d组树鼩腹部WAT被UCP1抗体标记后细胞阳性为3.74%(图4)。利用CD137抗体标记对照组中缅树鼩腹部WAT,R2群标记阳性为0.55%;高脂高糖食物28 d组树鼩腹部WAT被CD137抗体标记后,有4.51%的细胞为阳性;高脂高糖食物49 d组树鼩腹部WAT被CD137抗体标记后细胞阳性为0.84%(图5)。对照组中缅树鼩肩胛BAT的R2群用UCP1抗体标记后,有3.54%的细胞显示为阳性;高脂高糖食物诱导28 d时,中缅树鼩肩胛BAT中R2群被UCP1抗体标记的阳性细胞为36.33%;高脂高糖食物诱导49 d组的R2群用UCP1抗体标记后,有13.34%的细胞显示为阳性(图6)。

表2 中缅树鼩血糖血脂生化指标和血常规指标检测结果Table2 The detection results of blood glucose,lipid biochemical indexes and blood routine indexes in T.belangeri
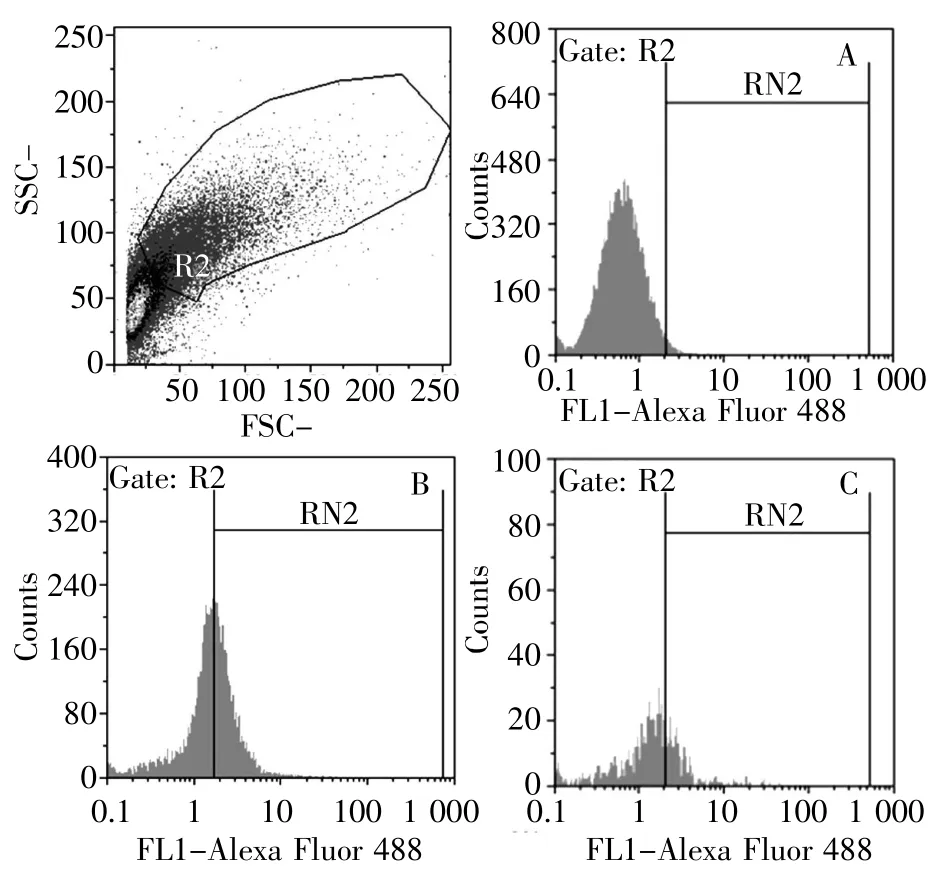
图4 中缅树鼩腹部皮下WAT流式分析图(抗体:UCP1)Fig.4 The flow cytometric analysis diagram of WAT in T.belangeri abdomen(Antibody:UCP1)
2.4 PET/CT扫描成像结果

图5 中缅树鼩腹部皮下WAT流式分析图(抗体:CD137)Fig.5 The flow cytometric analysis diagram of WAT in T.belangeri abdomen(Antibody:CD137)

图6 中缅树鼩腋下BAT流式分析图(抗体:UCP1)Fig.6 The flow cytometric analysis diagram of BAT in T.belangeri armpit(Antibody:UCP1)
食物诱导28 d组中缅树鼩腹部WAT的18FFDG吸收60 min后,平均辐射值SUV是对照组的2.4倍,49 d组平均辐射值SUV是对照组的1.2倍。食物诱导28 d组中缅树鼩腹股沟WAT中出现FDG药物吸收的增加,说明其代谢增强(图7)。食物诱导28 d组中缅树鼩肩胛BAT的18F-FDG吸收60 min后,平均辐射值SUV是对照组的5.3倍,49 d组平均辐射值SUV是对照组的2.6倍,提示食物诱导28 d时中缅树鼩肩胛BAT活性增强(图8)。

图7 中缅树鼩WAT FDG摄取分布图Fig.7 The distribution of FDG in WATs of T.belangeri
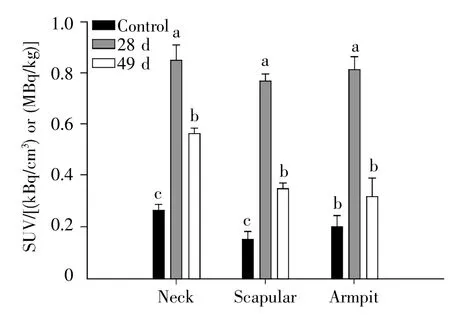
图8 中缅树鼩BAT FDG摄取分布图Fig.8 The distribution of FDG in BATs of T.belangeri
3 讨论
产生肥胖的因素很多,人类的肥胖与高脂、高糖这些高热量的食物有关[17]。由于高脂高糖饮食诱导动物模型的肥胖与人类肥胖的形成相似,所以目前常用高脂食物育肥法建立动物肥胖模型[12]。本研究利用高脂高糖食物构建中缅树鼩肥胖模型,数据显示中缅树鼩随着实验时间的延长体重显著增加,在28 d时,体重差异达到极显著水平。先前的研究结果表明,中缅树鼩在季节性或者不同温度光照条件下,其体重的增加可能和WAT质量的增加有关[14]。本研究的结果表明中缅树鼩在高脂高糖食物作用下其体重的增加也可能与WAT质量的增加有关,28 d组和49 d组中缅树鼩的体脂质量和含量与对照组相比均是差异极显著,这可能说明高糖高脂食物可以显著增加中缅树鼩的体重,使其出现肥胖特征。此外,评价人类或者动物是否出现肥胖的血液指标有葡萄糖(GLU)、总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等[18]。本研究结果表明49 d组中缅树鼩的血糖水平、甘油三酯和总胆固醇含量显著高于对照组,而高密度脂蛋白含量显著低于对照组。甘油三酯含量过高或高密度脂蛋白含量过低,均表明中缅树鼩的血脂出现异常。以上血液指标差异说明中缅树鼩在长期的高脂高糖饮食条件下血糖血脂发生了改变,已经出现了肥胖的相关症状。
Barbatelli等[19]将小鼠进行冷暴露处理,发现冷驯化下小鼠体内白色脂肪细胞的C/EBP α基因表达增加,但是与细胞有丝分裂相关的基因却基本维持稳定水平,同时结合米色脂肪组织超显微结构结果,证实冷驯化可以诱导WAT中出现米色脂肪细胞。而Tim等[20]利用流式细胞仪进行研究后发现,他们分选出的前体骨骼肌细胞可以用药物诱导分化成米色脂肪细胞。此外,有研究通过PET/CT扫描发现,冷暴露处理后成人体内锁骨上部区域BAT的FDG吸收显著增加[21];冷暴露2 h后,实验人群中BAT的存在比例也显著升高[22];还有研究表明BAT的活性在寒冷季节(1~3月,13.7%)较温暖季节(4~12 月,4.1%)更加活跃[23]。本研究中流式细胞检测结果表明,高脂高糖食物诱导使中缅树鼩WAT在28 d时UCP1和CD137表达阳性的细胞群增多,而在49 d表达阳性的细胞群减少,这可能说明高脂高糖食物可以诱导中缅树鼩WAT在28 d时出现米色脂肪细胞,米色脂肪细胞或UCP1蛋白的表达可以短时间产生肥胖抵抗的现象[19,20,24]。而在BAT细胞中,食物诱导同样使BAT在28 d时UCP1表达阳性的细胞群增多,说明食物可以诱导BAT产热的增加,同样出现了抵抗肥胖现象。PET/CT扫描结果显示,WAT在28 d时18F-FDG吸收增强,这可能是中缅树鼩WAT中产生了米色脂肪细胞或褐色脂肪细胞导致[11,21,23,25,26]。但是随着时间的延长,中缅树鼩的肥胖抵抗现象减弱。
综上所述,高糖高脂食物可以显著增加中缅树鼩WAT的质量,而流式细胞检测和PET/CT扫描成像研究结果说明中缅树鼩在肥胖的过程中,28 d时会出现肥胖抵抗的现象,但是随着时间的延长,该抵抗现象逐渐减少。
参考文献(References):
[1]周显.脂肪组织制片的改良方法[J].临床与实验病理学杂志(Zhou Xian.Improved method for producing adipose tissue[J].Chinese Journal of Clinical and Experimental Pathology),2009,25(2):216-217.
[2]Tseng Y H,Cypess A M,Kahn C R.Cellular bioenergetics as a target for obesity therapy[J].Nature Reviews Drug Discovery,2010,9(6):465-482.
[3]Vickers S P,Jackson H C,Cheetham S C.The utility of animal models to evaluate novel anti-obesity agents[J].British Journal of Pharmacology,2011,164(4):1248-1262.
[4]杨吉刚,袁磊磊,阚英,等.棕色脂肪组织在体内的分布及FDG PET/CT扫描中的影响因素[J].临床和实验医学杂志(Yang Ji-gang,Yuan Lei-lei,Kan Ying,et al.The distribution of brown adipose tissuein vivoand the influencing factors in FDG and PET/CT scan[J].Journal of Clinical and Experimental Medicine),2013,12(24):2030-2033.
[5]Wu J,Bostr M P,Sparks L M,et al.Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human[J].Cell,2012,150(2):366-376.
[6]Guerra C,Koza R A,Yamashita H,et al.Emergence of brown adipocytes in white fat in mice is under genetic control.Effects on body weight and adiposity[J].Journal of Clinical Investigation,1998,102(2):412-420.
[7]Lowell B B,S-Susulic V,Hamann A,et al.Development of obesity in transgenic mice after genetic ablation of brown adipose tissue[J].Nature,1993,366(6457):740-742.
[8]Lowell B B,Spiegelman B M.Towards a molecular understanding of adaptive thermogenesis[J].Nature,2000,404(6788):652-660.
[9]Spiegelman B M,Flier J S.Obesity and the regulation of energy balance[J].Cell,2001,104:531-543.
[10]倪鸣,王金焱,王璟.白色脂肪组织棕色化调控机制的研究进展[J].医学研究生学报(Ni Ming,Wang Jin-yan,Wang Jing.Advances in molecular mechanisms of browning of white adipose tissue[J].Journal of Medical Postgraduates),2015,28(7):771-775.
[11]Cypess A M,Lehman S,Williams G,et al.Identification and importance of brown adipose tissue in adult humans[J].New England Journal of Medicine,2009,360(15):1509-1517.
[12]Lee Y H,Petkova A P,Mottillo E P,et al.In vivoidentification of bipotential adipocyte progenitors recruited by beta3-adrenoceptor activation and high-fat feeding[J].Cell Metabolism,2012,15(4):480-491.
[13]Kopecky J,Clarke G,Enerback S,et al.Expression of the mitochondrial uncoupling protein gene from the aP2 gene promoter prevents genetic obesity[J].The Journal of Clinical Investigation,1995,96(6):2914-2923.
[14]Zhang L,Yang F,Wang Z K,et al.Role of thermal physiology and bioenergetics on adaptation in tree shrew(Tupaia belangeri)the experiment test[J].Scientific Reports,2017,7:41352.
[15]Li X S,Wang D H.Regulation of body weight and thermogenesis in seasonally acclimatized Brandt’s voles(Microtus brandti)[J].Hormones and Behavior,2005,48(3):321-328.
[16]Zhu W L,Wang Z K.Resting metabolic rate and energetics of reproduction in lactatingEothenomys miletusfrom Hengduan mountain region[J].Zoological Studies,2014,53:41.
[17]Hill J O.Understanding and addressing the epidemic of obesity:an energy balance perspective[J].Endocrine Reviews,2006,27(7):750-761.
[18]朱万龙,孙舒然,王政昆.冷驯化对中缅树鼩白色脂肪组织和血液生理生化指标变化的影响[J].云南师范大学学报(自然科学版)(Zhu Wan-long,Sun Shu-ran,Wang Zheng-kun.Effects of cold acclimation on white adipose tissue,blood physiological and biochemical indexes inTupaia belangeri[J].Journal of Yunnan Normal University(Natural Sciences Edition)),2017,37(1):64-67.
[19]Barbatelli G,Murano I,Madsen L,et al.The emergence of coldinduced brown adipocytes in mouse white fat depots is determined predominantly by white to brown adipocyte transdifferentiation[J].American Journal of Physiology.Endocrinology and Metabolism,2010,298(6):E1244-E1253.
[20]Tim J S,Tian L H,Thien T T,et al.Identification of inducible brown adipocyte progenitors residing in skeletal muscle and white fat[J].Proceedings of the National Academy of Sciences USA,2011,108(1):143-148.
[21]Van Marken Lichtenbelt W D,Vanhommerig J W,Smuldem N M,et al.Cold-activated brown adipose tissue in healthymen[J].New England Journal of Medicine,2009,360(15):1500-1508.
[22]李永国,颜忠诚,王德华.人体内褐色脂肪组织及其生理功能[J].生理科学进展(Li Yong-guo,Yan Zhong-cheng,Wang De-hua.Brown adipose tissue in human and its potential physi ological significanc[J].Progress in Physiological Sciences),2011,42(2):100-103.
[23]Enerbäck S.Human brown adipose tissue[J].Cell Metabolism,2010,11(4):248-252.
[24]Tran K V,Gealekman O,Frontini A,et al.The vascular endothelium of the adipose tissue gives rise to both white and brown fat cells[J].Cell Metabolism,2012,15(2):222-229.
[25]Virtanen K A,Lidell M E,Orava J,et al.Functional brown adiposetissueinhealthyadults[J].New England Journal of Medicine,2009,360(15):1518-1525.
[26]Timmons J A,Pedersen B K.The importance of brown adipose tissue[J].New England Journal of Medicine,2009,361(4):415-416.
