潞党参多糖的抗补体活性分析
2018-06-02胡建燃史宝忠
李 平,胡建燃,史宝忠
(长治学院生物科学与技术系,中国山西长治046011)
补体系统是人体重要的防御系统之一,在抵御病原微生物、清除机体代谢废物以及调节免疫应答中发挥关键作用。然而,在某些情况下,补体系统可能被异常激活,诱发多种疾病,包括风湿及类风湿性关节炎、系统性红斑狼疮、移植中的超急性排斥反应等[1]。同时,急性呼吸窘迫综合征、急性心肌梗死等急性疾病也可能是补体系统异常激活所导致[2]。另外,已有研究发现重症非典型性肺炎(severe acute respiratory syndrome,SARS)也与补体系统的过度激活有关[3,4]。由此可见,抑制补体系统活性是治疗上述疾病的重要途径之一。
目前,临床上使用的免疫抑制剂主要包括环磷酰胺、糖皮质激素、甲胺蝶呤等。这些药物在一定程度上能够缓解补体过度激活所诱发的疾病,但是长期使用则可能产生多种副作用和并发症[5,6]。因此,寻找高效低毒的新型补体抑制剂成为临床治疗该类疾病的当务之急。有研究表明,药用植物中广泛存在着具有抗补体活性的成分,包括多糖、蛋白质、生物碱、黄酮、甾类等[7],这些天然活性成分大多对机体低毒,且可被机体直接消化吸收。因此,从药用植物中寻找新型高效的抗补体物质具有重要意义。
党参是名贵的传统中药材,为桔梗科植物党参、素花党参或川党参的干燥根,分布广泛。潞党参主要分布于山西省东南部长治地区,品质甚优,自古即被视为党参中的珍品,发挥益气养血、生津健脾、益肺消渴之功效。现代医学认为,党参具有抗氧化、抗肿瘤、抗炎、抗病毒等药理作用,而多糖是其主要活性成分[8]。目前,关于党参多糖在免疫系统调节方面的作用研究逐渐受到重视。例如:王爱青[9]的研究表明党参多糖能够改变大鼠血清中IL-2、IL-6等免疫因子的水平,改善其肾阴虚症状;李开菊等[10]认为素花党参多糖能够显著提高乌鸡体内的法氏囊指数水平,增强其机体免疫功能;王希春等[11]研究发现在饲料中添加1%~2%的党参多糖能够显著提高仔猪血清中IFN-γ、IL-2、IL-4和IL-6的水平以及小肠黏膜分泌SIgA的水平,改善仔猪的生长性能;有研究发现,硒化党参多糖能够有效提高鸡和小鼠外周血中的免疫因子含量,增强其免疫功能[12,13];余兰等[14]研究发现道真洛龙党参多糖可通过提高胸腺和脾脏指数,减轻环磷酰胺所致小鼠免疫功能抑制。然而,关于潞党参多糖在免疫调节方面的研究,目前尚未见报道。
在前期工作中,本研究室优化了潞党参多糖(LuCodonopsis pilosulapolysaccharides,LCPP)的提取方法,并对LCPP的生理活性进行了初步探索,发现LCPP具有良好的体外抗氧化活性[15]以及一定的抑制人宫颈癌细胞SiHa增殖和迁移的作用[16]。但是,关于LCPP影响补体系统活性的研究鲜见报道。本研究采用溶血法、实时定量PCR等技术探讨LCPP的抗补体活性,旨在为寻求新型天然补体抑制剂开辟路径,同时为潞党参的深层次开发提供参考。
1 材料与方法
1.1 仪器
多功能酶标仪SpectraMax M2(美谷分子仪器(上海)有限公司);5805台式高速离心机(北京博瑞祥腾科技有限公司);KQ-250医用超声波清洗器(昆山市超声仪器有限公司);BSA 124S-CW电子天平(赛多利斯科学仪器(北京)有限公司);CO2培养箱(美国Thermo Fisher Scientific公司);细胞计数仪Cellometer Auto1000(美国Nexcelom公司);倒置显微镜CKX41-C31BF(日本Olympus公司);高速冷冻离心机(日本HITACHI公司);StepOne-Plus型实时定量PCR仪(美国Thermo Fisher Scientific公司)。
1.2 材料与试剂
潞党参购自长治市万民药房;绵羊红细胞(sheep red blood cell,SRBC)、绵羊红细胞溶血素、巴比妥酸等购自南京森贝伽生物科技有限公司;豚鼠血清购自广州鸿泉生物科技有限公司;肝素钠、EGTA等购自北京依托华茂生物科技有限公司;人肝癌细胞HepG2购自中国科学院上海生命科学研究院细胞资源中心;DMEM培养基购自北京索来宝生物科技有限公司;胎牛血清购买于杭州四季青生物工程材料有限公司;TRIzol试剂购自美国Invitrogen公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)购自美国 Sigma公司;逆转录试剂盒及SYBR®Premix Ex TaqTMGC试剂盒购自宝生物工程(大连)有限公司。
1.3 实验方法
1.3.1 LCPP的提取
参照文献报道方法[15],利用微波辅助的乙醇沉淀法提取LCPP,并通过Sevag法和透析法去除蛋白质、小分子等杂质,精制多糖。
1.3.2 经典途径抗补体活性(CH50)测定
先用1×巴比妥酸溶液(1×BBS溶液)将豚鼠血清(补体)稀释10倍,然后继续对倍稀释成1∶20、1∶40、1∶80、1∶160、1∶320、1∶640 和 1∶1 280共7个浓度梯度的溶液。实验分为补体组(complement group)和全溶血组(hemolysis group),按照表1,补体组依次准确加入1×BBS溶液、补体(complement)、溶血素(hemolysin)和2%绵羊红细胞(SRBC),轻柔混匀;全溶血组则依次加入蒸馏水和2%SRBC,轻柔混匀。然后,将补体组和全溶血组均置于37℃孵育30 min,4℃下5 000 r/min离心10 min后每个反应体系吸取200 μL上清液置于96孔板中,利用酶标仪测定405 nm处的光吸收值(OD405)。以全溶血组的OD405值为标准,计算绵羊红细胞溶血率,溶血率(%)=补体组OD405值/全溶血组OD405值×100%,选择溶血率接近100%的最低补体浓度为临界浓度。补体组中每个浓度梯度以及全溶血组均做3个重复。
用1×BBS溶液溶解精制的LCPP,制成浓度为25 mg/mL的溶液。继续用1×BBS溶液,按照2倍、4倍、8倍、16倍、32倍、64倍和 128倍的比例对上述LCPP溶液进行梯度稀释。然后,设置实验组(test group)共7个浓度梯度,对应7个对照组(control group),以及1个临界点浓度的补体组,每组设置3个重复。按照表2加入各试剂后(操作同表1),测定OD405值,计算溶血抑制率,溶血率抑制率 (%)=1-(补体组OD405值-对照组OD405值)/补体组OD405值×100%,然后利用SPSS 10.0软件计算CH50值。
1.3.3 旁路途径抗补体活性(AP50)测定
参照文献方法[17],取健康成年男性静脉血10 mL,以及家兔(约2.5 kg)动脉血2 mL,制备人血清和0.5%兔红细胞(rabbit red blood cell,RRBC),置于4℃冰箱保存备用,并配制旁路途径(alternative pathway,AP)缓冲液,对人血清(补体)进行5倍稀释,然后依次对倍稀释为10倍、20倍、40倍、80倍、160倍、320倍和640倍的溶液。按照表3加入各试剂,轻柔混匀,置于37℃孵育30 min,然后在4℃下5 000 r/min离心10 min,每个反应体系吸取200 μL上清液置于96孔板中,利用酶标仪测定OD405值,以全溶血组的OD405值为标准,计算兔红细胞溶血率,选择溶血率接近100%的最低补体浓度为临界浓度。
用AP溶液配制浓度为25 mg/mL的LCPP溶液,然后按照2倍、4倍、8倍、16倍和32倍的比例,用AP溶液对上述LCPP溶液进行梯度稀释,按照表4加入各试剂后(操作同上),测定OD405值,计算溶血抑制率,然后计算AP50值。
1.3.4 HepG2细胞的处理及real-time PCR实验
用胰酶-EDTA溶液消化指数增长期的人HepG2细胞,成单细胞悬液,接种到Φ35 mm细胞培养皿中,待汇合率达到60%时,分别在加入和不加入LCPP情况下,用终浓度为50 ng/mL的TNF-α处理细胞,在不同时间点收集细胞,并按照TRIzol试剂说明书提取总RNA,利用逆转录试剂盒合成cDNA,保存于-70℃冰箱备用。
利用表5中所列的引物,按照SYBR®Premix Ex TaqTMGC试剂盒说明书配制反应体系,反应条件为95℃5 min;95℃5 s;60℃30s;40个循环。利用2-△△Ct方法计算基因mRNA的相对水平。

表1 经典途径补体临界浓度的确定(mL)Table1 Identification of the critical concentration of complement in the classical pathway(mL)

表2 补体经典途径溶血实验(mL)Table2 Hemolysis assay of the classical pathway(mL)

表3 旁路途径中补体临界浓度的确定(mL)Table3 Identification of the critical concentration of complement in the alternative pathway(mL)

表4 补体旁路途径溶血实验(mL)Table4 Hemolysis assay of the alternative pathway(mL)
1.4 统计学处理
每个反应体系均设有3个重复,统计结果用平均值±标准差±s)表示。利用SPSS 10.0软件对所得数据进行处理,并进行t检验。
2 结果与分析
2.1 LCPP经典途径抗补体活性
2.1.1 经典途径补体临界点浓度的确定
红细胞在发生轻微溶血和接近完全溶血时,补体量的变化不能使溶血程度有显著改变,即溶血对补体量的变化不敏感。为检测LCPP是否对补体所引起的溶血过程产生影响,需确定本实验体系中溶血发生突跃的补体稀释区间,选择适宜的补体浓度进行后续实验。将不同稀释倍数的豚鼠血清(补体)分别与2%的绵羊红细胞以及1 000倍稀释的绵羊红细胞溶血素混合,测定OD405值,计算溶血率。以溶血率为纵坐标,稀释倍数为横坐标绘制折线图。如图1所示,当补体稀释80倍时,溶血率为88.42%,稀释倍数超过80后,溶血率显著下降,因此,在后续实验中选择80倍稀释的豚鼠血清作为补体使用。
2.1.2 LCPP对补体经典途径的影响
用1×BBS溶液将LCPP和肝素钠分别配制成25 mg/mL和0.5 mg/mL的溶液,然后继续用1×BBS溶液将二者按照2倍、4倍、8倍、16倍、32倍、64倍和128倍进行梯度稀释。通过绵羊红细胞溶血实验,以肝素钠为阳性对照,检测LCPP对补体经典途径的影响。结果如图2所示,LCPP对补体经典途径具有抑制作用,经计算CH50为2.061±0.127 mg/mL,肝素钠CH50值为0.056±0.004 mg/mL,P<0.01。
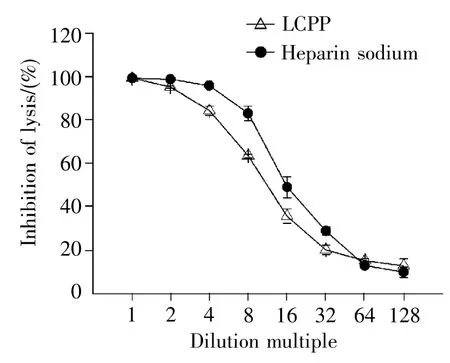
图2 LCPP对补体经典途径的抑制效应Fig.2 Anti-complementary activities of LCPP on the classical pathway
2.2 LCPP对补体旁路途径的影响
2.2.1 旁路途径补体临界点浓度的确定
按照表3中的体积,将不同浓度的人血清、0.5%的兔血清以及AP溶液混合,测定兔红细胞溶血率。结果如图3所示,人血清稀释10倍时,溶血率为93.20%,当稀释倍数继续增大,溶血率显著下降。因此,在后续实验中,以10倍稀释的人血清作为补体使用。
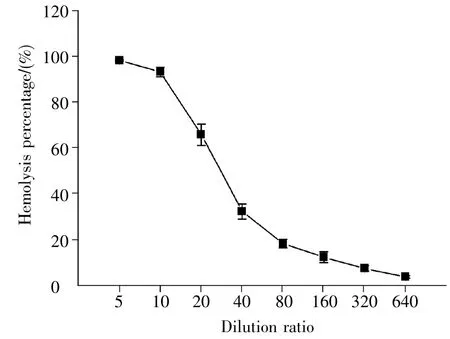
图3 不同稀释倍数的人血清在补体旁路途径中的效价Fig.3 The hemolysis capacities of the different dilutions of human sera on the alternative pathway

表5 Real-time PCR引物信息Table5 Amplification primers for real-time PCR
2.2.2 LCPP对补体旁路途径的抑制效应
用AP溶液分别配制25 mg/mL的LCPP溶液和0.5 mg/mL的肝素钠溶液,并继续按照2倍、4倍、8倍、16倍和32倍对二者进行梯度稀释。以肝素钠溶液为阳性对照,通过兔红细胞溶血实验,检测LCPP对补体旁路途径活性的影响。结果如图4所示,LCPP对补体旁路途径具有抑制作用,经计算 AP50值为 6.725±0.895 mg/mL,肝素钠AP50值为 0.075±0.005 mg/mL,P<0.01。

图4 LCPP对补体旁路途径活性的影响Fig.4 Anti-complementary activities of LCPP on the alternative pathway
2.3LCPP对TNF-α诱导的C3表达水平的影响
用TNF-α(终浓度50 ng/mL)刺激人 HepG2细胞,然后通过实时定量PCR检测补体成分C3的mRNA水平,结果如图5所示,随着TNF-α处理时间的延长,C3 mRNA表达量逐渐增加。若用LCPP和TNF-α同时处理HepG2细胞24 h,C3的mRNA水平则与LCPP的浓度呈负相关(图6),这种抑制作用呈现明显的剂量依赖性。上述结果表明,LCPP能够拮抗TNF-α诱导的补体因子C3水平的升高。

图5 TNF-α对人HepG2细胞补体成分C3表达的影响Fig.5 Effect of TNF-α on C3 expression in HepG2 cells
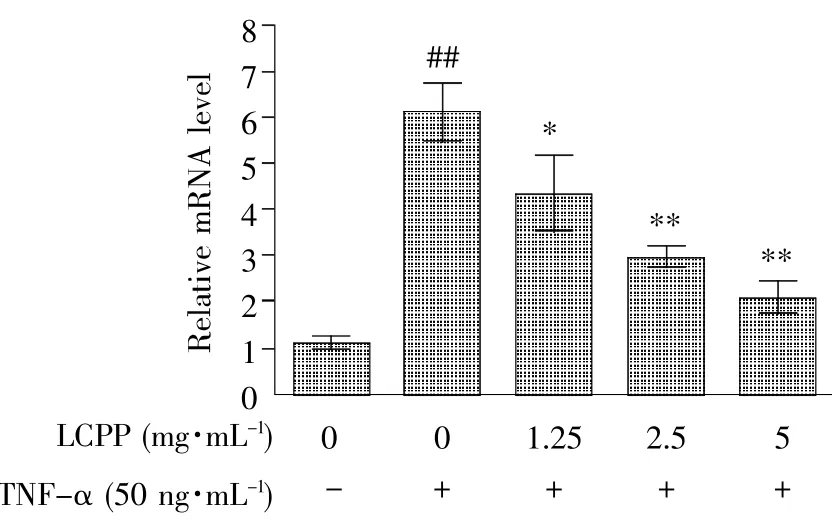
图6 LCPP抑制TNF-α诱导的人HepG2细胞中C3的表达Fig.6 LCPP suppressed C3 expression in TNF-α-me原diated HepG2 cells
3 讨论
补体系统是动物免疫系统的重要组成部分,其中,经典途径的主要参与因子是C1~C9,旁路途径的主要参与因子为C3、C5~C9以及P因子和B因子等。肝素及其衍生物是一类临床上常见的抗凝血剂,同时也具有强大的抗补体作用[18],其主要通过与多种补体因子相结合,阻碍免疫复合物的形成,从而抑制补体系统活性[19]。近年来,有大量研究以药用植物为研究对象,分析其提取物的免疫调节作用,其中针对补体系统的效应是研究的热点之一。例如,阮姝楠等[20]从广藿香中分离得到的槲皮素-7,3′,4′-三甲醚对补体经典途径和旁路途径具有较强的抑制效果,并确定了其作用靶点为 C1q、C2、C5和C9;吴彦等[21]的研究表明,与阳性对照肝素相比,半枝莲中的多糖成分B3-PS2具有与之相当的体外抗补体活性;张娟娟等[22]采用优化的提取方法获得的鱼腥草多糖具有较强的抗补体活性,CH50值为0.079 mg/mL;焦杨等[23]比较了千解草、白花灯笼、尖尾枫、赪桐、臭茉莉等5种马鞭草科药用植物提取物的抗补体活性,结果显示它们在经典途径和旁路途径均表现出不同程度的抑制效应;杨涛等[24]在红芪中分离得到一种新多糖HPS1-D,发现其具有一定的抗补体活性,CH50值为0.21 mg/mL。本研究以肝素钠为阳性对照,采用细胞溶血实验,探讨LCPP潜在的抗补体活性,结果显示LCPP的CH50值和AP50值分别为2.061±0.127 mg/mL、6.725±0.895 mg/mL,虽然大于肝素钠的 CH50值(0.056±0.004 mg/mL)和 AP50值(0.075±0.005 mg/mL),但是仍然能够在一定程度上抑制补体所导致的红细胞溶血,因此LCPP具有一定的抗补体活性。
动物补体系统可能因为某些外部或内部因素的影响而异常激活,从而导致某些疾病或器官损伤,如果通过药物及时抑制补体系统活性,就有可能改善相关症状。例如,姚楠等[25]的研究表明脂多糖(lipopolysaccharides,LPS)刺激能够明显提高HEK293细胞中IL-8、TNF-α等炎症因子的表达,而TNF-α能诱导人肾近曲小管上皮细胞中补体因子C3 mRNA和蛋白质水平升高,导致肾损伤[26]。Shavva等[27]用TNF-α蛋白刺激人HepG2细胞,显著增强了其补体因子C3的表达。褚纯隽等[28]报道LPS能够刺激小鼠C3、TNF-α、IL-6等因子水平的升高,导致急性肺损伤,而药用植物野马追的提取物则能够有效降低上述因子的水平,从而起到保护作用。此外,有研究表明,当某些鱼类被细菌感染后,体内补体因子C3和B的表达均显著升高[29]。王志平等[30]发现LPS处理斑马鱼后,最终显著提高其C3和补体因子Bf的表达水平。本研究发现TNF-α能够提高人HepG2细胞中补体因子C3的mRNA水平,而LCPP则能有效拮抗TNF-α的刺激作用,降低C3的表达,呈现量效关系。因此,在由于补体系统异常激活导致的疾病中,潞党参的多糖成分可能通过降低补体因子C3的表达,抑制补体系统的活性,达到缓解症状或治疗的作用。
那岩鹰翼展过丈,黑羽灰斑,带着岩石般的厚重纹路,看上去身躯极为结实。它抓着一条黑蟒,那黑蟒有成人手臂粗细,七八尺长,在钢钩般的鹰爪下一动不动地耷拉着,颇为瘆人。
参考文献(References):
[1]Ricklin D,Lambris J D.Complement in immune and inflammatory disorders:therapeutic interventions[J].Journal of Immunology,2013,190(8):3839-3847.
[2]Emmens R W,Wouters D,Zeerleder S,et al.On the value of therapeutic interventions targeting the complement system in acute myocardial infarction[J].Translational Research,2017,182:103-122.
[3]Peiris J S M,Chu C M,Cheng V C C,et al.Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia:a prospective study[J].The Lancet,2003,361(9371):1767-1772.
[4]Wong R S,Wu A,To K F,et al.Haematological manifestations in patients with severe acute respiratory syndrome:retrospective analysis[J].British Medical Journal,2003,326(7403):1358-1362.
[5]Barle E L,Winkler G C,Ulrich P,et al.Cancer risk of immunosuppressants in manufacturing[J].Regulatory Toxicology and Pharmacology,2014,70(1):122-124.
[6]Namazi S,Sagheb M M,Karimzadeh I.Adverse reactions of immunosuppressive drugs in Iranian adult kidney transplant recipients[J].Experimental and Clinical Transplantation,2012,10(3):224-231.
[7]Hou Y Z,Chen K K,Deng X L,et al.Anti-complementary constituents ofAnchusa italica[J].Natural Product Research,2017,31(21):2572-2574.
[9]王爱青.党参多糖对肾阴虚大鼠抗氧化活性和免疫调节影响[J].中医药临床杂志(Wang Ai-qing.Study on antioxidant and immune regulation effects ofCodonopsispolysaccharides on deficiency of kidney-yin type rats[J].Clinical Journal of Traditional Chinese Medicine),2018,30(2):287-290.
[10]李开菊,陈文倩,周霞,等.素花党参多糖对乌鸡生长性能、免疫功能、血常规及肠道菌群的影响[J].四川畜牧兽医(Li Kaiju,Chen Wen-qian,Zhou Xia,et al.Effects ofCodonopsis pilosulapolysaccharides on the production performance,immune function,routinebloodindexesandintestinalmicrofloraofblackbone chicken[J].Sichuan Animal&Veterinary Sciences),2017,10:32-36.
[11]王希春,朱电锋,尹莉莉,等.党参多糖对仔猪生长性能、血清细胞因子及肠黏膜分泌型免疫球蛋白A含量的影响[J].动物营养学报(Wang Xi-chun,Zhu Dian-feng,Yin Li-li,et al.Effects ofCodonopsis pilosulapolysaccharide on growth performance,serum cytokines and intestinal mucosal secretory immunoglobulin A contents of piglets[J].Chinese Journal of Animal Nutrition),2017,29(11):4069-4075.
[12]刘宽辉,田卫军,高珍珍,等.硒化党参多糖和大蒜多糖协同增强鸡外周血淋巴细胞和新城疫疫苗的免疫功效[J].畜牧兽医学报(Liu Kuan-hui,Tian Wei-jun,Gao Zhen-zhen,et al.SelenizingCodonopsis pilosulapolysaccharide and garic polysaccharide synergistically enhance immumological efficacy of chicken lymphocyte and newcastle disease vaccine[J].Acta Veterinaria et Zootechnica Sinica),2017,48(7):1349-1356.
[13]林丹丹,秦韬,任喆,等.硒化党参多糖对免疫抑制小鼠免疫功能的影响[J].中国畜牧兽医(Lin Dan-dan,Qin Tao,Ren Zhe,et al.Effects of selenium-Codonopsis pilosulapolysaccharide on immune function of immunosuppressed mice[J].China AnimalHusbandry&VeterinaryMedicine),2016,43(6):1544-1549.
[14]余兰,王毅.道真洛龙党参多糖对小鼠免疫活性的影响[J].遵义医学院学报(Yu Lan,Wang Yi.Study on immunological activities of polysaccharides isolated fromRadix codonopsison immune function in mice[J].Journal of Zunyi Medical University),2016,39(1):10-13.
[15]胡建燃,郭阳,李平.潞党参多糖的提取及其抗氧化活性分析[J].中国食品添加剂(Hu Jian-ran,Guo Yang,Li Ping.Analysis of LuCodonopsis pilosulapolysaccharide′s extraction and it′s antioxidantactivities[J].ChinaFoodAdditives),2016,7:93-96.
[16]胡建燃,李平,雷海英,等.潞党参多糖对宫颈癌细胞SiHa增殖和迁移的影响[J].生物技术通报(Hu Jian-ran,Li Ping,Lei Hai-ying,et al.Effects of polysaccharides from Lu Dangshen(Codonopsis pilosula)on proliferation and migration of human cervical SiHa[J].Biotechnology Bulletin),2017,33(5):159-163.
[17]吴彦,吴甘霖.半枝莲多糖抗补体活性研究[J].中国实验方剂学杂志(Wu Yan,Wu Gan-lin.Studies on anti-complementary activity of the polysacchride fromHerbaScutellariae Barbatae[J].Chinese Journal of Experimental Traditional Medical Formulae),2009,15(5):49-52.
[18]Mousavi S,Moradi M,Khorshidahmad T,et al.Anti-inflammatory effects of heparin and its derivatives:a systematic review[J].Advances in Pharmacological Sciences,2015,2015:507151.
[19]Young E.The anti-inflammatory effects of heparin and related compounds[J].Thrombosis Research,2008,122(6):743-752.
[20]阮姝楠,卢燕,陈道峰.广藿香的抗补体活性成分[J].中国中药杂志(Ruan Shu-nan,Lu Yan,Chen Dao-feng.Anti-complementary constituents ofPogostemon cablin[J].China Journal of Chinese Materia Medica),2013,38(13):2129-2135.
[21]吴彦,魏和平,王建波.半枝莲多糖B3-PS2分离纯化及抗补体活性研究[J].药学学报(Wu Yan,Wei He-ping,Wang Jianbo.Anti-complement activity of polysaccharide B3-PS2 puri fied fromHerba Scutellariae Barbatae[J].Acta Pharmaceutica Sinica),2009,44(6):615-619.
[22]张娟娟,卢燕,陈道峰.鱼腥草抗补体活性多糖的制备工艺研究[J].中国中药杂志(Zhang Juan-juan,Lu Yan,Chen Daofeng.Preparation procedures of anti-complementary polysaccharides fromHouttuynia cordata[J].China Journal of Chinese Materia Medica),2012,37(14):2071-2075.
[23]焦杨,邹录惠,邱莉,等.5种马鞭草科药用植物的抗补体活性[J].中国药科大学学报(Jiao Yang,Zou Lu-hui,Qiu Li,et al.Anticomplementary effects of the extracts of five Verbenaceae herbsin vitro[J].Journal of China Pharmaceutical University),2016,47(4):469-473.
[24]杨涛,郭龙,李灿,等.红芪多糖HPS1-D的化学结构和抗补体活性研究[J].中国中药杂志(Yang Tao,Guo Long,Li Can,et al.Chemical structural features and anti-complementary activity of polysaccharide HPS1-D fromHedysarum polybotrys[J].China Journal of Chinese Materia Medica),2014,39(1):89-93.
[25]姚楠,白杰,张雪梅,等.牛杀菌/通透性增加蛋白对脂多糖介导的炎性细胞因子表达的影响[J].生物工程学报(Yao Nan,Bai Jie,Zhang Xue-mei,et al.Effects on the expression of lipopolysaccharide-induced inflammatory cytokines mediated by bovine bactericidal/permeability-increasing protein[J].Chinese Journal of Biotechnology),2015,31(2):195-205.
[26]洪郁芝,俞东容,朱斌,等.肿瘤坏死因子α诱导人肾近曲小管上皮细胞C3 mRNA表达和蛋白合成及其意义[J].中华肾脏病杂志(Hong Yu-zhi,Yu Dong-rong,Zhu Bin,et al.TNF-αregulation of C3 gene expression and protein biosynthesis in human proximal tubular epithelial cells[J].Chinese Journal of Nephrology),2001,17(5):327-330.
[27]Shavva V S,Mogilenko D A,Dizhe E B,et al.Hepatic nuclear factor 4αpositively regulates complement C3 expression and does not interfere with TNFα-mediated stimulation of C3 expression in HepG2 cells[J].Gene,2013,524(2):187-192.
[28]褚纯隽,任慧玲,李显伦,等.野马追提取物对脂多糖诱导小鼠急性肺损伤的保护作用[J].华西药学杂志(Chu Chun-jun,Ren Hui-ling,Li Xian-lun,et al.Protective effect of the extracts ofEupatorium lindleyanumon acute lung injury induced by LPS in mice[J].West China Journal of Pharmaceutical Sciences),2015,30(6):653-656.
[29]Steel D M,Whitehead A S.The major acute phase reactants:C-reactive protein,serum amyloid P component and serum amyloid A protein[J].Immunology Today,1994,15(2):81-88.
[30]王志平,韩彦军,刘小宁,等.细菌脂多糖处理对斑马鱼补体基因表达水平的影响[J].水产科学(Wang Zhi-ping,Han Yanjun,Liu Xiao-ning,et al.Effect of bath of lipopolysaccharides derived from bacteria on expression of complement genes in zebrafish[J].Fisheries Science),2014,33(2):115-118.
