临床分离沙门菌的耐药性及超广谱β-内酰胺酶类耐药基因
2018-05-28钱海坤王全意
曲 梅,黄 瑛,张 新,吕 冰,钱海坤,王全意
(北京市疾病预防控制中心 北京市预防医学研究中心 食物中毒诊断溯源技术北京市重点实验室,北京 100013)
沙门菌是一种重要的人畜共患病原菌,是引起感染性腹泻和食源性疾患最重要的致病菌之一。随着抗菌药物的广泛使用,沙门菌耐药问题日趋严重,耐药水平越来越高,多重耐药菌的频繁出现,已成为严重的公共卫生问题。β-内酰胺类抗生素(β-lactam antibiotic)是指化学结构中含β-内酰胺环的一大类抗生素(主要包括青霉素类、头孢菌素类、头霉素类、单环内酰胺类及其他非典型β-内酰胺类抗生素)。产超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)是革兰阴性菌耐药最常见的机制,约占总耐药机制的80%[1]。编码ESBLs的基因分为blaTEM、blaCTX-M、blaOXA和blaSHV及其他5种基因型[2],呈全球分布,可由染色体外的质粒携带,通过融合、转导和转化等机制在细菌间传递转移,从而扩大耐药性的传播与分布,引发感染暴发。目前,临床上治疗沙门菌感染性腹泻,多使用β-内酰胺类抗生素,因而对其耐药的菌株也不断出现。本研究对北京市临床分离的非伤寒沙门菌株进行药物敏感性分析及ESBLs基因的检测,为指导临床合理使用抗菌药物,控制沙门菌的流行和疾病传播,有效应对耐药菌株的扩散提供参考依据。
1 材料与方法
1.1 菌株来源 2012—2015年在北京市7个监测区县选取17家肠道门诊,每个监测区县每周采集10~15份急性感染性腹泻患者新鲜粪便标本。按照北京市肠道传染病监测方案的要求进行规范采样,共收集16 349份标本,进行沙门菌的分离、培养和鉴定,分离出非伤寒沙门菌677株。急性感染性腹泻的诊断标准为日腹泻次数>3次,比平时次数增多;大便形状改变,呈稀便、水样便、黏液便或脓血便,原则上就诊前未使用过抗菌药物。
1.2 方法
1.2.1 分离、培养及生化鉴定 粪便沙门菌的分离培养参照卫生部行业标准WS271-2007附录B进行。采集患儿的粪便或肛拭子,插入亚硒酸盐煌绿(selenite brilliant green,SBG)增菌液肉汤培养(37℃,18~24 h),在SS选择性培养基进行划线分离培养(37℃,18~24 h);挑取可疑单菌落,穿刺三糖铁琼脂,于37℃培养18~24 h,斜面呈红色,底层黄色、产气,硫化氢阳性为可疑沙门菌。将分离到的可疑沙门菌转种于营养琼脂培养基上过夜培养,采用法国梅里埃公司VITEK 2 Compact全自动微生物鉴定系统进行系统生化鉴定。上述培养基为英国OXOID公司产品。
1.2.2 血清学分型试验 用沙门菌群(A~F)抗原、菌体(O)抗原及鞭毛(H)抗原的不同抗血清对沙门菌进行血清型鉴定。方法为挑取三糖斜面上少量菌苔与A~F多价抗血清在室温下进行玻片凝集,1 min 内出现凝集颗粒为阳性;按同样方法与O单价抗血清进行逐一凝集确定O抗原,根据确定的O抗原进行相应的H多价和单价血清凝集,以确定最终血清型。玻片凝集时需设生理盐水对照。沙门菌诊断血清为丹麦SSI血清研究所产品,均在有效期内使用。

1.3 ESBLs 耐药基因检测 采用煮沸法提取菌体及质粒DNA。PCR扩增反应体系为25 μL,包含12.5 μL 2×PCR反应混合物,上、下游引物0.2 μmol/L,模板DNA 2 μl;反应条件:94℃预变性5 min,94℃变性30 s ,退火30 s ,72 ℃ 延伸1 min,35 个循环,72℃延伸5 min。OXA、TEM、SHV、PSE和CTX-M 型基因引物序列[4-5]及反应条件见表1,引物序列由北京擎科生物技术有限公司合成。PCR扩增在美国ABI9700 PCR仪上进行,PCR扩增产物用德国QIAGEN公司QIAxcel 全自动电泳系统进行检测,PCR 阳性扩增产物交于北京擎科生物技术有限公司纯化、双相测序。序列拼接后通过NCBI Blast 程序在GenBank 上查询比较,确定基因亚型。

表1 ESBLs耐药基因PCR引物及序列
2 结果
2.1 分离沙门菌及血清型分布 2012—2015年从16 349份腹泻临床样本中共分离非伤寒沙门菌677株,阳性率为4.14%。其中2012年采样3 364份,阳性率5.68%;2013年采样3 314份,阳性率4.01%;2014年采样2 781份,阳性率4.17%;2015年采样6 890份,阳性率3.44%。677株沙门菌共分为68种不同的血清型,其中肠炎沙门菌为最主要的血清型,占35.45% (240株),其次为鼠伤寒沙门菌(111株,16.40%)、山夫登堡沙门菌(61株,9.01%)、鼠伤寒沙门菌变种(45株,6.65%)。见表2。


表2 677株沙门菌血清型分布

表3 677株沙门菌对16种抗菌药物的耐药结果
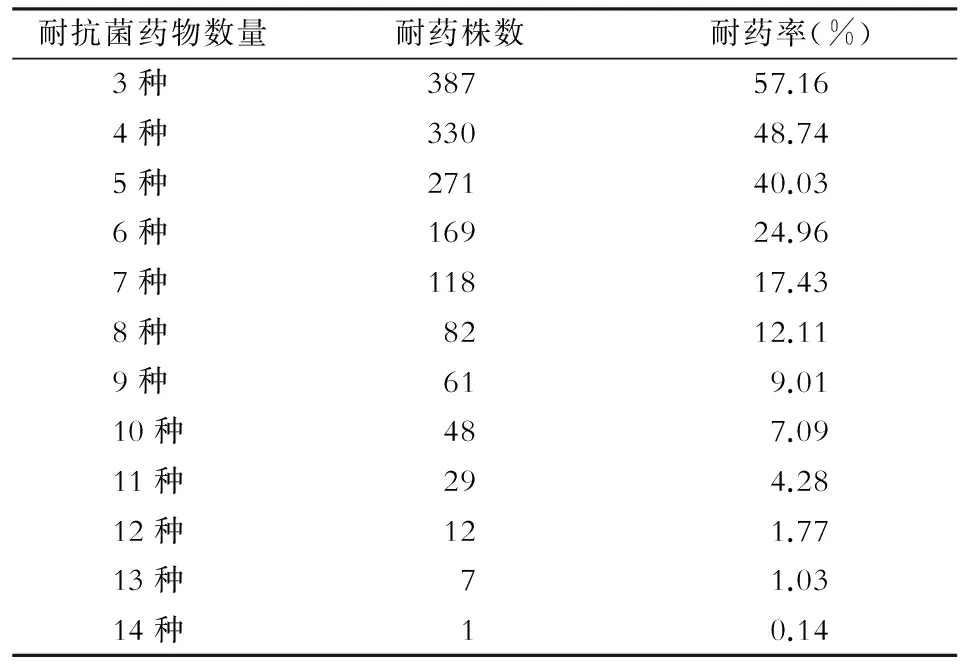
表4 沙门菌多重耐药结果
2.3 β-内酰胺酶类耐药基因检测 677株非伤寒沙门菌中选取对氨苄西林和阿莫西林/克拉维酸均耐药的244株沙门菌,进行blaTEM、blaCTX-M、blaOXA、blaSHV和blaPSE-15种ESBLs基因的检测,其中blaSHV和blaPSE-1未检测到,阳性基因电泳结果见图1,基因片段测序峰图见图2。blaTEM检出率最高(59.84%,146/244),经测序确证全部为blaTEM-1;30株(12.30%)blaOXA-1阳性,18株(7.38%)blaCTX-M阳性,其中包括7株blaCTX-M-15,6株blaCTX-M-55和5株blaCTX-M-14;154株(63.11%)携带一种ESBLs耐药基因;20株(8.20%)同时携带2种ESBLs耐药基因,其中blaTEM-1和blaOXA-1双阳性的菌株12株,blaTEM-1和blaCTX-M双阳性的菌株8株,见表5。所有ESBLs基因阳性的菌株对头孢菌素的耐药性不同,18株blaCTX-M基因阳性的菌株头孢菌素耐药表型符合率最高,对头孢曲松的耐药率为88.89%(16/18),对头孢吡肟的耐药率为77.78%(14/18),对头孢西丁的耐药率仅为5.56%(1/18)。

图1 耐药基因毛细管电泳结果
Figure1Capillary electrophoresis result of drug resistance genes
A:blaOXA基因;B: blaTEM基因;C: blaCTX-M基因
Table5Detection results of ESBLs drug resistance genes of 244Salmonellastrains

耐药基因型菌株数blaTEM-1146blaOXA-130blaCTX-M18 blaCTX-M-157 blaCTX-M-556 blaCTX-M-145blaTEM-1+blaOXA-112blaTEM-1+blaCTX-M8 blaTEM-1+blaCTX-M-154 blaTEM-1+blaCTX-M-143 blaTEM-1+blaCTX-M-551
3 讨论
沙门菌引起的感染性腹泻与诺如病毒一样全球分布[6-7],尤其在发达国家和地区更是高发,在我国感染性腹泻中位居第3位。许多沙门菌可在人、动物、食品和外环境之间相互传播,导致人和动物发病。北京市2012—2015年自感染性腹泻病例中分离沙门菌677株,检测出68种血清型,肠炎沙门菌和鼠伤寒沙门菌为优势血清型,与国内其他研究[3,8-9]类似,只是在优势血清型分布顺序上略有差别。北京、上海以肠炎沙门菌为第一位,而广东和河南则以鼠伤寒沙门菌为第一优势血清型,可见沙门菌血清型分布广泛,并具有区域特异性。本研究显示,山夫登堡沙门菌和阿贡纳沙门菌是临床常见的2种沙门菌致病血清型,其中山夫登堡沙门菌可在环境中持续存在,成为潜在的污染源,并造成腹泻病例的持续发生[10]。阿贡纳沙门菌曾引起过多起聚集性腹泻疫情,有报道[11]阿贡纳沙门菌污染奶粉引起新生儿感染导致脑膜炎。因此,明确鉴定沙门菌血清分型,了解本地区近几年沙门菌主要病原构成情况,掌握其血清学变迁,为临床诊疗提供病原学依据。

CTX-M型ESBLs是一组逐渐被认识且家族成员日益庞大的新型ESBLs,该类酶最早由鼠伤寒沙门菌产生,以对头孢噻肟高水平耐药为主要表型特征。blaCTX-M基因亚型及菌谱地域分布广泛,是导致某些地区ESBLs 产酶株传播或流行的主要原因。本研究对头孢曲松耐药的沙门菌进行检测,检出3种基因亚型blaCTX-M-15、blaCTX-M-55和blaCTX-M-14,在我国其他地区也有此3种基因亚型的检出,提示上述亚型的ESBLs 在我国存在一定的流行,但由于各地区使用抗菌药物不同,blaCTX-M流行基因亚型也有差异,深圳和江西报道的流行亚型为blaCTX-M-14[13-14],而辽宁地区则以blaCTX-M-55为主[15]。
由于ESBLs家族基因种类繁多,本研究仅选取了研究比较多的经典的5种基因。在244株沙门菌中,71.31% 的菌株携带上述1种以上ESBLs耐药基因,但文献报道还有很多编码其他类型酶,如BES-1、FEC-1、PER-2、CME-1、VEB-1等的基因[2],难免会造成一些表型ESBLs耐药菌株基因型的漏检。由于细菌的耐药机制相当复杂,耐药基因的位置、遗传结构和表达情况以及不同耐药基因之间的相互作用等均会影响细菌对抗菌药物的耐药性,产ESBLs菌株不仅对青霉素类和头孢菌素耐药,而且对氨基糖苷类、喹诺酮类、磺胺类药物也交叉耐药。耐药表型与耐药基因存在密切的关系,但又并非遵循严格的对应关系,细菌对一种药物的耐药可能是几种耐药基因和耐药机制共同作用的结果[16]。因此,扩大ESBLs菌株耐药基因监测的种类,是后续研究关注的重点和有待完善的方面。
[参 考 文 献]
[1] Jacoby GA, Archer GI. New mechanism of bacterial resistance to antimicrobial agents[J]. N Engl J Med, 1991, 324(9): 601-612.
[2] Bradford PA. Extended-spectrum beta-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat[J]. Clin Microbiol Rev, 2001, 14(4): 933-951.
[3] Ke B, Sun J, He D, et al. Serovar distribution, antimicrobial resistance profiles, and PFGE typing ofSalmonellaentericastrains isolated from 2007-2012 in Guangdong, China[J]. BMC Infect Dis, 2014, 14: 338.
[4] Wang Y,Yang B, Wu Y,et al. Molecular characterization ofSalmonellaentericaserovar Enteritidis on retail raw poultry in six provinces and two National cities in China[J]. Food Microbiol, 2015, 46: 74-80.
[5] Sidjabat HE, Paterson DL, Adams-Haduch JM, et al. Molecular epidemiology of CTX-M-producingEscherichiacoliisolates at a tertiary medical center in western Pennsylvania[J]. Antimicrob Agents Chemother, 2009, 53(11): 4733-4739.
[6] 陈艳伟,高志勇,严寒秋,等. 2011—2015年北京市肠道门诊老年腹泻患者诺如病毒感染的流行特征分析[J].国际病毒学杂志,2017,24(1):36-39.
[7] 周莹,祁亮梁,梁俊荣,等. 北京市东城区5岁以下婴幼儿病毒性腹泻病原学研究[J].国际病毒学杂志,2017,24(2):119-122.
[8] 许学斌,顾宝柯,金汇明,等. 上海市沙门氏菌血清型流行特征[J].中国人兽共患病学报,2009,25(2):156-158.
[9] 赵嘉咏,黄丽莉,穆玉姣,等. 2011—2013年河南省鼠伤寒沙门菌耐药与分子分型研究[J].中国人兽共患病学报,2016,32(1):56-60.
[10] 曲梅,黄瑛,张新,等. 2008—2014年北京市山夫登堡沙门菌耐药性及分子流行病学特征分析[J]. 现代预防医学,2016,43(14):2497-2501.
[11] Cooke FJ, Ginwalla S, Hampton MD, et al. Report of neonatal meningitis due toSalmonellaentericaserotype Agona and review of breast milk-associated neonatalSalmonellainfections[J]. J Clin Microbiol, 2009, 47(9): 3045-3049.
[12] 崔海洋,王宵雪,霍哲,等. 76 株沙门菌耐药谱及耐药基因分析[J].中国卫生检验杂志,2016,26(1):136-138.
[13] 吴伟元,王辉,陆坚,等. 深圳社区感染沙门菌耐药基因调查与同源性分析[J].中华检验医学杂志,2011,34(5) :431-436.
[14] 陈强,余晓君,李俏俏,等.引起儿童腹泻的沙门菌属临床分离株的耐药特点及分子流行病研究[J]. 中华检验医学杂志,2011,34(3):249-253.
[15] 夏梦,张智洁,刘勇. 152 株沙门菌临床分离株的耐药性及同源性分析[J].医学临床研究,2014,31(12):2311-2317.
[16] Kariuki S, Gordon MA, Feasey N, et al. Antimicrobial resis-tance and management of invasiveSalmonelladisease[J]. Vaccine, 2015, 33(Suppl 3): C21-C29.
