原发性肺黏液腺癌结合病理的CT表现及临床征象
2018-05-25高菲,陈亮
高 菲,陈 亮
(吉林大学白求恩第一医院,吉林 长春130021)
肺黏液腺癌(Primary Pulmonary Mucinous Adenocarcinoma,PPMA)是非小细胞肺癌中肺腺癌的一种特殊亚型,是一种分化良好变异型腺癌,相当于原浸润型黏液性细支气管肺泡癌(BAC),该病临床表现隐匿缺乏特异性,且病程进展缓慢,若早期诊治预后一般良好,因此笔者通过收集本院PPMA 10例,均经手术或取病理证实,分析其临床、病理学及影像学特点,期望能提高对该病认识,加深对该病各方面的理解,争取及早诊断、精确治疗,以求获得良好预后。
1 资料与方法
1.1一般资料收集2015年6月至2017年6月于吉林大学第一医院经手术病理证实的 PPMA患者10例,男性4例,女性6例,发病年龄最小49岁,最大76岁,平均(59±7.05)岁;临床无明显症状或经体检发现5例,伴有间断性咳嗽、无或偶伴有咳痰2例,患者有三年乳癌病史其中1例,粉尘接触史及吸烟史各1例,吸烟 10-20 支/d,烟龄20年;男 4 例,女6例。
1.2CT检查及图像分析10例均行胸部CT平扫,5例行CT双期增强扫描,采用多排螺旋CT 进行扫描,患者仰卧位双臂上举,嘱患者深吸气后保持不动扫描。扫描范围:肺尖到肺底,增强对比剂:选用碘海醇300 mgI100 ml,4 ml/s,用量70-80 ml。注射对比剂后30 s、60 s分别采集双期图像。扫描参数:扫描层厚3 mm,层间距1.5 mm,螺距1.2,管电压120 kV,管电压160 mA,矩阵512×512。扫描图像经后处理工作站曲面重建(CPR)得到重建图像,由2名高年资主治及以上医师分别阅片,对病变的分布、形态、大小、密度、强化程度及与周围临近胸膜、肋骨的关系,及否伴有胸水、纵隔及肺门淋巴结的增大加以回顾性分析。
2 结果
2.1CT表现及影像学诊断8例中单发病灶8例,多灶性1例,右下肺组织整肺叶实变1 例;病变位于右肺下叶5例,左肺上叶1例,左肺下叶3 例,双肺及双侧胸膜多发病灶1例,部分见小空洞形成,大小约0.2-0.5 cm;8例单发病灶中,不规则磨玻璃样病灶1例,不均匀实性病灶5例,混合密度(实性成分与磨玻璃)病灶2例;病灶大小:最小病灶约为0.8 cm,最大病灶为累及整个右下肺叶(图1、2),整肺叶呈水样低密度实变,CT值约0-13 HU,肺内支气管走行扭曲闭塞,周围可见少许小囊泡及点状钙化灶,增强扫描不强化,可见血管造影征、支气管截断征及肺叶膨隆征等;囊性成分CT值约11.3-22.5 HU,实性成分平扫CT 值约25.7-38.4 HU,其中有5例行二期增强扫描,囊实性病灶内囊性成分强化不明显,实性成分呈轻度强化,强化幅度约11.0-23.6 HU。具有典型周围型肺腺癌表现,如毛刺及分叶征、空泡征、胸膜凹陷征等7例,其中含有空泡及囊腔4例,伴有点状钙化灶3例,本组病例中无出血及胸腔积液形成,纵隔及肺门均未见肿大淋巴结。2例行PET-CT检查,其中共4枚病灶均呈轻度FDG摄取或低摄取,代谢不高,SUV最大值2.5。8例单发结节状改变患者中,有5例可根据影像学形态诊断为周围型肺癌,其中1例患者乳癌术后病史,诊为转移瘤1年余无改变,近期复查病灶实性成分增多(图6);1例表现模糊不均匀团片影(图5),诊断为肺炎,经抗炎治疗后影像学无改变;1例多灶性病变,首诊怀疑多发转移瘤。
2.2病理及免疫组化结果10例患者均通过手术切除病灶取病理证实为肺原发性黏液腺癌。大体病理肉眼所见(图3):肿物呈淡褐色或灰白色、实性、质软,较湿润,半透明样、部分有黏液感;镜下(图4、5)肿瘤细胞呈杯状或柱状衬附于细支气管肺泡壁,呈伏壁样生长,胞质透亮,核位于基底部,肺泡及腺腔内充满黏液。 PPMA免疫组化结果包括:为:CK7(+)、CK20(+)及(-)各4例、TTF-1(+)7例,TTF(-)1例,Ki-76(+5%-70%)、CDX-2(+)4例、NapsinA(+)3例。
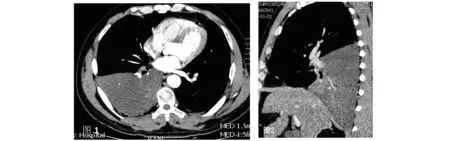
图1、图2 患者男,60岁。右肺下叶整肺叶呈水样低密度实变,CT值约0-13HU,肺叶轻度膨隆,肺内支气管走行扭曲闭塞,周围可见少许小囊泡并见点状钙化灶,增强扫描后肺实质强化不明显。
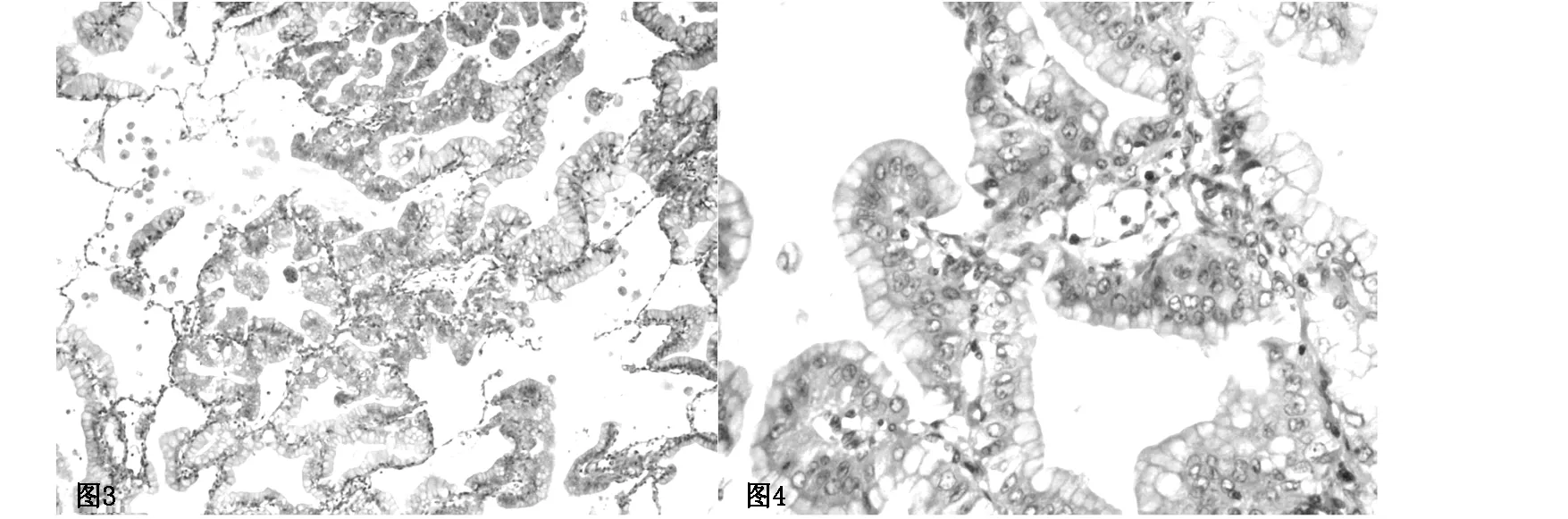
图3、4(HE染色,为×100、×400)为图1、2患者手术后标本病理切片,肺泡腔内充满大量黏液,肿瘤细胞胞质透亮、细胞核位于基底部,沿细支气管肺泡壁伏壁生长。
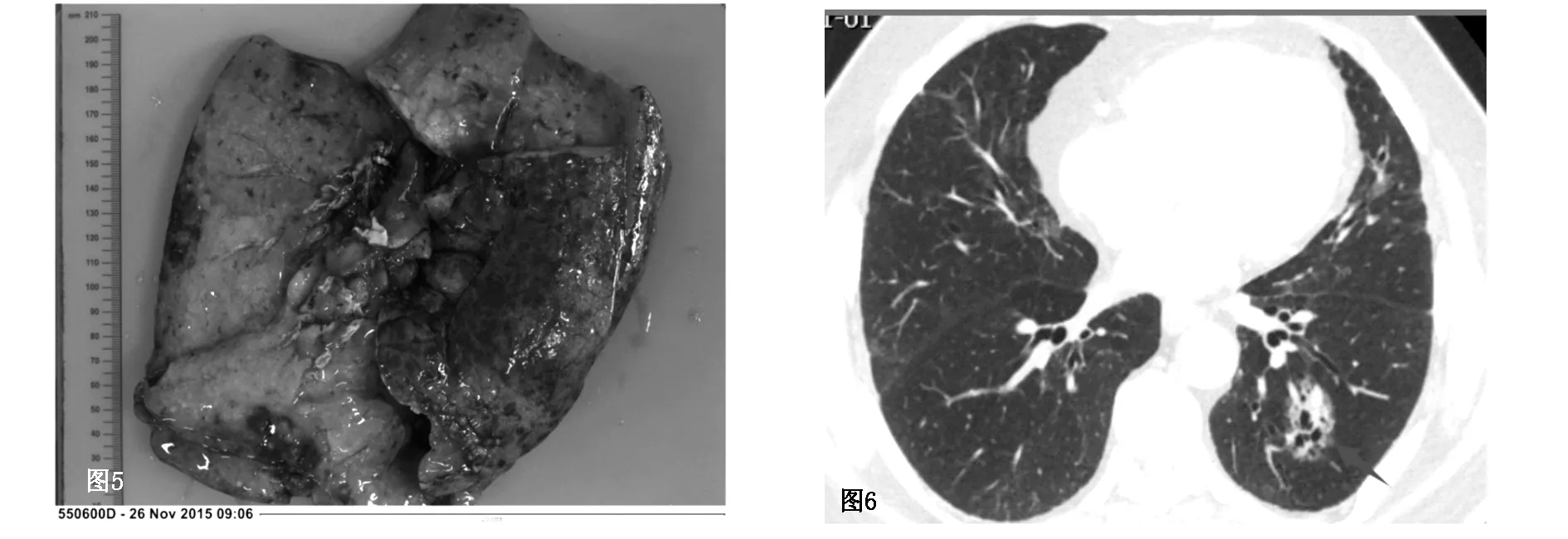
图5 为其肉眼大体图像,肿物呈灰白色,湿润,质软,右肺下叶整肺叶实变 图6 患者男,76岁。左肺下叶见团片状混杂密度影,呈部分磨玻璃内见多发空泡及多发偏心性囊腔影,其他层面病灶周围可见多发磨玻璃卫星灶
3 讨论
黏液性腺癌多见于胃肠道系统肿瘤,PPMA作为肺腺癌一类的伴黏液分泌肺腺癌的亚型,约占全部非小细胞肺癌(NSCLC)全部亚型的4%,在全部分化良好型腺癌中占30%,在1989年Kish[1]首次提出了PPMA的概念,在后继的病例及文献中PPMA多以胶样癌和黏液型细支气管肺泡癌报道。2011年肺腺癌国际多学科分类的新分类中,其中黏液腺癌被分为黏液性原位腺癌(mucinous adenocarcinoma in situ,m-AIS)、黏液型微浸润腺癌(Mucinous minimally Invasive Mucinous adenocarcinoma,m-MIA)、浸润型黏液腺癌(Invasive mucinous adenocarcinoma,IMA)以及胶样癌(Colloid Carcinoma)[2],前两种极少见,多为浸润型;根据2015年WHO定义肺黏液性腺癌的肿瘤细胞病理学起源为杯状细胞及柱状上皮细胞,以细胞内富含大量黏液;根据生长方式上又可细分为不同亚型,多以鳞屑样伏壁生长占主要成分,腺泡型、乳头状、微乳头状及实体性成分相互混合[3],肉眼大体肿物呈灰白色或淡褐色,半透明胶冻状,湿润、质软。镜下可见肿瘤细胞内存在大量分泌的黏液堆积,细胞核受挤压位于细胞基底侧。
PPMA 多见于>40岁的人群,其中以51-60岁年龄段多见,本组10例中7位患者位于此年龄段。本病发病率较低,既往报道男女好发比例及是否与吸烟相关统计结果不尽相同,也有研究认为无相关性,本组病例男女比例4∶6,仅有1例有吸烟史。通常临床无症状或较轻,缺乏特异性,可仅有咳嗽、咳痰,或长期反复咳白色黏液样痰,病因为肿瘤细胞向肺泡腔内分泌黏蛋白所致,本组病例有5例为无症状体检首诊,只有2例有间断性咳嗽,早期极易误诊为肺炎等其他肺内疾病,拖延病程至发生转移,而贻误治疗。
PPMA最主要的检查手段为胸部CT。原则上可发生于双肺各叶,但以双肺下叶略多见,本组中有6例位于下叶;按病灶类型可分为肿块型(单发结节或团块)、多灶型及散在肺炎型,也有研究按 实性病灶、空泡型和肺炎型分类,但多以周围型肿块型多见,依据王晓梅[4]等的报道,肿块型PPMA可具有肺腺癌的一般典型特征,多表现为胸膜下区分布的孤立病灶,可见分叶、空泡及毛刺,血管集束征及胸膜凹陷征等,此类型肺腺癌一般从影像上不难诊断;但是肺炎型PPMA因其临床症状轻微或与肺炎相似,且影像学表现也与肺部感染性或过敏性炎变表现相似[5,6],是肺癌中唯一影像学表现可为非支气管阻塞性肺实变的类型,易通过气道壁浸润经气道发生肺内散在弥漫性转移,较其他类型肺癌更易发展成弥漫性病变,X线及CT表现为双肺段、叶样的斑片影或磨玻璃影,内有实变并大片融合,此类型一般预后较差,5年生存率仅为26%。本组病例中术后病理结果发现,有2例发生气道壁癌浸润,其中1例术后1年随访复查发生肺内多发转移。
由于PPMA病理学特点的特殊性,通过结合本组病例影像资料及既往报道的相关文献及个案,可以总结出一些相对特征性的表现:(1)病灶密度不均且较低,增强强化幅度较小:肿块型病灶多为囊实性[7,8],病理上是由于由于肿瘤细胞大量黏液分泌所致的病灶实质密度减低,部分可融合成黏液囊,多不强化,而实性成分为癌组织,呈轻度强化,强化幅度约11.0-23.6 HU;本组病例中,囊性成分CT值约11.3-22.5 HU,实性成分CT制约25.7-38.4 HU;且囊性成分与肺癌中央缺血性病灶坏死区不同,PPMA囊性区可位于病灶偏侧或边缘;而肺炎型及多灶型病灶可表现为实性、囊实性混合密度,多伴部分磨玻璃密度,极少为单纯磨玻璃密度,由于病灶较散在或弥散,密度可成水样低密度[9],增强扫描轻度或无强化,此时在低密度影的衬托下增强扫描可清晰看到病变内的血管影,被称作“血管造影征”[10];该征象最初被认为是大叶性PPMA的特征性表现,但后续研究证实在肺炎、阻塞性肺炎及淋巴瘤中均可见到该征象,因此缺乏特征性。(2)病灶易出现多发空泡及蜂窝征:可见于伴有磨玻璃密度的孤立性病灶,以及肺炎型及较弥漫性病变;可表现为小空泡及多发小囊腔影[11],多见于病灶边界的浸润区,其病理学基础为肿瘤呈伏壁样浸润性生长,当肿瘤组织及其分泌的黏液尚且未能完全填充肺泡腔,而是沿肺泡及支气管管壁蔓延,使肺泡腔形成活瓣样阻塞,当多个肺泡腔因过度充气而发生扩张,则表现空泡征或蜂窝征,本组病例中有4例可见小囊腔及空泡征,均位于病灶组织边缘,应符合本特征;部分研究[12]显示病灶还可表现为较大不规则的薄壁空洞影,甚至多发空洞;另外当发生在肺炎型或不规则弥漫性病变时,肺段、叶性实变内还可见走形僵硬、分支扭曲稀疏,呈枯枝状的充气支气管影,因此可称为“枯枝状”征,此表现与支气管壁癌组织浸润,多可提示发生气道播散,是肺炎型一般预后极差的原因。(3)病灶周围可见多个粟粒样卫星样子灶,表现围绕或分布的多个小磨玻璃影,大小相似,可能与肿瘤沿气道播散有关,或沿肺泡间隔或肺泡孔蔓延形成,本组有1例中心病灶周围分散可见2枚小磨玻璃样结节,且PET-CT扫描均呈低摄取。 (4)钙化,多为点状、小结节状钙化,既往文献[8]中可见条索状、弯曲条形钙化,本组病例中有4例可见钙化,且与病灶大小无关,钙化的形成机制可能与肿瘤本身分泌功能丰富所致钙盐沉积有关。
除外CT检查以外,MR及PET-CT在对PPMA的诊断上应用有相应的应用。于2000年Gaeta等[13]首次提出白肺征 (white lung sign),是由于肿瘤内高度黏液成分存在,且黏液成分中95%-98%由水组成,另外2%-5%为糖蛋白,由于病灶含水较多,T1及T2的弛豫时间长,病灶于重T2上表现明显高信号,可以在CT诊断基础上进一步支持诊断,有学者认为对于怀疑黏液腺癌的肺实变病人可进一步行MR重T2成像;但后继研究发现“白肺征”也可见于阻塞性肺炎,但可通过发现病灶中央气道内肿块予以鉴别[14]。
PET-CT在肺癌的鉴别诊断、分期和治疗疗效的评估等方面均具有很好的临床价值,国外一些关于肺癌的临床指南等都已确认18F-FDG PET用于肺癌诊断的价值。但是有研究[15]显示,在PET扫描中,对于胶样腺癌、粘液腺癌和鳞屑样肺腺癌结果有显著假阴性结果的倾向。因此,对于怀疑PPMA的患者PET-CT低摄取结果应谨慎假阴性结果,本例中有2组病例行PET-CT检查,病灶均为低摄取;因此胸部多排CT检查较PET-CT具有优势。
PPMA的 确诊主要通过的手术或支气管镜等手段取病理确诊,并进行免疫组化分析。免疫组化分析CK-7(+)、CDX-2、15%的 TTF-1阳性、8%阳性,MUC2 阴性,胃肠转移性黏液性腺癌病理学免疫组化结果中CK-20、NapsinA、TTF-1阴性,而MUC2 为阳性[3];而对于术后确诊NSCLC的患者,行辅助化疗前,常需要通过对表皮生长因子受体(epidermal growth factor recepter,EGFR)突变以及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因重组的检测,来决定对靶向治疗药物EGFR及ALK酪氨酸激酶抑制剂治疗反应的敏感性,对临床治疗起到重要作用。
PPMA转移及预后情况:较少发生胸膜浸润及侵犯,也很少出现胸水;且纵膈淋巴结转移多见于重晚期;与肺腺癌早期即可发生脑、肝脏及骨质血行转移不同,本病血行转移较少。本组病例中仅有1例纵隔淋巴结转移;肿瘤浸润气道壁,通过气道播散造成肺内转移是最常见形式,多发生于肺炎型提示预后不良;除外肿瘤的类型,病灶大小是决定肿瘤T分期的重要因素[16,17],病灶越小(<3 cm),预后越好。本组病例中右肺下叶整肺叶实变1例,病灶较大,肺组织呈水样低密度,外基底段可见多发小空泡影,肺内可见典型“枯树枝”征及“血管造影征”,边缘有一点状钙化影,该患者影像表现比较典型,术后病理未发现淋巴结转移及胸膜浸润,肿瘤分期T3N0MO期,但切口处气管壁可见癌组织浸润,经全肺叶切除术后伴辅助化疗,随访一年后复查,已发生双肺多发转移,预后极差,说明该病,气道壁浸润及病灶大小是决定预后的重要因素。
PPMA为肺腺癌的一种特殊亚型,发病率较低,肿瘤分化较良好,临床症状出现较晚或较轻;影像学表现多样,孤立结节型胸部CT表现可具有腺癌的一般特征;当其呈肺炎型及多灶状改变时,需要与感染性病变鉴别,当肺内实变与患者临床症状不符、抗炎效果不佳时应警惕本病可能。
参考文献:
[1]Kish JK,Ro JY, Ayala AG,et al.Primary mucinous adenocarcinom of the lung with singnet-ring cells:a histochemical comparison with signet-ring cell carcinomas of other sites[J].HumPathol,1989,20(11): 1097.
[2]Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].Journal of thoracic oncology:official publication of the International Association for the Study of Lung Cancer,2011,6(2):244.
[3]王 迪,于 红.肺黏液腺癌的影像学与病理学研究进展[J].国际医学放射学杂,2012,5:426.
[4]王晓梅,王靖红,吴重重,等.原发性肺浸润型黏液腺癌的多层螺旋CT表现[J].中国医学影像学杂志,2015,9:691.
[5]Morichika D,Miyahara N,Hotta K,et al.Invasive mucinous adenocarcinoma mimicking organizing pneumonia associated with Mycobacterium fortuitum infection[J].Internal medicine,2014,53(24):2795.
[6]Balestra R,Selvaraju A,Benzaquen S,Zander DS.Pneumonic-type mucinous lung adenocarcinoma diagnosed by transbronchial cryobiopsy[J].Respirology case reports,2017,5(3):e00222.
[7]涂 灿,邓生德,汪建华,等.原发性肺黏液腺癌的影像学表现[J].中国全科医学,2015,(15):1849.
[8]宾怀有,龙腾河,滕才钧.原发性肺黏液腺癌的CT表现与病理学对照研究[J].广西医学,2014,4:527.
[9]王 迪,于 红.肺黏液腺癌的影像学与病理学研究进展[J].国际医学放射学杂志,2012,5:426.
[10]Shah RM,Friedman AC.CT angiogram sign: incidence and significance in lobar consolidations evaluated by contrast-enhanced CT[J].AJR American journal of roentgenology,1998,170(3):719.
[11]Oda S,Awai K,Liu D,et al.Ground-glass opacities on thin-section helical CT:differentiation between bronchioloalveolar carcinoma and atypical adenomatous hyperplasia[J].AJR American journal of roentgenology,2008,190(5):1363.
[12]Masuzawa K,Minematsu N,Sasaki M,et al.Invasive mucinous adenocarcinoma of the lung presenting as a large,thin-walled cyst:A case report and literature review[J].Molecular and clinical oncology,2017,6(3):433.
[13]Gaeta M,Blandino A,Scribano E,et al.Magnetic resonance imaging of bronchioloalveolar carcinoma[J].Journal of thoracic imaging,2000,15(1):41.
[14]Gaeta M,Ascenti G,Mazziotti S,et al.MRI differentiation of pneumonia-like mucinous adenocarcinoma and infectious pneumonia[J].European journal of radiology,2012,81(11):3587.
[15]Lococo F,Galeone C,Formisano D,et al.18F-fluorodeoxyglucose positron emission tomographic scan in solid-type p-stage-I pulmonary adenocarcinomas:what can produce false-negative results?[J].European Journal of Cardio-thoracic Surgery:official journal of the European Association for Cardio-thoracic Surgery,2017,51(4):667.
[16]Hwang S,Han J,Choi M,et al.Size of Non-lepidic Invasive Pattern Predicts Recurrence in Pulmonary Mucinous Adenocarcinoma: Morphologic Analysis of 188 Resected Cases with Reappraisal of Invasion Criteria[J].Journal of pathology and translational medicine,2017,51(1):56.
[17]宁 晖,王承志,谢 祎,等.26例肺原发黏液腺癌的临床特征和影响预后因素[J].天津医药,2009,11:981.
