宫颈癌宫颈脱落细胞中miR-21的表达及其诊断价值的探讨
2018-05-25支亚丽张诗蒙栗俊杰谭志容李树隆
支亚丽,张诗蒙,栗俊杰,谭志容,李树隆,庄 严
(深圳市蛇口人民医院,广东 深圳518067)
微小RNA(microRNA,miRNA)是在真核生物中发现的、内源性的、具有调控功能的大小约20-25个碱基的非编码RNA[1]。近几年的研究发现,miRNA能够稳定存在于血液、尿液、唾液、乳汁、眼泪、分泌物等多种体液中[2]。一些miRNA对某些肿瘤具有特异性,因此,miRNA是一种良好的生物标志物,对肿瘤的诊断、评价疗效、预后等有很好的指导意义。宫颈癌是女性常见的恶性肿瘤之一,是由宫颈不典型增生逐步发展到原位癌,再进一步恶化为宫颈癌。因此宫颈癌的早期诊断对治疗与预后十分重要。研究表明,miR-21在乳腺癌、结肠癌等多种肿瘤患者的血清中表达明显升高[3],这其中也包括宫颈癌。本研究通过SYBR Green荧光定量PCR法检测宫颈粘液脱落细胞标本中的mi-21的表达情况,发现正常组与宫颈上皮内瘤变组、宫颈癌组中miR-21的表达水平存在明显差异。
1 资料与方法
1.1 标本采集
深圳市蛇口人民医院收治的门诊、住院病人以及健康体检者宫颈脱落细胞标本共90例,其中宫颈癌30例,年龄32-58岁;宫颈上皮内瘤样病变30例,年龄31-59岁;正常组30例,年龄30-59岁。
1.2 仪器与试剂
All-in-OneTMmiRNA第一链cDNA合成试剂盒与All-in-OneTMmiRNA qPCR检测试剂盒、miR-21引物以及内参U6引物购于中国广州复能基因公司, TRIzol购于TAKARA。低温离心机为Eppendorf 5230R,荧光定量PCR仪为罗氏Z480。
1.3 方法
1.3.1总RNA提取
取500 μl宫颈粘液上皮细胞标本于EP管中,加入500 μl TRIzol(TAKARA,日本)裂解细胞,为使细胞完全裂解,需要用移液枪反复吹打裂解液,吹打完成后,将EP管静置5 min;在 EP管中加入0.1 ml的氯仿,为使有机相与水相充分反应,盖紧离心管盖,用手剧烈振荡15 s,待溶液充分乳化(无分相现象)后,再室温静置10 min;低温离心机(Eppendorf 5230R)程序设置温度为4℃,12,000 g离心15 min。离心结束后,从离心机中慢慢取出EP管,不要摇晃EP管,这个时候可看到EP管中的液体分为3层,上层是上清液,无色透明,RNA即存在于此层。中间可见一小层白色的乳状物,即蛋白,下层为红色的有机层,RNA存在于上清液中。尽量多地吸取上清液到另一新的RNase free离心管中。沉淀RNA:加入与吸的上清液大致等体积的异丙醇,轻柔地来回颠倒,使其充分混匀,室温静置10 min;低温离心机4℃下,12,000 g离心10 min,收集RNA沉淀,去上清;用无水乙醇与DEPC水配置75%乙醇,加入0.5 ml-1 ml 75%乙醇洗涤,低温离心机4℃下,12,000 g离心5 min,去上清,将EP管超净台风干,待白色沉淀逐渐变透明后加入15-50 μl DEPC水溶解。
1.3.2逆转录
采用Trizol法提取总RNA后,测提取的RNA浓度,以总RNA为2 μg算出加RNA模板的体积。按照试剂说明书添加体系,进行逆转录(复能基因,广州),将RNA逆转录成cDNA。 miRNA逆转录体系为:5 μl 的5×PAP/RT Buffer;1 μl 的2.5 U/μl Poly A Polymerase;2 μg的RTase Mix 1 μl Total RNA;补RNase Free dH2O配成25 μl。PCR仪反应条件设定为:37℃,60 min;85℃,5 min。逆转录产物加入100 μl dH2O稀释5倍后用于miRNA荧光定量检测。
1.3.3miRNA荧光定量PCR
按照试剂说明书(复能基因,广州),配置荧光定量PCR反应液。反应体系为10 μl的2×All-in-OneTM; 2 μl 的qPCR Mix Universal Adaptor PCR Primer;2 μl 的All-in-OneTMmiRNA qPCR Primer,2 μl 的First-strand cDNA(diluted 1∶5),dH2O 4.0 μl。反应条件为95℃,10 min;95℃,10 s;60℃,20 s;72℃,30 s,共40个循环。PCR仪为罗氏Z480。以U6作为内参microRNA,通过2-△△Ct来评价目标mRNA的表达水平,△△Ct=(标本Ct目的-标本内参)-(对照Ct目的-对照内参)。
1.4 统计学处理
本研究的数据采用SPSS17.0软件中的Mann-Whitney U 检验进行组间比较,P<0.05为差异有统计学意义。ROC曲线采用Graphpad制作分析。
2 结果
2.1 各组宫颈粘液上皮细胞中miR-21的表达情况
用SYBR Green荧光定量PCR法检测各组宫颈粘液脱落细胞标本中的mi-21的表达情况。由于各组均不满足参数检验的条件,故使用非参数检验进行组间比较。由图1所示,miR-21在正常组、宫颈上皮内瘤变组、宫颈癌组中相对表达中位数分别2.8733、13.3643、14.2617。miR-21在宫颈上皮内瘤变组明显高于正常组,其差异均具有统计学意义(Z=-5.027,P<0.001);宫颈癌组miR-21的表达相对正常组也明显升高(Z=-5.648,P<0.001)。而miR-21的表达在宫颈上皮内瘤变组与宫颈癌组之间的差异不具有统计学意义(Z=-1.198,P=0.231)。
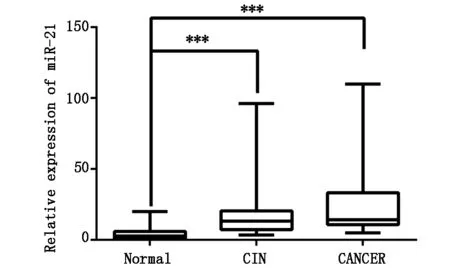
图1 miR-21在正常组(Normal)、宫颈上皮内瘤变组(CIN)、宫颈癌组(CANCER)的表达水平
2.2 miR-21的ROC曲线分析
如表1所示,miR-21区别正常组与宫颈上皮内瘤样病变组的ROC曲线面积为0.87(95%CI:0.793 5-0.962 1;P<0.001),当临界值为7.060时,敏感度为80%,特异度为80%,约登指数为60%。

表1 miR-21对宫颈上皮瘤变、宫颈癌的诊断价值ROC分析结果
如表1所示,miR-21区别正常组与宫颈癌组的ROC曲线面积为0.92(95%CI:0.859 0-0.989 9;P<0.001),当临界值为7.508时,敏感度为93.33%,特异度为80%,约登指数为73.33%。
3 讨论
微小RNA(microRNA,miRNA)是内源性的、具有调控功能的非编码RNA,由约20-25个碱基组成。miRNA能通过与靶 mRNA 的特异性碱基配对引起靶 mRNA 的降解、抑制或活化,对基因进行转录或转录后调控[1]。miRNA可通过调控细胞的癌基因和抑癌基因,参与肿瘤发生、发展、转移、侵袭和预后等形成过程。大量的实验研究表明大多数人类肿瘤中都存在miRNA的异常表达,而miRNA又可稳定地存在于人类各种体液中,因此可作为肿瘤标志物用于肿瘤的诊断与监测。
miR-21位于人类染色体脆性位点FRA17B上,该位点与肿瘤密切相关[4]。因此,miR-21在大多数恶性肿瘤中表达增高。在宫颈癌细胞株HeLa细胞中,miR-21可抑制其靶基因PDCD4的表达,促进细胞增殖[5];miR-21也可通过抑制TIMP3的表达,促进HeLa细胞生长,抑制其凋亡[6]。Yao等发现,miR-21在宫颈癌组织中表达增高,并且miR-21可通过调控CCL20基因,促进宫颈癌的发生与发展[7]。miR-21还可抑制PTEN表达,促进宫颈癌细胞增殖[8]。血清中的循环miR-21与宫颈癌淋巴结转移有关[9]。
由于miRNA被证明能稳定存在于血清、尿液等各种体液中,因此近些年来miRNA作为疾病新型生物标志物用于诊断疾病成为了研究热点。研究表明,miR-21在宫颈癌组织的表达高于正常宫颈组织。在宫颈癌患者的血清中的miR-21的表达量明显高于非宫颈癌患者。然而,血清或血浆中的miR-21可在多种恶性肿瘤中异常表达:如乳腺癌、结肠癌、肝细胞癌、肺癌等等,除此之外,miR-21还可在非肿瘤疾病患者的血清中表达异常:如肝炎、糖尿病等。因此血清中的miR-21的异常表达并不能针对性地反映某种疾病,不具备某种疾病的特异性[3]。
本研究通过实时荧光定量PCR检测宫颈癌脱落细胞中miR-21的表达水平,发现宫颈粘液脱落细胞标本中的miR-21在宫颈癌与癌前病变患者表达升高(P<0.001)。ROC曲线分析结果显示,miR-21可区分正常组和宫颈上皮内瘤样病变组,其ROC曲线面积为0.87,说明诊断价值中等,其敏感度为80%,特异度为80%。miR-21在正常组和宫颈癌组的ROC曲线面积为0.92,说明诊断价值较高,其敏感度为93.33%,特异度为80%。
综上所述,宫颈粘液脱落细胞中的miR-21对宫颈癌及其癌前病变具有诊断价值。而宫颈粘液脱落细胞标本有着无创、易于取样、易于检测等特点,而且相对于血清标本,对宫颈癌更具有特异性。因此,宫颈粘液脱落细胞中的miR-21可以作为宫颈癌筛查与诊断以及预后判断的生物标志物,但是尚需进一步的大样本临床验证。
参考文献:
[1]张诗蒙.HPV16 E7调控miR-27b-PPARγ-NHE1途径影响宫颈癌细胞增殖与侵袭功能的实验研究[D]. 南方医科大学,2014.
[2]Weber JA,Baxter DH,Zhang S,et al.The microRNA spectrum in 12 body fluids[J].CLIN CHEM,2010,56(11): 1733.
[3]Hrustincova A,Votavova H,Dostalova MM.Circulating MicroRNAs: Methodological Aspects in Detection of These Biomarkers[J].Folia Biol (Praha),2015,61(6): 203.
[4]Lui WO,Pourmand N,Patterson BK,et al.Patterns of known and novel small RNAs in human cervical cancer[J].Cancer Res,2007,67(13):6031.
[5]Yao Q,Xu H,Zhang QQ,et al.MicroRNA-21 promotes cell proliferation and down-regulates the expression of programmed cell death 4 (PDCD4) in HeLa cervical carcinoma cells[J].Biochem Biophys Res Commun,2009,388(3):539.
[6]梁 亮,张寅斌,张 扬,等.miR-21影响宫颈癌HeLa细胞生长和凋亡的机制探讨[J].现代肿瘤医学,2016,24(19):3005.
[7]Yao T,Lin Z.MiR-21 is involved in cervical squamous cell tumorigenesis and regulates CCL20[J].Biochim Biophys Acta,2012,1822(2):248.
[8]Peralta-Zaragoza O,Deas J,Meneses-Acosta A,et al.Relevance of miR-21 in regulation of tumor suppressor gene PTEN in human cervical cancer cells[J].Bmc Cancer,2016,16:215.
[9]Zhang L,Zhan X,Yan D,et al.Circulating MicroRNA-21 Is Involved in Lymph Node Metastasis in Cervical Cancer by Targeting RASA1[J].Int J Gynecol Cancer,2016,26(5):810.
[10]陈文璟,温旺荣.SYBR Green I荧光定量PCR检测宫颈癌血清中miR-21的表达[J].临床检验杂志,2011,29(7):523.
