高糖刺激大鼠肾间质成纤维细胞TGF-β、CTGF及α-SMA作用研究
2018-05-25丁雪峰
韩 璐,胡 涛,丁雪峰,杨 玉
(吉化集团公司总医院 1.检验科;2.内分泌科,吉林 吉林132000)
肾间质成纤维细胞作为肾间质的固有细胞,是肾脏细胞外基质(ECM)的主要生成细胞,约占肾组织细胞总数的6%。研究表明,在高糖等因素作用下,正常肾脏中相对静止的成纤维细胞可被激活,表现出明显增殖活性,同时刺激合成多种ECM成分,包括胶原(collagen)、纤连蛋白(FN)、弹性蛋白、糖胺聚糖和蛋白聚糖等,参与肾间质纤维化过程。转化生长因子-β(TGF-β)、结缔组织生长因子(CTGF)被认为是强效的致纤维化因子,在多种组织器官纤维化中起重要作用。大量研究显示,二者在肾间质纤维化发生发展中也具有重要作用[1,2]。有学者认为,活化的成纤维细胞可发生功能和表型改变,即转变为可表达α-平滑肌肌动蛋白(α-SMA)的肌成纤维细胞(MFB),后者数量的多少与间质纤维化轻重程度密切相关,可以作为判断慢性肾脏疾病一个很好的指标[3]。本研究旨在探讨高糖对大鼠肾间质成纤维细胞株NRK49f TGF-β、CTGF及α-SMA表达的影响。
1 材料与方法
1.1材料大鼠肾间质成纤维细胞株NRK49f购自上海拜力生物科技有限公司。DMEM高糖及低糖培养基为Invitrogen产品,胎牛血清产自天津灏洋生物技术公司。兔抗大鼠TGF-β、CTGF及α-SMA多克隆抗体、辣根过氧化物酶标记抗兔多克隆抗体购自北京中杉金桥生物技术有限公司。ECL显色试剂盒为武汉伊莱瑞特生物科技股份有限公司产品。细胞裂解液、Bradford 法蛋白检测试剂盒由碧云天生物技术公司生产。TRizol为Invitrogen产品,二步法实时定量逆转录PCR(RT-PCR)试剂盒为全式金生物技术公司产品。
1.2细胞分组将处于对数生长期的细胞按1×106/孔接种至6孔板,待细胞完全贴壁后,将培养细胞换用无血清DMEM培养12 h后,用无血清高糖DMEM继续培养12 h、24 h及48 h,同时设空白对照组,即继续用无血清DMEM培养相应时间。每组设3个复孔,实现重复3次。
1.3WesternBlot检测各组细胞于培养结束后,吸取培养上清并用预冷磷酸盐缓冲液(PBS)充分洗涤细胞2次,每孔加300 μl细胞裂解液反复吹打以充分裂解细胞,经蛋白定量后按50 μg/孔行聚丙烯酰胺(SDS-PAGE)电泳并经转膜、洗膜、封闭后,用兔抗大鼠TGF-β、CTGF及α-SMA多克隆抗体4℃孵育过夜,再用辣根过氧化物酶标记抗兔多克隆抗体37℃孵育2 h,充分洗膜后用ECL法显色、曝光后测量X光胶片上条带密度。
1.4实时定量RT-PCR检测各组细胞于培养结束后,吸取培养上清并用预冷磷酸盐缓冲液(PBS)充分洗涤细胞2次后,按TRizol说明书提取细胞总RNA,并二步法实时定量RT-PCR试剂盒说明书进行逆转录并用TGF-β、CTGF及α-SMA特异性引物进行PCR反应。按2-ΔΔCt计算各组细胞TGF-β和CTGF的相对表达量,ΔΔCt=(实验组目的基因Ct-实验组内参基因Ct)-(对照组目的基因Ct-对照组内参基因Ct)[4]。
PCR引物序列分别为:TGF-β正意义链5’-CCAAGGAGACGGAATACAGG-3’, 反意义链5’-GTGTTGGTTGTAGAGGGCAAG-3’;CTGF正意义链5’-CTAAGACCTGTGGAATGGGC-3’, 反意义链5’-CTCAAAGATGTCATTGCCCCC-3’。以GAPDH为内参照,引物序列为正意义链5’-ACTGAGCATCTCCCTCAC-3’, 反意义链5’-TCCACCACCCTGTTGCTGTA-3’。
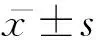
2 结果
2.1各组细胞TGF-β和CTGFwesternblot检测结果高糖DMEM作用于NRK49f 12 h即可见TGF-β、CTGF蛋白表达均有增加趋势,并持续增高,与正常对照组比较,高糖刺激24 h及48 h组TGF-β相对表达量均明显增加,差异有统计学意义(P<0.05),且与高糖12 h组比较,二者相对表达量变化明显增加(P<0.05),见图1,表1。
图1 各组细胞TGF-β和CTGF western blot检测结果
表1 各组细胞TGF-β和CTGF western blot检测结果
2.2各组细胞TGF-β和CTGF实时定量RT-PCR检测结果高糖DMEM作用于NRK49f 12 h即可见TGF-β、CTGF mRNA表达均增加,随培养时间的延长,二者表达量持续增加,至高糖刺激培养细胞24 h及48 h时,二者相对表达量均明显高于对照组及高糖培养12 h组,差异均有统计学意义(P<0.05),见表2。
表2 各组细胞TGF-β和CTGF 实时定量RT-PCR检测结果
2.3各组细胞α-SMA表达检测结果Western blot检测结果显示,正常组NRK49f细胞未检测到α-SMA表达,高糖DMEM作用于NRK49f 24 h时可见α-SMA表达条带,至高糖DMEM培养48 h时,α-SMA表达量明显高于24 h高糖DMEM培养组,见图2。

图2 各组细胞α-SMA表达检测结果
3 讨论
肾间质纤维化是各种原因所致肾脏损伤的最终结果,肾间质成纤维细胞是肾间质纤维化的主要效应细胞。研究表明,糖尿病肾病大鼠肾间质中成纤维细胞明显增生及ECM生成,肾间质TGF-β、CTGF蛋白及mRNA表达亦明显增加[5,6]。李海剑等[7,8]通过体外实验证明,高糖可刺激肾间质成纤维细胞增殖及ECM表达。这些研究表明高糖可引发或加速肾间质纤维化进程。
TGF-β分子量25 kD,由两个分子量为12.5 kD的亚基通过二硫键连接而成的同源二聚体,二聚体形式的TGF-β才有生物活性。现已证明,TGF-β是肾间质纤维化过程中最重要的生长因子之一,在肾间质纤维化发生、发展的多个环节起作用。研究表明,TGF-β除直接刺激肾间质成纤维细胞ECM产生外,还可通过促进纤溶酶原激活物抑制物(PAI)和基质金属蛋白酶抑制物(TIMPs)的合成而减少ECM降解。CTGF是在TGF-β下游起作用的介质。在CTGF启动子上有一个特殊的TGF-β反应元件,TGF-β通过此元件诱导CTGF表达,促进肾间质纤维化的形成。黄海长等[9]的研究发现,CTGF可修饰或放大TGF-β1的促成纤维细胞生成作用。本研究中,高糖培养液作用于NRK49f 12 h即可见其TGF-β和CTGF的表达增加,并随培养时间的延长而继续增加,至24 h和48 h时,培养细胞TGF-β和CTGF的表达已明显高于对照组,表明在体外,高糖可明显刺激肾间质成纤维TGF-β和CTGF的转录和翻译水平。
α-SMA是常用的肌细胞特异性表达蛋白,常用于平滑肌细胞的鉴定。有研究发现,TGF-β、CTGF均可刺激大鼠肾脏成纤维细胞合成向肌成纤维细胞转分化,即由本来不表达α-SMA的肾小管成纤维细胞转分化为有α-SMA表达的肌成纤维细胞。本研究中,高糖刺激NRK49f 24 h后,NRK49f出现α-SMA的表达,表明其向肌成纤维细胞转分化。
综上所述,高糖可刺激体外培养的肾间质成纤维细胞表达TGF-β和CTGF的转录和翻译,并可刺激其表达α-SMA,这可能是糖尿病肾病致肾间质纤维化的机制之一。
参考文献:
[1]Lam S,van der Geest RN,Verhagen NA,et al.Secretion of collagen type IV by human renal fibroblasts is increased by high glucose via a TGF-beta-independent pathway[J].Nephrol Dial Transplant,2004,19(7):1694.
[2]Wang S,Denichilo M,Brubaker C,et al.Connective tissue growth factor in tubulointerstitial injury of diabetic nephropathy[J].Kidney Int,2001,60(1):96.
[3]Chao LK,Chang WT,Shih YW,et al.Cinnamaldehyde impairs high glucose-induced hypertrophy in renal interstitial fibroblasts[J].Toxicol Appl Pharmacol,2010,244(2):174.
[4]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(2):402.
[5]安 娜,刘惠兰,王 英.2型糖尿病肾病大鼠肾小管间质病变及TGF-β1、HGF和CTGF表达的变化及意义[J].首都医科大学学报,2008,29 (3):315.
[6]张树华,孙 冬,梅马琳,等.糖尿病大鼠肾脏纤维化与CTGF表达的相关性[J].中国循证心血管医学杂志,2013,5(2):190.
[7]程根阳,刘章锁,李海剑.罗格列酮对高糖环境大鼠肾脏成纤维细胞影响[J].医药论坛杂志,2009,19:12.
[8]郑朝晖,李海剑,刘章锁.罗格列酮对高糖环境下肾脏成纤维细胞表达细胞外基质的影响[J].中华肾脏病杂志,2006,22(9):574.
[9]杨 敏,黄海长,李惊子,等.结缔组织生长因子增强转化生长因子β-1促成肌纤维细胞生成的分子机理研究[C].“中华医学会肾脏病学分会年会”暨“全国中青年肾脏病学术会议”,2004.
